Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Method for Culture of Early Hühnerembryonen ex vivo (New Culture)
In diesem Artikel
Zusammenfassung
Dieses Video zeigt neue Kultur, eine Methode, durch die Hühnerembryonen außerhalb der Eizelle bis zu 24 h kultiviert. Diese Methode ermöglicht ein bis frühen Entwicklung (Primitivstreifens bis 14 som.), Ein Zeitraum entsprechend E7-9 in der Maus zu studieren. Anwendungen dieser Technik sind die Elektroporation, in situ Hybridisierung und Immunhistochemie.
Zusammenfassung
Der Hühnerembryo ist ein wertvolles Werkzeug in der Studie der frühen Embryonalentwicklung. Seine Transparenz, Zugänglichkeit und einfache Handhabung machen ihn zu einem idealen Werkzeug zur Untersuchung der Bildung und Strukturierung des Gehirns, Neuralrohr, Somiten und Herz Primordien. Anwendungen von Hühnerembryonen Kultur gehören die Elektroporation von DNA-oder RNA-Konstrukte, um Genfunktionen, Transplantate growth factor Kügelchen wie FGFs und BMPs sowie whole mount in situ Hybridisierung und Immunhistochemie analysiert. Dieses Video zeigt die verschiedenen Schritte in Hühnerembryo Kultur; Erste, der Embryo in Kochsalzlösung explantiert. Dann wird der Embryo auf einem Glasring zentriert. Die Membranen um den Embryo sind die Wände entlang des Rings aufgehoben. Der Ring wird dann in einer Kulturschale mit einem Pool von Albumin platziert. Die Kulturschale wird verschlossen und in einer feuchten Kammer, wo der Embryo bis zu 24 Stunden kultiviert. Schließlich ist der Embryo vom Ring entfernt, fixiert und für weitere Anwendungen. Ein Leitfaden für die Fehlersuche wird ebenfalls vorgestellt.
Protokoll
Teil 1: Bench einrichten
- Eine feuchte Kammer, indem Kimwipe / ddH 2 O in Kunststoff-Kammer vorbereitet.
- Eine Falcon-Röhrchen an Albumin, Geschirr für Kultur, Ringe, Uhrglas und Entsorgung sammeln auf der Bank platziert.
- Pyrex Schüssel wird mit 1,4 l Kochsalzlösung gefüllt (siehe Erläuterungen [a]).
Teil 2: Embryo ist in Kochsalzlösung explantierten
- Die Eier werden aus dem Inkubator nach 16 Stunden (Stufe 4) entfernt. Das Ei ist, offener, indem Sie die Schale mit einer Pinzette. Shell Stück entfernt werden.
- Die dünne Albumin ist in Falcon-Röhrchen gesammelt. Die dicken Albumin ist mit einer Pinzette entfernt.
- Der Embryo wird in einer Plastikschale in der Saline Schale gelegt. Die verbleibenden Albumin ist mit einer Pinzette entfernt.
Teil 3: Embryo ist am Ring zentriert
- Der Dottersack wird mit einer Pinzette so geneigt, dass Embryos nach oben zeigt.
- Der Dottersack ist auf der Ebene des Äquators oder unten abgeschnitten.
- Mit feinen Pinzetten, ist die Dotterhaut schnell geschält. Die Dotterhaut ist so, dass seine körnigen Seite (nicht shinny) nach oben zeigt orientiert.
- Mit feinen Pinzetten, ist die Dotterhaut auf dem Uhrglas gelegt.
- Mit feinen Pinzette, ein Glas Ring an der Oberseite der Dotterhaut aufgetragen und der Embryo ist zentriert.
- Die Dotterhaut ist an den Kanten des Glases Ring gehoben. Die Montage wird von der Saline Gericht entfernt.
Teil 4: Die Kultur wird unter dem Mikroskop eingestellt
- Die Dotterhaut wird über den Glasring mit feinen Pinzetten unter dem Mikroskop angehoben.
- Mit Pasteurpipette wird die Kochsalzlösung aus dem äußeren Rand des Ringes entfernt.
- Mit einer feinen Schere wird überschüssige Dotterhaut von der Innenkante des Glases Ring entfernt. Care ist nicht zu durchdringen die Membran mit Pipette oder einer Zange genommen.
- Der Embryo wird vorsichtig mit Kochsalzlösung gespült, um lose Membranen und Dotter Zellen zu entfernen.
- 200 ul Kochsalzlösung zu den äußeren Rand des Ringes (dies wird später Transfer zu erleichtern) aufgenommen.
- Die Montage erfolgt mit einem umgekehrten Plastikschale bedeckt.
Teil 5: Die Kultur ist Inkubator überführt
- Eine Falcon Kulturschale gekennzeichnet ist.
- 2,5 ml dünne Albumin ist an der Unterseite des Falcon Gericht aufgenommen.
- 200 ul von dünnen Albumin ist an der inneren Kante des Deckels der Falcon Gericht aufgenommen.
- Die invertierte Gericht ist aus dem Verbund lösen.
- Mit feinen Pinzette wird das Glas Ring entlang der Kante des Uhrglas geschoben, und an den Falcon Gericht.
- Alle übrigen Kochsalzlösung ist von der Innenfläche des Ringes entfernt.
- Die Falcon Gericht ist mit Deckel abgedeckt und versiegelt.
- Die Montage erfolgt in feuchten Kammer und dann in den Brutschrank gestellt.
- Die Embryonen werden für bis zu 24 Stunden bei 38 ° C kultiviert
Teil 6: Im Anschluss an Kultur, ist der Embryo fixiert; Kultur ist Inkubator überführt
- Eine Fixierung Gericht wird mit eiskaltem PBS gefüllt (oder DEPC-PBS, wenn Embryonen für die in-situ-Hybridisierung verarbeitet werden sollen).
- Die Kultur ist aus dem Brutschrank entnommen und sofort auf Eis gelegt. Die Kulturschale wird sofort mit eiskaltem PBS / DEPC-PBS gefüllt.
- Der Embryo ist von der Dotterhaut abgelöst. Der Embryo wird die Fixierung Schale überführt, mit dem stumpfen Ende einer Pasteurpipette.
- Der Embryo wird nach unten mit stumpfem Ende feinen Pinzette merken. Die PBS für die Fixierung Schale wird entfernt. Fixativ gegeben wird (siehe Anhang [b]).
- Je nach Anwendung wird der Embryo für 6-8 Stunden bei 4 ° C fixiert (Kryostat), O / N bei 4 ° C (in situs), oder 1 Stunde bei RT für ganze Berg Immunhistochemie.
- Der Fixateur wird entfernt und mit eiskaltem PBS / DEPC PBS ersetzt.
- Für Downstream-Anwendungen wie in-situ-Hybridisierung oder immantibody Färbung: das Nervensystem und das Herz sind perforiert mit einem stumpfen Ende Mikrokapillare Nadel oder ein Mikrodissektion Messer, das wird verhindern, Abfangen von Sonde / Antikörper in späteren Schritten.
Anmerkungen: [a] Saline besteht aus: Lösung A (für 1 l): 121,0 g NaCl, 15,5 g KCl, 10,4 g CaCl 2 .2 H 2 O, 12,7 g MgCl 2 .6 H 2 O; Lösung B (für 1 l) : 2,4 g Na 2 HPO 4 · 2H 2 O, 0,2 g NaH 2 PO 4 · 2H 2 O; Autoclave; Vor dem Gebrauch mischen 120 ml A mit 2700 ml H 2 O; Add 180 ml B. Mix [1]; [b] Fixativ ist unmittelbar vor Gebrauch vorbereitet (4% PFA in PBS oder DEPC-PBS für in situs).
Teil 7: Repräsentative Ergebnisse
Vor Kultur, ist der Embryo in Primitivstreifens Stufe (HH4). Am Ende der Kultur Zeit hat der Embryo HH10 (Länge 2-3 mm) entwickelt und wird sichtbar in der Mitte der Kulturschale. Es ist möglich, eine Gruppe von Zellen mit fluoreszierenden Carbocyanin DiI Labelkurz vor dem Kultur (0h) und folgen ihrer Bewegung während der Kulturzeit. In diesem Fall wurden die Zellen unter Hensen den Knoten (HN) mit DiI markiert. Diese Zellen sind nachweislich auf eine stufenweise Entwicklung Somiten (som) und Chorda (n) beitragen. 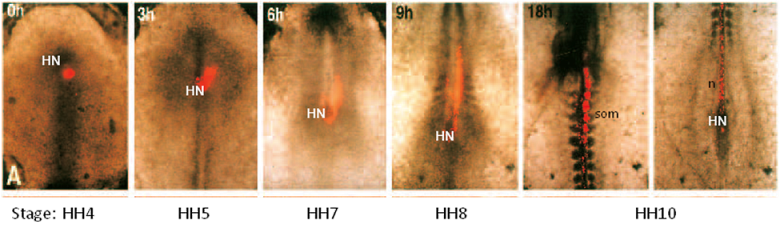
Teil 8: Fehlersuche
| Problem | Ursache | Abhilfe |
|---|---|---|
| Embryo bleibt mit Eigelb statt kommenden off mit Membran (Schritt 2) | Schlechte Qualität von Eiern | Shop Eier bei 13 ° C nach Erhalt; Anfrage frisch produzierten Eier. Inkubieren Eier am selben Tag wie Anreise. |
| Dotterhaut Rutsche vom Uhrmacher Glas folgende Platzierung der Ring (Schritt 3) | Albumin Reste | In Schritt 2, um sicherzustellen, dass alle Albumin, indem Sie sie weg von Membran mit gekippten Pinzette entfernt |
| Embryo nicht zugänglich ist: liegt unterhalb der Membran (Schritt 4) | Falschen Seite der Membran wird nach oben | In Schritt 3 sicher, dass die Seite der Membran mit Dotterschollen nach oben zeigt. Die glänzende, polierte Seite sollte nach unten zeigen. |
| Embryo in Kochsalzlösung / Albumin folgenden Kultur eingetaucht (Schritt 6) | Saline / Albumin linken inneren Ring vor Kultur, Loch in der Membran | In Schritt 5 Stellen Sie sicher, dass alle Albumin / Kochsalzlösung aus dem Inneren des Ringes wird entfernt; In Schritt 4, sicherzustellen, dass Sie nicht gewaltsam öffnen Membran mit einer Pinzette (Einsatz mit stumpfen Enden Zangen) |
| Embryo zerfiel nach Kultur | Bakterielle Infektion | Sterilisieren Sie alle Werkzeuge und Glaswaren; Verwenden Antibiotikum / Antimykotikum |
Diskussion
Die neue Kultur-Methode 2 kann für eine Vielzahl von Anwendungen, von der Transplantate Wachstumsfaktor mit Perlen 3, um whole mount in situ Hybridisierung und Immunhistochemie ganze Berg 4 verwendet werden. Kultur über einen 24-Stunden-Periode ermöglicht die kontinuierliche Überwachung der embryonalen Entwicklung in Anwendungen wie Zeitraffer Zellbewegung Analyse 5 oder Überwachung von GFP mit elektroporiert Konstrukte 6.
Danksagungen
Diese Arbeit wurde von der Margaret M. Alkek Stiftung RHF unterstützt.
Materialien
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Tool | Lyon | RX | |
| Hybridization Incubator | Tool | Robbins Scientific, SciGene | M1000 | |
| Pyrex dish (2) | Tool | |||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Surgery | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Surgery | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Sharpening Stone Dan’s Black Arkansas | Surgery | Electron Microscopy Sciences | 62082-00 | |
| Fine scissors | Surgery | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microcapillary tube | Surgery | Sigma-Aldrich | P1049-1PAK | Pull using vertical micropipette puller; blunt end with fine forceps |
| Microdissecting knife | Surgery | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Surgery | Fine Science Tools | 26002-20 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave |
Referenzen
- Pannett, P. A., Compton, C. A. The cultivation of tissues in saline. Lancet. 206, 381-384 (1924).
- New, D. T. A new technique for the cultivation of the chick embryo in vitro. J. Embryol. Exp. Morph. 3, 326-331 (1955).
- Alvarez, I. S., Araujo, M., Nieto, M. A. Neural induction in whole chick embryo cultures by FGF. Dev. Biol. 199, 42-54 (1998).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
- Psychoyos, D., Stern, C. D. Fates and migratory routes of primitive streak cells in the chick embryo. Development. 122, 1523-1534 (1996).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nature Protoc. 3, 419-426 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten