Gelöster Sauerstoff im Wasser
Überblick
Quelle: Labors von Margaret Workman und Kimberly Frye - Depaul University
Gelöster Sauerstoff (DO) Messungen berechnen die Höhe der gasförmigen Sauerstoff aufgelöst im Wasser, die wichtig für alle Sauerstoff-Atmung Leben in Flussökosysteme, einschließlich Fischarten bevorzugt für den menschlichen Verzehr (z. B. Sonnenbarsch und Bass), sowie Zersetzung Arten für das recycling von biogeochemischen im System von entscheidender Bedeutung ist.
In Seen, Flüssen und Ozeanen gelöste Sauerstoff ist entscheidend für die Organismen und Lebewesen in ihr Leben. Als die Menge an gelöstem Sauerstoff unter das normale Niveau in Gewässern fällt, die Wasserqualität wird geschädigt und Kreaturen beginnen zu sterben. In einem Prozess namens Eutrophierung eines Gewässers kann hypoxischen werden und werden nicht mehr in der Lage, Lebewesen, im wesentlichen immer eine "Tote Zone".
Eutrophierung tritt auf, wenn überschüssige Nährstoffe Algen Bevölkerung rasant in eine Algenblüte verursachen. Die Algenblüte bildet dichte Teppiche an der Oberfläche des Wassers Ausblocken zwei wesentliche Vorleistungen von Sauerstoff für Wasser: gas-Austausch aus der Atmosphäre und Photosynthese im Wasser durch den Mangel an Licht unter die Matten. Als gelöster Sauerstoff sinken Ebenen unterhalb der Oberfläche, Sauerstoff-Atmung Organismen Absterben in großen Mengen, erstellen eine Zunahme an organischen Stoffen. Die überschüssige organischer Ursachen eine Erhöhung der Sauerstoff-Atmung Zersetzung Populationen in die benthische Zone, die weiter die restlichen gelösten Sauerstoffs verbraucht während der Zersetzung der metabolischen Aktivität Ebenen. Sobald der Sauerstoffgehalt werden werden dieser niedrigen, mobile Sauerstoff-Atmung-Arten (z.B. Fisch), wegziehen verlassen keine aeroben Leben im Wasser und eine tote Zone zu schaffen.
Die Azid-Winkler Titrierung Methode verwendet Titration die Konzentration eines unbekannten in einer Probe zu bestimmen. Insbesondere dient Natriumthiosulfat Jod, titrieren, die stoichiometrically auf die Menge an gelöstem Sauerstoff in einer Probe bezogen werden können.
Grundsätze
Die Azid-Winkler-Methode dient zur vor Ort Messen wo Oberflächenwasser gesammelt wird. Manganese(II) Sulfat und Kaliumhydroxid sind hinzugefügt, um die Probe, und die gelösten Sauerstoffs in der Probe das Mangan oxidiert und bildet einen braunen Niederschlag. Natriumazid wird hinzugefügt, in Form von gekauften alkalischen Jodid-Azid Reagenzien für die Anwesenheit von Nitrit, korrigieren, die findet man in Abwasserproben und Winkler Oxidation Verfahren stören können.
MnSO4 + 2 KOH  Mn(OH)2 + K2SO4
Mn(OH)2 + K2SO4
4 Mn(OH)2 + 2 H2O O2  4 Mn(OH)3
4 Mn(OH)3
Schwefelsäure wird dann zum Ansäuern der Lösung hinzugefügt, und der Niederschlag löst sich. Unter diesen Bedingungen wird die Jodid aus der alkalischen Jodid-Azid-Reagenz in der Lösung in Iod umgewandelt.
2 Mn(OH)3 + 3 H2SO4  Mn2(also4)3 + 6 H2O
Mn2(also4)3 + 6 H2O
MN2(also4)3 + 2 KI  2 MnSO4 + K2SO4 + 2 I2
2 MnSO4 + K2SO4 + 2 I2
Thiosulfat wird dann verwendet, um das Jod in der Gegenwart eine zusätzliche Stärke-Indikator titrieren.
4 Na2S2O3 + 2 I2  2 Na2S4O6 + 4 NaI
2 Na2S4O6 + 4 NaI
4 Mol S2O32 -  1 Mol O2
1 Mol O2
Am Endpunkt dieser Titration leuchtet die blaue Lösung klar. Die Menge an gelöstem Sauerstoff in der Probe wird quantifiziert, in direktem Verhältnis zu der Menge an Thiosulfat erforderlich, um den Endpunkt zu erreichen.
X mL S2O3  X mg/L O:
X mg/L O:
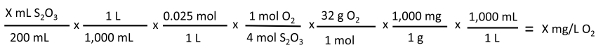
Verfahren
1. Probe gelösten Sauerstoffmessung
- Am Entnahmeort Wasser mithilfe einer kalibrierten Pipette hinzu, 2 mL manganous Sulfat, eine klare 300-mL-BSB-Flasche mit dem Probenwasser gefüllt. Achten Sie darauf, dass Sie nicht Sauerstoff in die Probe durch Einsetzen der Pipettenspitze unter der Oberfläche der Probe und sorgfältig dosieren manganous Sulfat einzuführen. Dadurch wird vermieden, Bläschen zu schaffen, bis die Probe "fest ist" und Änderung auf die Konzentration des gelösten Sauerstoffs verhindert.
- Mit der gleichen Technik, fügen Sie 2 mL alkalische Jodid-Azid Reagenz.
- Legen Sie sofort den Stopper, kippen die Flasche leicht und schnell Druck des Stoppers an Stelle also keine Luftblasen in der Flasche gefangen sind.
- Sorgfältig zu invertieren, mehrmals (ohne Luftblasen) zu mischen. Ein Floccule (Floc) bilden eine gefällte Aggregation über Material mit ein trübes Aussehen (Abbildung 1).
- Warten Sie, bis die Floc in die Lösung gelegt hat. Wieder, invertieren Sie die Flasche mehrmals und warten Sie, bis die Floc niedergelassen hat. Die Probe kann ist nun behoben, um gelösten Sauerstoffgehaltes zu verhindern und zurück ins Labor transportiert und gespeichert für bis zu 8 h, bei Bedarf, in einem kühlen und dunklen Zustand.
- Wenn speichern, Proben sollten versiegelt werden mit einem kleinen Betrag von entionisiertem Wasser gespritzt, um den Anschlag und der Stopfen in Alufolie eingewickelt werden, mit einem Gummiband gesichert.
- Pipette 2 mL konzentrierte Schwefelsäure in die Probe halten die Pipettenspitze knapp über der Oberfläche der Probe. Invertieren Sie sorgfältig mehrmals Floc (Abbildung 2) aufzulösen.
- Titrieren Sie in einem Glaskolben, und mit einer kalibrierten Pipette 200 mL Probenwasser mit 0,025 N Natriumthiosulfat, standardisiert, wirbeln und mischen bis eine blasse Stroh Farbe bildet (Abbildung 3) kontinuierlich.
- Fügen Sie 2 mL Stärkelösung Indikator mit einer Pipette und wirbeln um zu mischen. Einmal die Stärke Indikator hinzugefügt, die Lösung färbt sich blau (Abbildung 4).
- Weiter die Titration, hinzufügen ein Tropfen nacheinander, bis ein Tropfen blau, wodurch die farblosen Endpunkt zerstreut. Achten Sie darauf, jeden Tropfen des Titriermittel sorgfältig hinzuzufügen und zu jedem Tropfen gleichmäßig zu mischen, bevor Sie den nächsten hinzufügen. Mit der Probe gegen ein weißes Blatt Papier kann helfen, Visualisierung des Endpunkts zu verbessern.
- Die Konzentration von entspricht das Volumen (mL) der Titriermittel verwendet. Jeder Milliliter Natriumthiosulfat hinzugefügt, um das Wasser Probe entspricht 1 mg/L gelösten Sauerstoff.

Abbildung 1. Eine Probe nach der alkalischen Jodid-Azid-Reagenz wurde aufgenommen und gemischt, zeigt Floc Bildung an der Spitze der Probe, bevor er sich.

Abbildung 2. Eine Probe mit gelösten Floc nach Zugabe von Schwefelsäure.

Abbildung 3. Eine Probe nach Zugabe von Natriumthiosulfat eine blasse Stroh Farbe anzeigen.

Abbildung 4. Ein Beispiel zeigt die blaue Farbe, nachdem die Stärke-Indikator und gemischt ist.
Ergebnisse
Ein gelöster Sauerstoff-Niveau von 6 mg/L ist ausreichend für die meisten Wassertieren. Gelöster Sauerstoff-Niveaus unter 4 mg/L sind belastend für die meisten Wassertiere. Gelöster Sauerstoff-Niveaus unter 2 mg/L unterstützt keine aeroben Lebewesen (Abbildung 5).
Die maximale Menge an Sauerstoff, die in Wasser aufgelöst werden kann, variiert je nach Temperatur (Tabelle 1).
-Messungen in mg/L sind in % Sättigung mit Wassertemperatur und die Umrechnungstabelle unter (Abbildung 6) konvertiert.
GELÖSTEN SAUERSTOFF-NIVEAUS (% SÄTTIGUNG)
Ausgezeichnet: 91 – 110
Gut: 71-90
Messe: 51 – 70
Schlecht: < 50
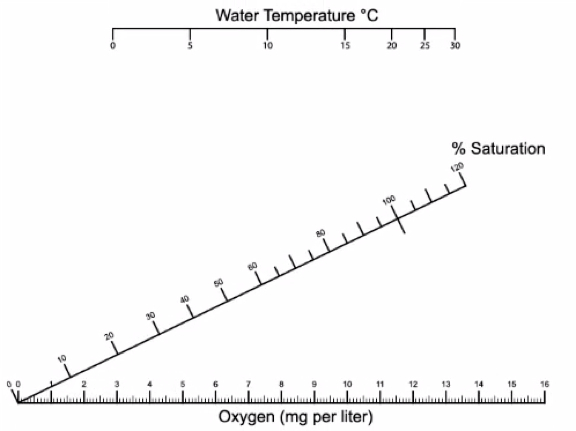
Abbildung 5. SIND Messungen in % Sättigung mit der Wassertemperatur umgewandelt werden. Die Wassertemperatur auf die obere horizontale Achse und dem-Messwert auf der unteren horizontalen Achse. Verwenden Sie ein Lineal zeichnen Sie eine Linie zwischen den beiden Werten und aufzeichnen, wo die Linie die Diagonale Mittelachse für % Sättigung trifft.
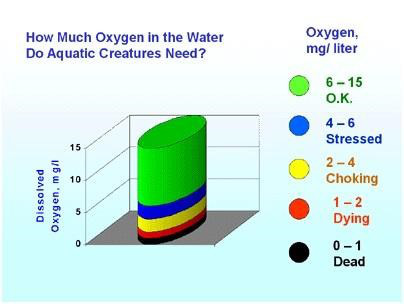
Abbildung 6. Ein gelöster Sauerstoff-Niveau von 6 mg/L ist ausreichend für die meisten Wassertieren. Gelöster Sauerstoff-Niveaus unter 4 mg/L sind belastend für die meisten Wassertiere. Gelöster Sauerstoff-Niveaus unter 2 mg/L werden keine Unterstützung für Fisch und unter 1 mg/L werden keine Unterstützung für die meisten Arten.
| Temp. (° C) | (Mg/L) | Temp. (° C) | (Mg/L) | Temp. (° C) | (Mg/L) | Temp. (° C) | (Mg/L) |
| 0 | 14.60 | 11 | 11.01 | 22 | 8.72 | 33 | 7.16 |
| 1 | 14.19 | 12 | 10,76 | 23 | 8,56 | 34 | 7.16 |
| 2 | 13.81 | 13 | 10,52 | 24 | 8.40 | 35 | 6,93 |
| 3 | 13.44 | 14 | 10,29 | 25 | 8.24 | 36 | 6.82 |
| 4 | 13.09. | 15 | 10.07 | 26 | 8.09 | 37 | 6,71 |
| 5 | 12,75 | 16 | 9,85 | 27 | 7.95 | 38 | 6.61 |
| 6 | 12,43 | 17 | 9.65 | 28 | 7,81 | 39 | 6.51 |
| 7 | 12.12 | 18 | 9.45 Uhr | 29 | 7,67 | 40 | 6.41 |
| 8 | 11,83 | 19 | 9.26 | 30 | 7,54 | 41 | 6.41 |
| 9 | 11,55 | 20 | 9.07. | 31 | 7.41 | 42 | 6.22 |
| 10 | 11.27 | 21 | 8.90 | 32 | 7.28 | 43 | 6.13 |
Tabelle 1. Maximale Mengen an Sauerstoff, die im Wasser durch Temperatur aufgelöst werden können.
Anwendung und Zusammenfassung
Langsam-bewegenden Flüssen sind besonders anfällig für niedrige, und in extremen Fällen können diese-Ebenen führen zu hypoxischen Bedingungen, Schaffung von "toten Zonen" wo aerobe Leben nicht mehr von einem Körper des Wassers (Abbildung 7) unterstützt wird. Einmal Tiere und Pflanzen absterben, der Aufbau von Sediment, das auftritt, kann auch zu einer Erhöhung des Flussbetts, so dass Pflanzen, über das Wasser zu kolonisieren und könnte zum Verlust des Flusses alle zusammen (Abbildung 8). Oberflächengewässer in höheren Lagen sind auch anfälliger für niedrige wie Luftdruck mit zunehmender Höhe abnimmt und weniger Sauerstoff im Wasser ausgesetzt ist.
TUN, Low Level unterstützen Lebensformen als unsympathisch oder ungeeignet für den menschlichen Gebrauch, einschließlich der Blutegel und aquatischen Würmer (Wenigborster).
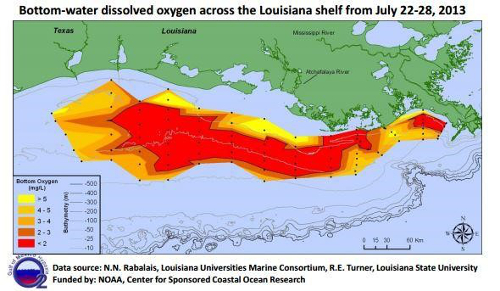
Abbildung 7. Karte von gelöstem Sauerstoff-Konzentrationen über dem Louisiana-Regal zeigt die tote Zone Region.

Abbildung 8. Foto des Kaspischen Meeres zeigen starke Eutrophierung im Nordende.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Gelöster Sauerstoff im Wasser
Environmental Science
55.8K Ansichten

Identifikation von Bäumen: Wie man einen dichotomen Bestimmungsschlüssel verwendet
Environmental Science
81.3K Ansichten

Analyse der Baumzusammensetzung eines Waldes
Environmental Science
49.4K Ansichten

Verwendung von GIS zur Untersuchung urbaner Forstwirstschaft
Environmental Science
12.6K Ansichten

Polymerelektrolytbrennstoffzelle
Environmental Science
22.1K Ansichten

Biokraftstoffe: Herstellung von Ethanol aus Zellulose-Material
Environmental Science
53.3K Ansichten

Tests für gentechnisch veränderte Lebensmittel
Environmental Science
89.8K Ansichten

Trübung und Trockenmasse in Oberflächengewässern
Environmental Science
35.9K Ansichten

Nährstoffe in aquatischen Ökosystemen
Environmental Science
38.9K Ansichten

Messung von bodennahem Ozon
Environmental Science
26.5K Ansichten

Bestimmung von NOX in Autoabgasen mittels UV/Vis-Spektroskopie
Environmental Science
30.1K Ansichten

Bleianalyse von Böden mittels Atomabsorptionsspektroskopie
Environmental Science
125.5K Ansichten

Kohlenstoff und Stickstoff-Analyse von Umweltproben
Environmental Science
29.5K Ansichten

Nährstoffanalyse des Bodens: Stickstoff, Phosphor und Kalium
Environmental Science
216.0K Ansichten

Analyse der Regenwurm-Populationen im Boden
Environmental Science
16.5K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten