Sales con iones ácidos
Las sales son compuestos iónicos formados por cationes y aniones, cualquiera de los cuales puede ser capaz de sufrir una reacción de ionización ácida o básica con agua. Las soluciones acuosas de la sal, por lo tanto, pueden ser ácidas, básicas, o neutras, dependiendo de las fuerzas relativas ácido-base de los iones constituyentes de la sal. Por ejemplo, la disolución del cloruro de amonio en el agua produce su disociación, tal como se describe en la ecuación:
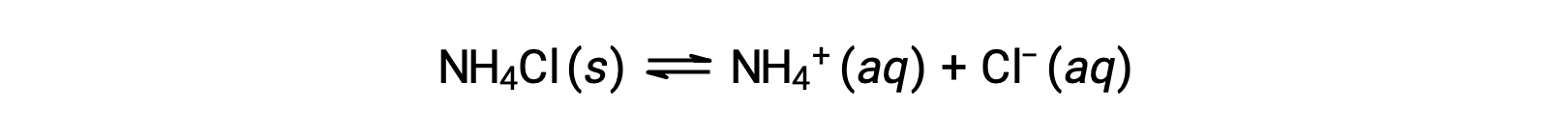
El ion amonio es el ácido conjugado de la base amoníaco, NH3; su reacción de ionización ácida (o hidrólisis ácida) está representada por
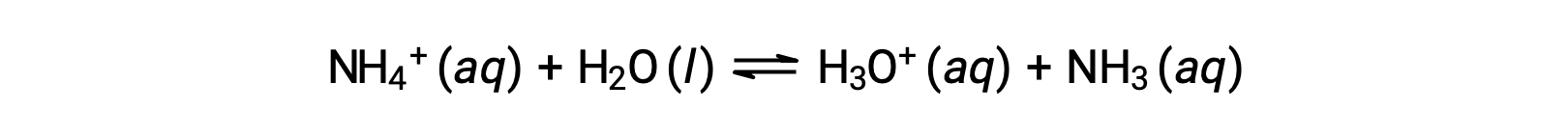
Dado que el amoníaco es una base débil, Kb es mensurable y Ka > 0 (el ion amonio es un ácido débil).
El ión cloruro es la base conjugada del ácido clorhídrico, por lo que su reacción de ionización básica (o hidrólisis básica) está representada por
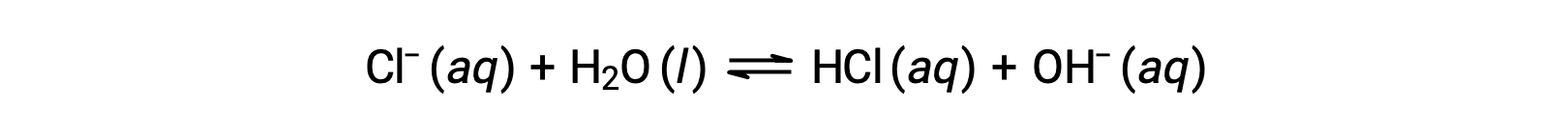
Dado que el HCl es un ácido fuerte, el Ka es inmensurablemente grande y el Kb ≈ 0 (los iones de cloruro no experimentan hidrólisis apreciable). Por lo tanto, la disolución del cloruro de amonio en el agua produce una solución de cationes ácidos débiles (NH4+) y aniones inertes (Cl−), lo que resulta en una solución ácida.
Sales con iones básicos
Como otro ejemplo, considere disolver el acetato de sodio en agua:
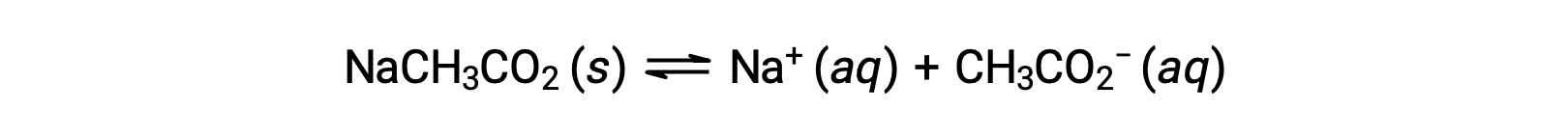
El ion sodio no se somete a una ionización apreciable de ácido o base y no tiene ningún efecto en el pH de la solución. Esto puede parecer obvio a partir de la fórmula del ión, que indica que no hay átomos de hidrógeno u oxígeno, pero algunos iones de metal disuelto funcionan como ácidos débiles, como se trata más adelante en esta sección. El ion acetato, CH3CO2−, es la base conjugada del ácido acético, CH3CO2H, por lo que su reacción de ionización básica (o hidrólisis básica) se representa mediante
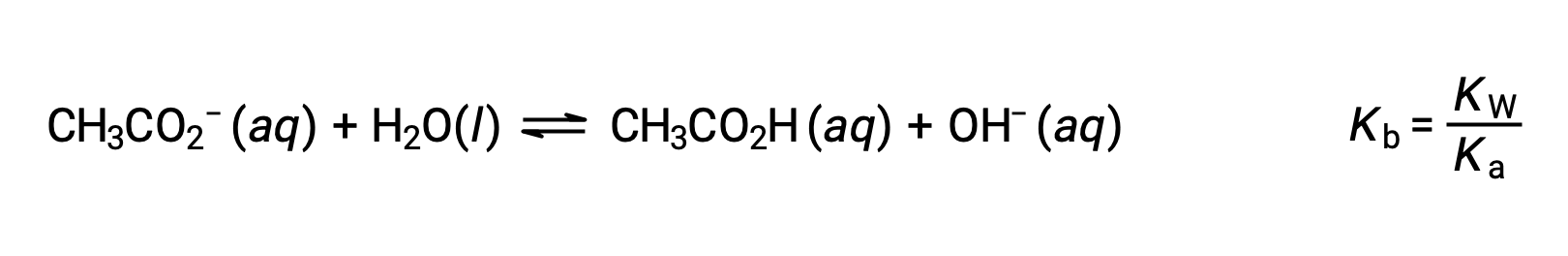
Debido a que el ácido acético es un ácido débil, su Ka es mensurable y su Kb > 0 (el ion acetato es una base débil). La disolución de acetato de sodio en agua produce una solución de cationes inertes (Na+) y aniones básicos débiles (CH3CO2−), lo que resulta en una solución básica.
Sales con iones ácidos y básicos
Algunas sales están compuestas de iones ácidos y básicos, por lo que el pH de sus soluciones dependerá de las fuerzas relativas de estas dos especies. Para este tipo de sales, una comparación de los valores de Ka y Kb permite predecir el estado ácido-base de la solución.
La ionización de iones metálicos hidratados
A diferencia de los iones metálicos de los grupos 1 y 2 de los ejemplos anteriores (Na+, Ca2+, etc.), algunos iones metálicos funcionan como ácidos en soluciones acuosas. Estos iones no sólo son solvatados libremente por moléculas de agua cuando se disuelven; en su lugar están covalentemente unidos a un número fijo de moléculas de agua para producir un ión complejo (ver el capítulo sobre química de coordinación). Como ejemplo, la disolución de nitrato de aluminio en agua se representa típicamente como

Sin embargo, el ion aluminio (III) reacciona realmente con seis moléculas de agua para formar un ion complejo estable, y por lo tanto la representación más explícita del proceso de disolución es
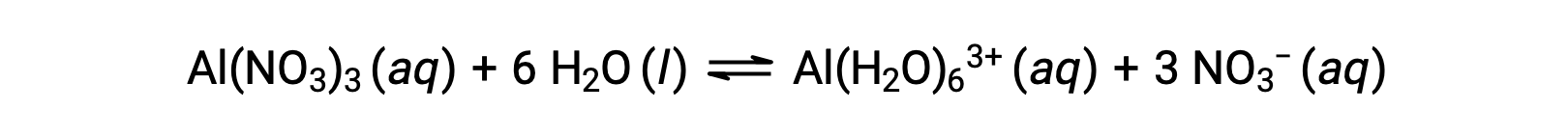
Los iones Al(H2O)63 involucran enlaces entre un átomo central de Al y los átomos de O de las seis moléculas de agua. En consecuencia, los enlaces O–H de las moléculas de agua unidas son más polares que en las moléculas de agua no unidas, lo que hace que las moléculas unidas sean más propensas a la donación de un ion hidrógeno:
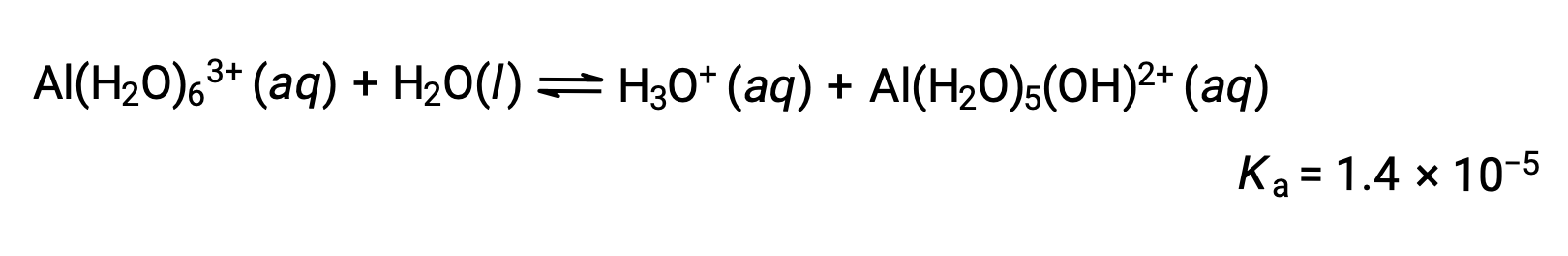
La base conjugada producida por este proceso contiene otras cinco moléculas de agua unidas capaces de actuar como ácidos, por lo que la transferencia secuencial o gradual de protones es posible como se muestra en pocas ecuaciones a continuación:
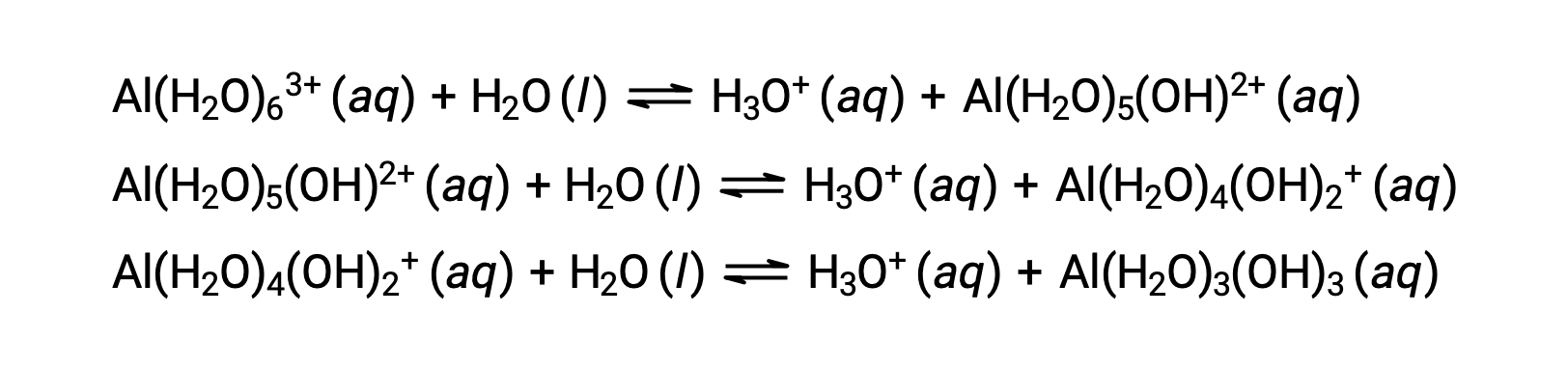
Aparte de los metales alcalinos (grupo 1) y algunos metales alcalinotérreos (grupo 2), la mayoría de los otros iones metálicos sufrirán ionización ácida en cierta medida cuando se disuelven en agua. La fuerza ácida de estos iones complejos normalmente aumenta con el aumento de la carga y la disminución del tamaño de los iones metálicos. A continuación se muestran las ecuaciones de ionización ácida de primer paso para otros iones metálicos ácidos:
| Ecuaciones de ionización de primer paso | pKa |
| Fe(H2O)63+ (ac) + H2O(l) ⇌ H3O+ (ac) + Fe(H2O)5(OH)2+ (ac) | 2,74 |
| Cu(H2O)62+ (ac) + H2O(l) ⇌ H3O+ (ac) + Cu(H2O)5(OH)+ (ac) | ~6,3 |
| Zn(H2O)42+ (ac) + H2O (l) ⇌ H3O+ (ac) + Zn(H2O)3(OH)+ (ac) | 9,6 |
Este texto es adaptado de Openstax, Química 2e, Sección 14.4: Hidrólisis de las sales.
Del capítulo 15:

Now Playing
15.10 : Los Iones como Ácidos y Bases
Ácidos y bases
22.9K Vistas

15.1 : Ácidos y Bases de Bronsted-Lowry
Ácidos y bases
88.8K Vistas

15.2 : Fuerzas de Ácidos/Bases y Constantes de Disociación
Ácidos y bases
59.4K Vistas

15.3 : El Agua: Un Ácido y Una Base de Bronsted-Lowry
Ácidos y bases
48.9K Vistas

15.4 : Escala del pH
Ácidos y bases
67.1K Vistas

15.5 : Fuerza Relativa de los Pares Ácido-Base Conjugados
Ácidos y bases
44.6K Vistas

15.6 : Soluciones de Ácidos y Bases Fuertes
Ácidos y bases
30.7K Vistas

15.7 : Soluciones de Ácidos Débiles
Ácidos y bases
37.0K Vistas

15.8 : Soluciones de Bases Débiles
Ácidos y bases
22.0K Vistas

15.9 : Mezclas de Ácidos
Ácidos y bases
19.3K Vistas

15.11 : Determinando el pH de las Soluciones Salinas
Ácidos y bases
42.9K Vistas

15.12 : Ácidos Polipróticos
Ácidos y bases
28.4K Vistas

15.13 : Fuerza y Estructura Molecular de los Ácidos
Ácidos y bases
30.3K Vistas

15.14 : Ácidos y Bases de Lewis
Ácidos y bases
42.5K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados