13.6 : Vida Media de una Reacción
La vida media o semivida de una reacción (t1/2) es el tiempo necesario para que se consuma la mitad de una cantidad determinada de reactivo. En cada semivida posterior, se consume la mitad de la concentración restante del reactivo. Por ejemplo, durante la descomposición del peróxido de hidrógeno, durante la primera semivida (de 0,00 horas a 6,00 horas), la concentración de H2O2 disminuye de 1,000 M a 0,500 M. Durante la segunda semivida (de 6,00 horas a 12,00 horas), la concentración disminuye de 0,500 M a 0,250 M, mientras que durante la tercera semivida, cae de 0,250 M a 0,125 M. Por lo tanto, durante cada período sucesivo de 6,00 horas, la concentración de H2O2 disminuye a la mitad.
La vida media de una reacción de primer orden es independiente de la concentración del reactivo. Sin embargo, la semivida de las reacciones de otros órdenes depende de las concentraciones de los reactivos.
Vida media de las reacciones de primer orden
Una ecuación que relaciona la vida media de una reacción de primer orden con su constante de velocidad puede derivarse de su ley de velocidad integrada:
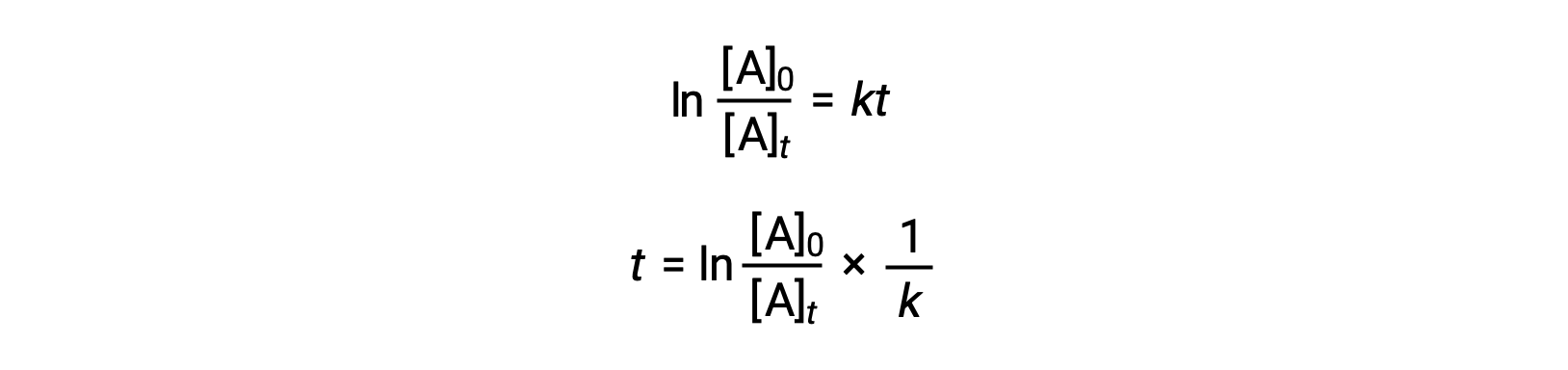
Según la definición de semivida, en el tiempo t1/2, la concentración del reactivo A es la mitad de su concentración inicial. Por lo tanto, t = t1/2y [A]t = ½ [A]0.
Si se sustituyen estos términos en la ley de velocidad integrada reorganizada y se simplifica, se obtiene la ecuación de semivida:
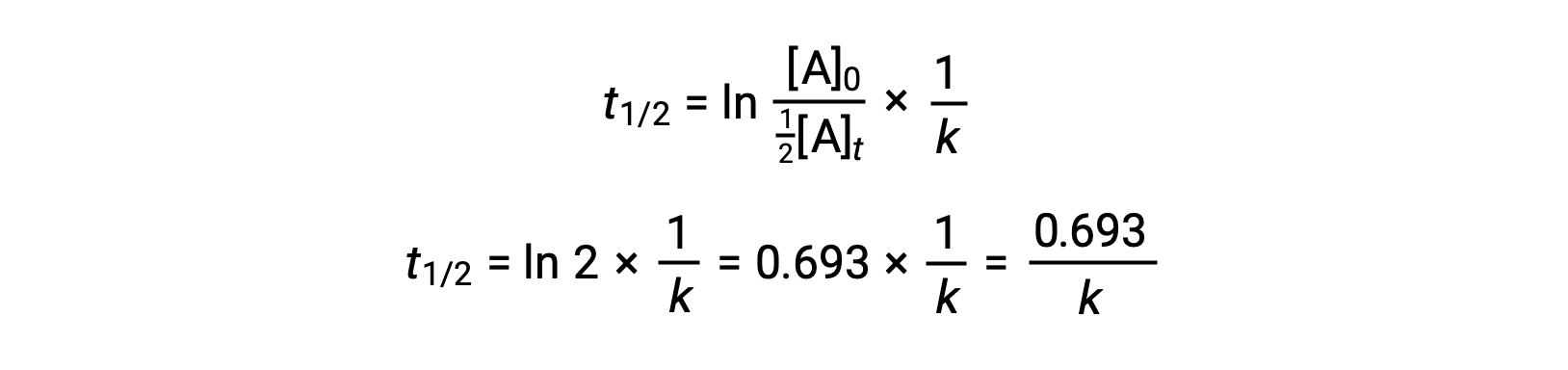
Esta ecuación de semivida describe una relación inversa esperada entre la semivida de la reacción y su constante de velocidad, k. Las reacciones más rápidas muestran constantes de velocidad más grandes y, en consecuencia, semividas más cortas, mientras que las reacciones más lentas muestran constantes de velocidad más pequeñas y semividas más largas.
Vida media de las reacciones de segundo orden
Siguiendo el mismo enfoque que para las reacciones de primer orden, una ecuación que relaciona la vida media de una reacción de segundo orden con su constante de velocidad y concentración inicial puede derivarse de su ley de velocidad integrada:
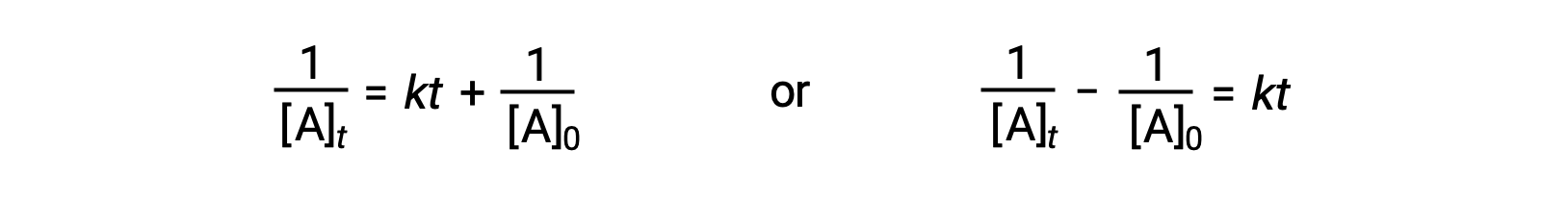
Al sustituir t = t1/2y [A]t = ½[A]0, se simplifica la ley de velocidad integrada:
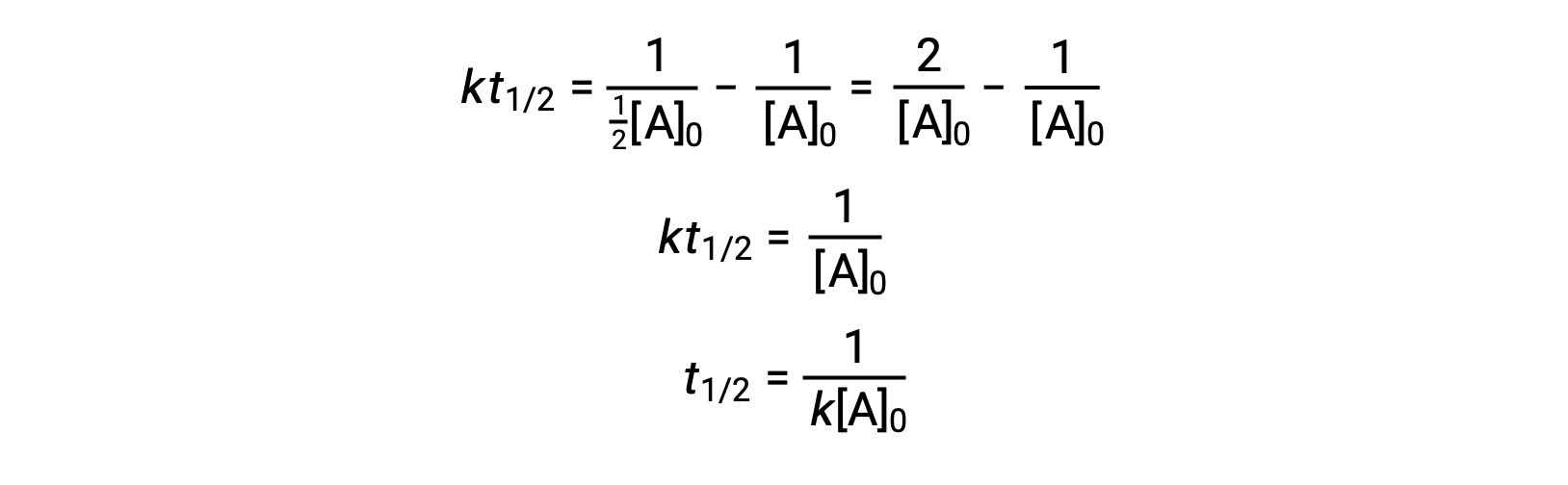
Para una reacción de segundo orden, t1/2 es inversamente proporcional a la concentración del reactivo, y la semivida aumenta a medida que la reacción avanza porque la concentración del reactivo disminuye. A diferencia de las reacciones de primer orden, la constante de velocidad de una reacción de segundo orden no puede calcularse directamente a partir de la semivida a menos que se conozca la concentración inicial.
Vida media de las reacciones de orden cero
Una ecuación para la semivida de orden cero también puede derivarse de su ley de velocidad integrada:
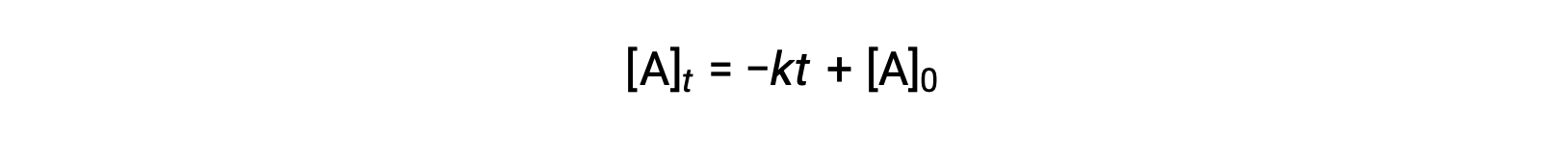
Sustituyendo t = t1/2y [A]t = ½ [A]0, en la ley de velocidad integrada de orden cero se obtiene:
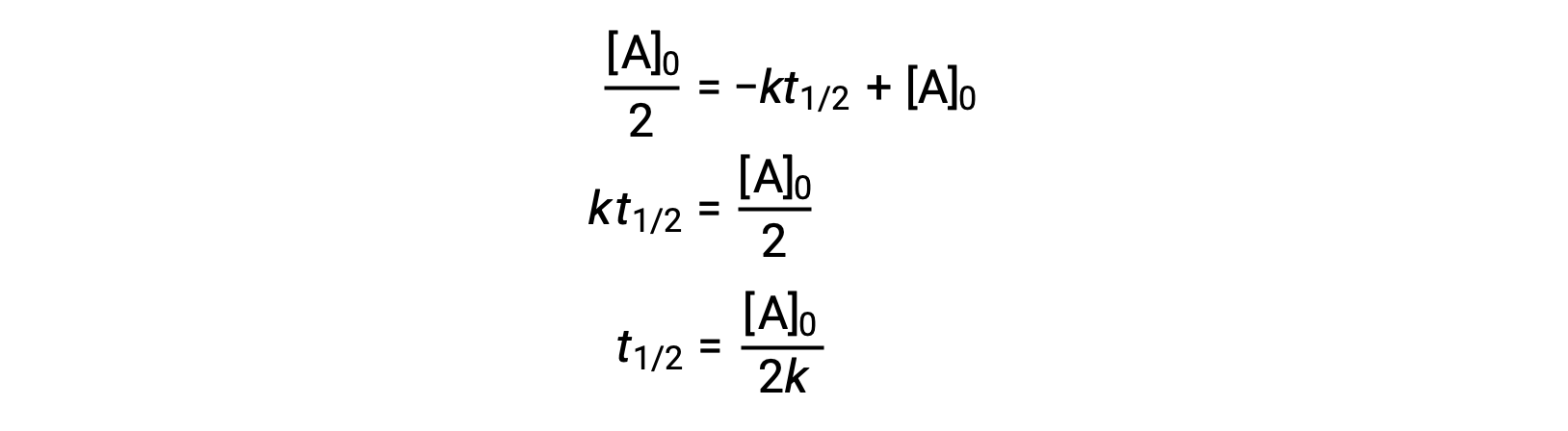
La vida media de una reacción de orden cero es inversamente proporcional a su constante de velocidad. Sin embargo, la vida media de una reacción de orden cero aumenta a medida que aumenta la concentración inicial.
Este texto es adaptado de Openstax, Química 2e, Sección 12.4: Leyes de velocidad Integrada.
Del capítulo 13:

Now Playing
13.6 : Vida Media de una Reacción
Cinética química
34.3K Vistas

13.1 : Velocidad de Reacción
Cinética química
51.3K Vistas

13.2 : Midiendo las Velocidades de Reacción
Cinética química
24.5K Vistas

13.3 : Concentración y Ley de Velocidad
Cinética química
30.1K Vistas

13.4 : Determinando el Orden de Reacción
Cinética química
55.1K Vistas

13.5 : Las Leyes de Velocidad Integrada: Dependencia entre la Concentración y el Tiempo
Cinética química
34.5K Vistas

13.7 : Dependencia de la Temperatura en la Velocidad de Reacción
Cinética química
81.1K Vistas

13.8 : Los Gráficos de Arrhenius
Cinética química
38.6K Vistas

13.9 : Mecanismos de Reacción
Cinética química
25.4K Vistas

13.10 : Pasos Determinantes de la Velocidad
Cinética química
31.7K Vistas

13.11 : Catálisis
Cinética química
26.6K Vistas

13.12 : Enzimas
Cinética química
80.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados