La química ácido-base de Brønsted-Lowry es la transferencia de protones; por lo tanto, la lógica sugiere una relación entre las fuerzas relativas de los pares ácido-base conjugados. La fuerza de un ácido o una base se cuantifica en su constante de ionización, Ka o Kb, que representa la magnitud de la reacción de ionización del ácido o de la base. Para el par ácido-base conjugado HA / A−, las ecuaciones de equilibrio de ionización y las expresiones de la constante de ionización son
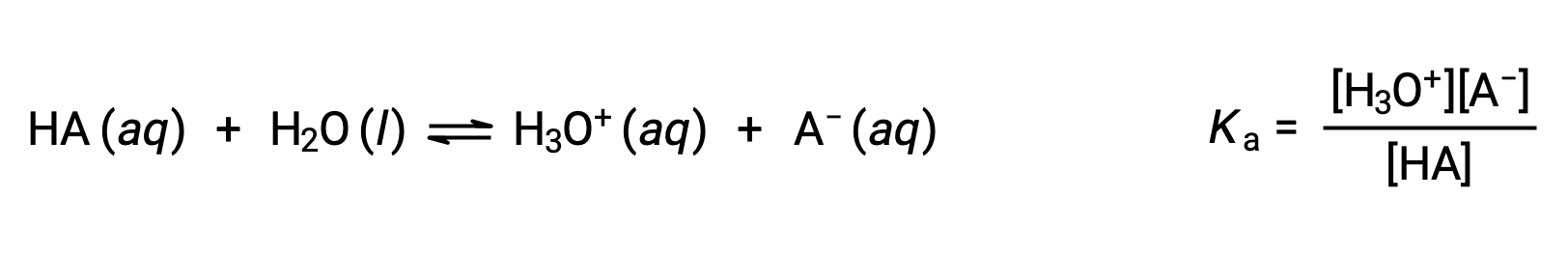
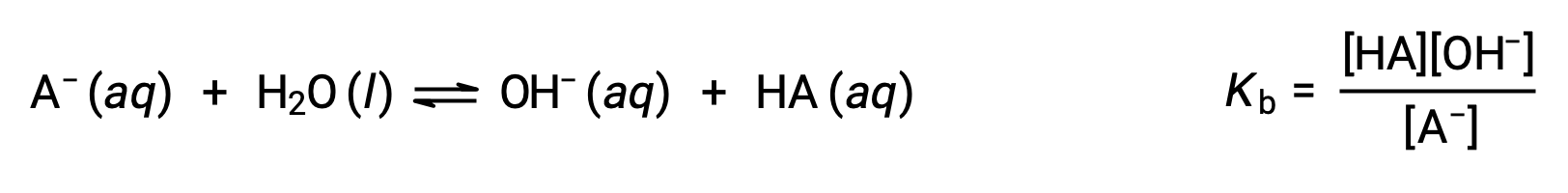
Al sumar estas dos ecuaciones químicas se obtiene la ecuación para la autoionización del agua:
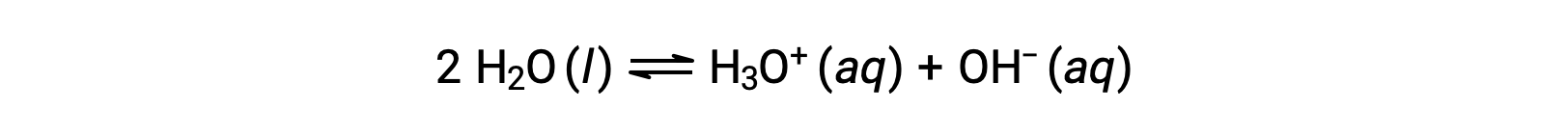
Como se ha comentado anteriormente, la constante de equilibrio para una reacción sumada es igual al producto matemático de las constantes de equilibrio para las reacciones sumadas, y así
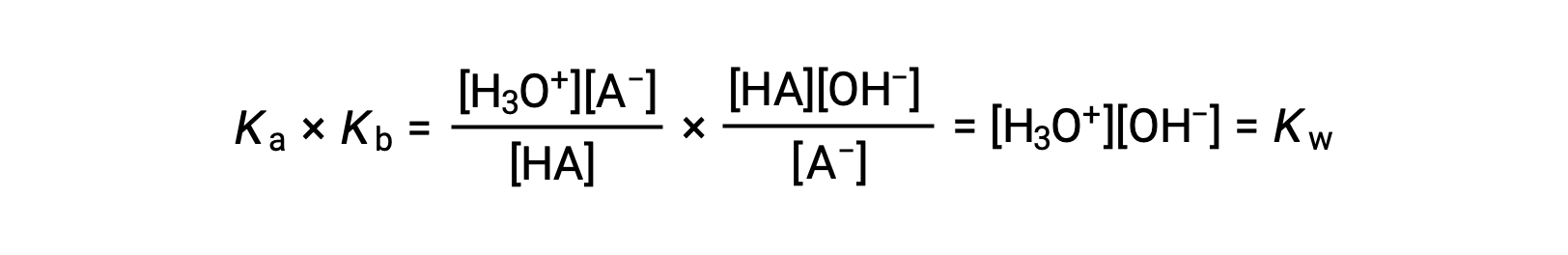
Esta ecuación establece la relación entre las constantes de ionización para cualquier par ácido-base conjugado, es decir, su producto matemático es igual al producto iónico del agua, KW. Al reorganizar esta ecuación, se hace evidente una relación recíproca entre las fuerzas de un par ácido-base conjugado:
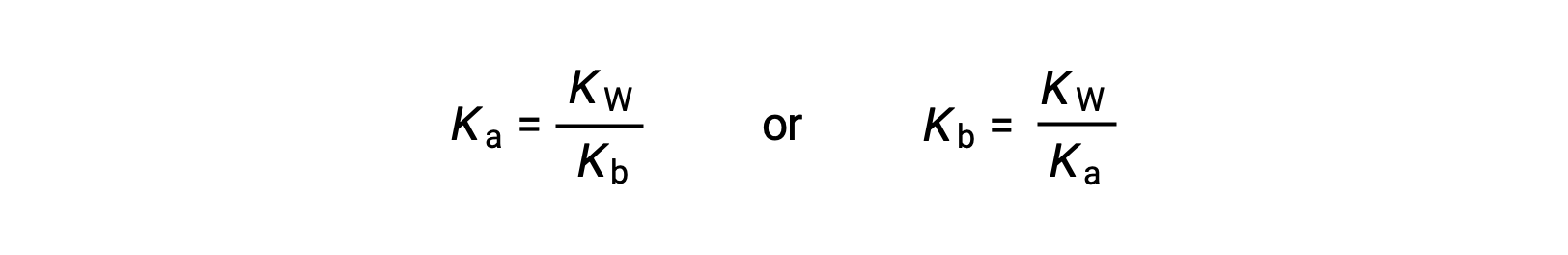
La relación proporcional inversa entre Ka y Kb significa que cuanto más fuerte es el ácido o la base, más débil es su conjugado.
Tomando el registro negativo de ambos lados de la ecuación, Ka × Kb = KW lleva a
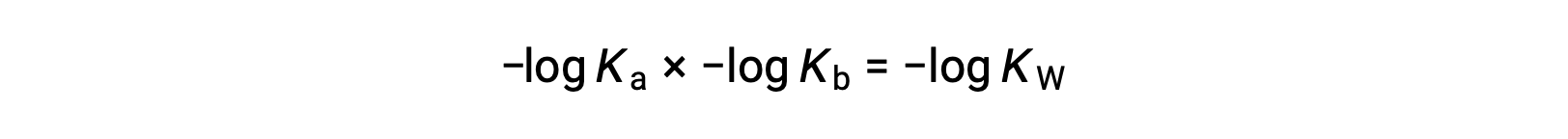
entonces
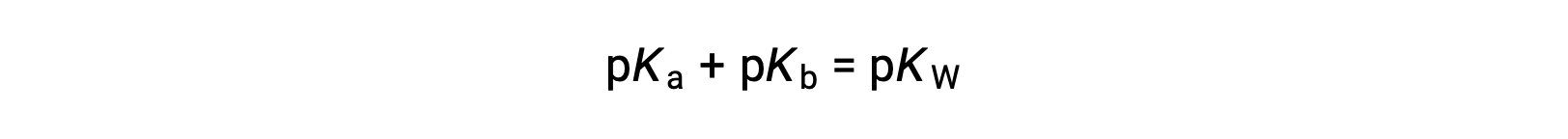
Como pKW es 14 a 25 °C, esta ecuación también puede escribirse como
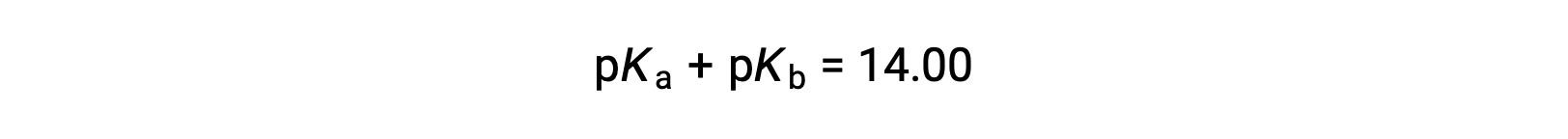
El pKa y el pKb también representan la fuerza de los ácidos y las bases, respectivamente. Al igual que el pH y pOH, cuanto mayor sea el valor del pKa o del pKb, más débil será el ácido o la base, respectivamente.
| Ácido | Base |
| Ácido perclórico (HClO4)* | Ion perclorato (ClO4−)** |
| Ácido sulfúrico (H2SO4)* | Ion sulfato de hidrógeno (HSO4−)** |
| Yoduro de hidrógeno (HI)* | Ion yoduro (I−)** |
| Bromuro de hidrógeno (HBr)* | Ion bromuro (Br−)** |
| Cloruro de hidrógeno (HCl)* | Ion cloruro (Cl−)** |
| Ácido nítrico (HNO3)* | Ion nitrato (NO3−)** |
| Ion hidronio (H3O+) | Agua (H2O) |
| Ion sulfato de hidrógeno (HSO4−) | Ion sulfato (SO42−) |
| Ácido fosfórico (H3PO4) | Ion fosfato de dihidrógeno (H2PO4−) |
| Fluoruro de hidrógeno (HF) | Ion fluoruro (F−) |
| Ácido nitroso (HNO2) | Ion nitrito (NO2−) |
| Ácido acético (CH3CO2H) | Ion acetato (CH3CO2−) |
| Ácido carbónico (H2CO3) | Ion carbonato de hidrógeno (HCO3−) |
| Sulfuro de hidrógeno (H2S) | Ion sulfuro de hidrógeno (HS−) |
| Ion amonio (NH4+) | Amoníaco (NH3) |
| Cianuro de hidrógeno (HCN) | Ion cianuro (CN−) |
| Ión de carbonato de hidrógeno (HCO3−) | Ión carbonato (CO32−) |
| Agua (H2O) | Ion hidróxido (OH−) |
| Ion sulfuro de hidrógeno (HS−)† | Ion sulfuro (S2−)‡ |
| Etanol (C2H5OH)† | Ion etóxido (C2H5O−)‡ |
| Amoníaco (NH3)† | Ion amida (NH2−)‡ |
| Hidrógeno (H2)† | Ion hidruro (H−)‡ |
| Metano (CH4)† | Ion metilo (CH3−)‡ |
| *Se someten a una ionización ácida completa en agua | |
| † No se somete a ionización ácida en agua | |
| **No se somete a ionización de base en agua | |
| ‡Se someten a una ionización completa de base en agua | |
La lista de pares ácido-base conjugados mostrada está organizada para mostrar la fuerza relativa de cada especie en comparación con el agua. En la columna ácido, las especies enumeradas debajo del agua son ácidos más débiles que el agua. Estas especies no se someten a ionización ácida en agua; no son ácidos de Brønsted-Lowry. Todas las especies enumeradas por encima del agua son ácidos más fuertes, transfiriendo protones al agua hasta cierto punto cuando se disuelven en una solución acuosa para generar iones de hidronio. Las especies por encima del agua pero por debajo del ion hidronio son ácidos débiles, sometidos a ionización parcial ácida, mientras que las que están por encima del ion hidronio son ácidos fuertes que están completamente ionizados en solución acuosa.
Este texto es adaptado de Openstax, Química 2e, Sección 14.3: Fuerzas Relativas de Ácidos y Bases.
Tags
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados