Un ácido poliprótico contiene más de un hidrógeno ionizable y sufre un proceso de ionización gradual.Si las constantes de disociación ácida de los protones ionizables difieren suficientemente entre sí, la curva de titulación para dicho ácido poliprótico genera un punto de equivalencia distinto para cada uno de sus hidrógenos ionizables. Por lo tanto, la titulación de un ácido diprótico da lugar a la formación de dos puntos de equivalencia, mientras que la titulación de un ácido triprótico da lugar a la formación de tres puntos de equivalencia en la curva de titulación.
El ácido carbónico, H2CO3, es un ejemplo de un ácido diprotico débil. La primera ionización del ácido carbónico produce iones hidronio e iones bicarbonato en pequeñas cantidades.
Primera ionización:
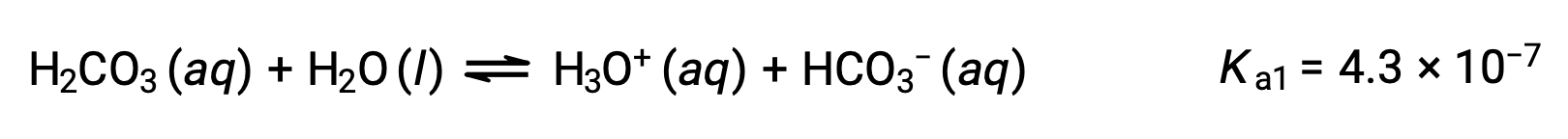
El ion bicarbonato también puede actuar como un ácido. Ioniza y forma iones hidronio e iones carbonato en cantidades aún más pequeñas.
Segunda ionización:
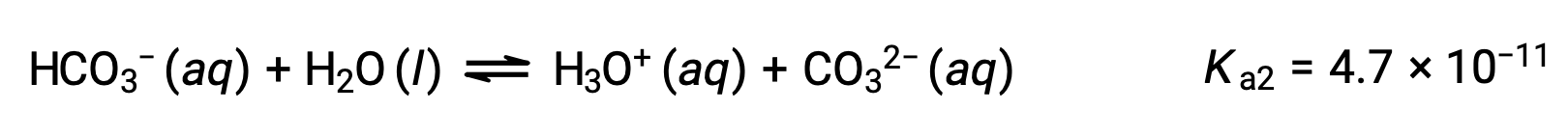
El Ka1 es mayor que el Ka2 por un factor de 104. Por lo tanto, cuando el H2CO3 se titula con una base fuerte como el NaOH, produce dos puntos de equivalencia distintos para cada hidrógeno ionizable.
El ácido fosfórico, un ácido triprótico, se ioniza en tres pasos:
Primera ionización:
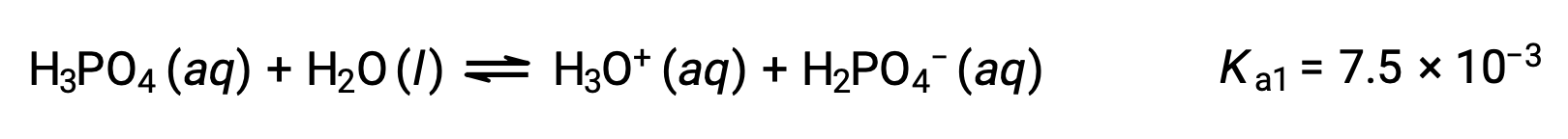
Segunda ionización:
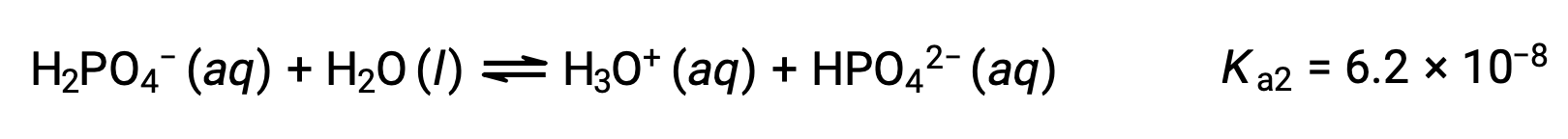
Tercera ionización:
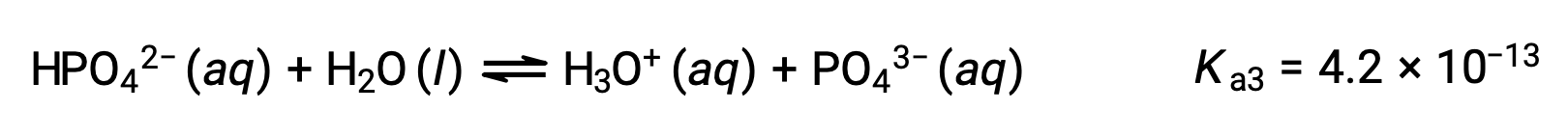
Cuando el H3PO4 se titula con una base fuerte como el KOH, produce tres puntos de equivalencia para cada hidrógeno ionizable. Sin embargo, como el HPO42− es un ácido muy débil, el tercer punto de equivalencia no se puede discernir fácilmente en la curva de titulación.
Este texto es adaptado de Openstax, Química 2e, Sección 14.5: Ácidos Polipróticos.
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados