2.1 : Reacciones químicas
Una ecuación química balanceada proporciona la información de las fórmulas químicas de los reactivos y productos involucrados en el cambio químico. La estequiometría de una reacción ayuda a predecir qué cantidad de reactivo se necesita para producir la cantidad deseada de producto o, en algunos casos, cuánto producto se formará a partir de una cantidad específica de reactivo.
Las cantidades relativas de reactivos y productos representados en una ecuación química balanceada a menudo se denominan cantidades estequiométricas. Sin embargo, en realidad, los reactivos no siempre están presentes en las cantidades estequiométricas indicadas por la ecuación balanceada.
En una reacción química, el reactivo que se consume primero y limita la cantidad de producto formado es el reactivo limitante, mientras que la otra sustancia se convierte en el reactivo en exceso. A menudo se utiliza un exceso de uno o más reactivos para asegurar la conversión completa del otro reactivo en el producto.
Considere la reacción para la formación de agua representada por la ecuación:
La estequiometría indica que dos moles de hidrógeno y un mol de oxígeno reaccionan para producir dos moles de agua; es decir, el hidrógeno y el oxígeno se combinan en una proporción de 2:1.
Imagínese si estuvieran presentes 5 moles de hidrógeno y 2 moles de oxígeno. La proporción de los reactivos es ahora 5:2 (o 2,5:1), que es mayor que la proporción estequiométrica de 2:1. Por lo tanto, el hidrógeno está presente en exceso y el oxígeno es el reactivo limitante. La reacción de todo el oxígeno proporcionado (2 moles) consumirá 4 moles de los 5 moles de hidrógeno proporcionados, dejando 1 mol de hidrógeno sin reaccionar. Calcular las cantidades molares de cada reactivo proporcionado y compararlas con las cantidades estequiométricas representadas en la ecuación química balanceada es una forma de identificar los reactivos limitantes y en exceso.
La velocidad de reacción es el cambio en la cantidad de un reactivo o producto por unidad de tiempo. Por lo tanto, las velocidades de reacción se determinan midiendo la dependencia del tiempo de alguna propiedad que puede relacionarse con las cantidades de reactivo o producto.
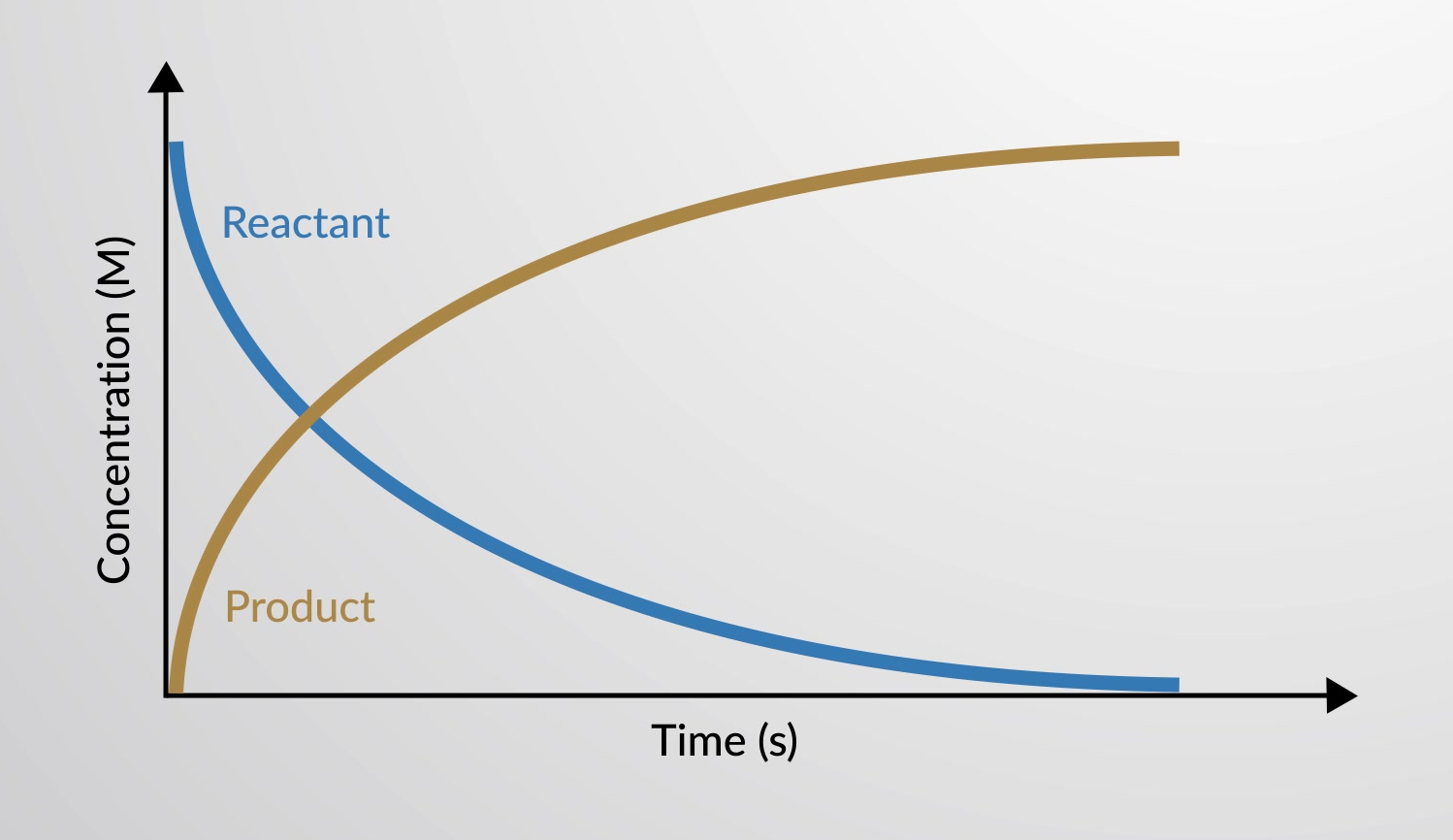
La velocidad de una reacción química se puede representar en un gráfico como la variación de las concentraciones de reactivos y productos en función del tiempo.
Una reacción química reversible representa un proceso químico que se desarrolla tanto en dirección directa (de izquierda a derecha) como inversa (de derecha a izquierda). El estado de una reacción reversible se evalúa convenientemente evaluando su cociente de reacción (Q). Para una reacción reversible descrita por
el cociente de reacción se obtiene directamente de la estequiometría de la ecuación balanceada como
donde el subíndice c denota el uso de concentraciones molares en la expresión.
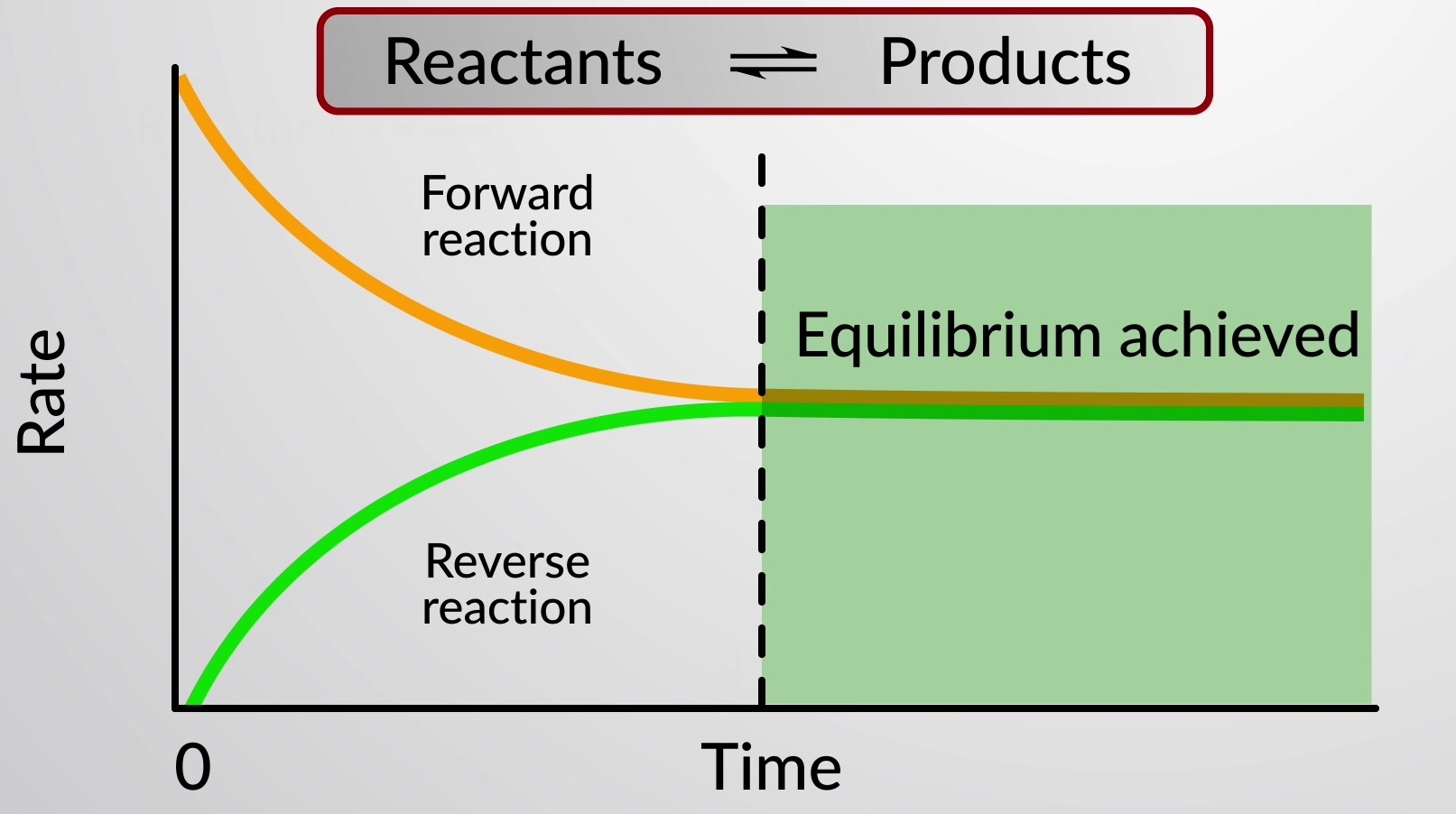
Cuando las velocidades de las reacciones directa e inversa son iguales, las concentraciones de las especies del reactivo y del producto permanecen constantes en el tiempo y el sistema está en equilibrio. Se utiliza una doble flecha especial para enfatizar la naturaleza reversible de la reacción.
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados