Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de los coeficientes de difusión a través de dos fotones de fluorescencia de recuperación después de photobleaching
En este artículo
Resumen
En este artículo vamos a describir el procedimiento para medir coeficientes de difusión con multi-fotón recuperación de fluorescencia después de photobleaching. Vamos a empezar por alinear el láser a lo largo del camino óptico de la muestra y la determinación de los parámetros experimentales adecuadas, y luego continuar la generación de curvas de fluorescencia y por último montaje de recuperación.
Resumen
Multi-fluorescencia de recuperación después de photobleaching es una técnica de microscopía para medir el coeficiente de difusión (o parámetros análogos de transporte) de las macromoléculas, y se puede aplicar tanto a
Protocolo
1. Alinear la óptica.
El equipo esencial de un experimento MP-FRAP son: un modo bloqueado fuente de láser, células Pockels (por haz de modulación), generador de impulsos, dicroicos, las lentes objetivo, la fluorescencia de emisión de filtro, tubo fotomultiplicador cerrada, y un sistema de registro de datos (fotones contra y multicanal escalador).
2. Determinará las competencias segura monitor.
- Atenuar el láser a un mínimo, pero razonable, para la generación de energía de fluorescencia en la muestra.
- Enfoque dentro de la muestra.
- Establecer un contador de fotones para integrar en una escala de tiempo mucho más largo que la recuperación de fluorescencia se esperaba. Con el volumen focal mantiene estacionario dentro de la muestra (en nuestro software de microscopio esto se logra mediante un análisis de punto), el registro de un número razonable de los datos de recuento de fotones.
- Aumentar el poder y tomar otra serie de datos de conteo de fotones. Repita hasta que el aumento en el recuento de fotones parece disminuir de forma significativa con respecto al aumento de potencia.
- Parcela de registro (recuento de fotones) como una función de registro (el poder). Una desviación de una pendiente de dos indica blanqueo en el monitor. Elegir como su poder de controlar un poder que está por debajo de este corte, pero que permite una señal a ruido razonable.
3. Determinar los parámetros de entrada para el generador de impulsos y multicanal escalador.
- Determinar el dorso de la de la sobre-estimación del coeficiente de difusión y el tiempo de recuperación basado en la literatura y / o la ecuación de Stokes-Einstein y la ecuación de difusión.
- Establecer los valores de los parámetros necesarios en el generador de impulsos y el escalador de la.
- En el generador de impulsos, establecer los tiempos pre-cloro y lejía. Un buen conjunto de reglas de oro es que el cloro pre-debe ser 1-2 veces mayor que el tiempo medio de recuperación de espera y el tiempo de cloro debe ser de una décima parte el tiempo medio de recuperación esperado.
- En el escalador, establecer el ancho de caja de aproximadamente la mitad de la duración de la lejía, y establecer el número de contenedores por cada registro de manera que el producto de su ancho de caja seleccionada y contenedores por registro es mayor o aproximadamente igual a la esperada recuperación completa más pre -cloro y los tiempos de lejía.
- Volver al generador de impulsos y establecer la frecuencia de la secuencia de pre-bleach/bleach/monitor igual a un valor justo inferior a la inversa del producto de la papelera de la anchura del número de contenedores por registro. *
- Por último, establezca el número de registros / digitalización en el escalador sobre la base de la intensidad de la señal de su poder controlar elegido.
* Es muy importante que el tiempo de una secuencia completa pre-bleach/bleach/monitor (1/Frecuencia) situado en el generador de impulsos es mayor que el tiempo de recogida de datos (ancho x contenedores bin / registro) establecido en el escalador. Si este criterio no se cumple, dispara múltiples cloro pueden aparecer dentro de un registro único en el escalador.
- Ajuste la alimentación del monitor a un nivel aceptable, determinado previamente. Ajustar la potencia de cloro a 200 mW o menos por encima del límite de blanqueo determinado durante la prueba de monitor de blanqueo. Estas facultades están establecidas en diferentes tensiones a través del cristal PC.
- Sello del microscopio, apagar las luces, a su vez en el PMT, realizar un escaneo en el punto en el software de microscopio y luego encender el generador de impulsos y escalador.
- Analizar la curva de recuperación como resultado por el trazado de la curva y marca tres puntos importantes: 1) la fluorescencia pre-cloro, 2) la fluorescencia inmediatamente después de la lejía, y 3) la fluorescencia en el extremo del conjunto de datos. Use los valores de fluorescencia pre-e inmediatamente después de cloro para calcular mejor el tiempo medio de recuperación.
- Con esta estimación del tiempo medio de recuperación, utilice las reglas generales señalados anteriormente para determinar los nuevos valores de la pre-lejía, cloro, y la duración de bin ancho. Además, el uso de la fluorescencia pre-cloro y de fluorescencia en el extremo del conjunto de datos para calcular mejor el tiempo necesario para lograr la plena recuperación. Como regla general, los datos deben ser recogidos por un período de tiempo que permite la recuperación total que debe presentarse en la segunda mitad de los datos.
- Ajustar los parámetros en el generador de impulsos y escalador, tomar una nueva curva, y continuar ajustando los parámetros hasta que la curva presenta un blanqueador fuerte y pronta recuperación. Tenga en cuenta que la duración de cloro puede, y debe, ser reducido por debajo de la regla de oro, si es posible. El poder de cloro también se puede ajustar, si es demasiado bajo, o demasiado profundo, un blanqueador se logra.
4. Prueba de la saturación de la excitación.
- Utilizando el monitor y el poder adecuados cloro, determinado previamente, tomar una serie de MP-FRAP curvas. Analizar cada uno de recuperación, normalización de la fluorescencia pre-lejía, utilizando la forma matemática adecuada y una de mínimos cuadrados no lineal algoritmo de ajuste (ver "Análisis de Datos"). Registrar el valor ajustado del parámetro de profundidad lejía.
- Siga tomando y análisis de series sucesivas de MP-FRAP curvas a aumentar los valores del poder blanqueador.
- Gráfico log (parámetro blanqueo de profundidad) en función de log (el poder). Cualquier desviación de una pendiente de dos indica la saturación de excitación. Elija un poder blanqueador de cloro que produce un fuerte, pero no causa la saturación.
5. Siga tomando MP-FRAP curvas.
- Seguir tomando las curvas, como el anterior, con todos los parámetros configurados correctamente.
6. Análisis de datos.
- Eliminar los datos pre-cloro y lejía de los datos de fluorescencia de fijar y ajustar los datos de tiempo de tal manera que t = 0 se corresponde con el valor de fluorescencia inmediatamente después de la lejía.
- Normalizar la recuperación de fluorescencia resultante con respecto a la media pre-cloro fluorescencia.
- Ajustar la curva normalizada utilizando el modelo matemático adecuado y de un algoritmo no lineal, al menos, las plazas ajuste, como por ejemplo la función lsqcurvefit en MATLAB. El modelo aquí presentado representa la recuperación de la fluorescencia influenciada tanto por la difusión y el flujo de convección:
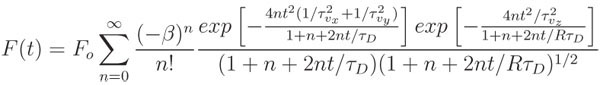
donde F es la fluorescencia o media antes de la lejía, β es el parámetro de profundidad de cloro, τ D es la característica de tiempo de recuperación de difusión, R es la relación entre el cuadrado de la axial (w z) para radial (w r) de ancho de la volumen focal de dos fotones, τ vx = w r / v x, τ vy = w R / V y, τ vz = w z / z v, y v 2 = v x 2 + y 2 + v v z 2 es el velocidad de la corriente de convección. De flujo confinado al plano de imagen, τ vz → ∞ y 1 / τ vx + 1 / τ vy se puede sustituir por una vr / τ. En ausencia de flujo convectivo, tanto en el numerador exponenciales ir a 1 y la expresión se reduce, a sólo dos parámetros de ajuste, β y D τ. El coeficiente de difusión se puede calcular fácilmente como D = w r 2 / D 8τ.
7. Los resultados representativos.
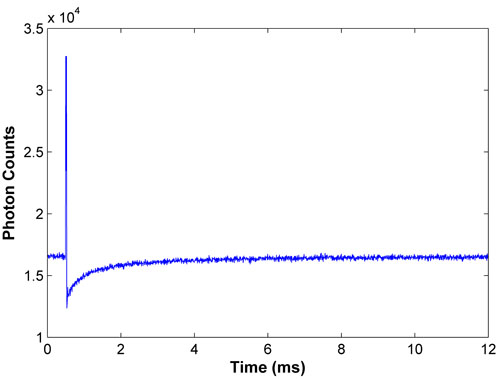
Figura 1. Lejía Representante y la curva de recuperación de FITC-BSA. Una curva de una buena recuperación exhibe una lejía fuerte y suave recuperación, con la fluorescencia a la recuperación completa se informa de la segunda mitad de los datos.
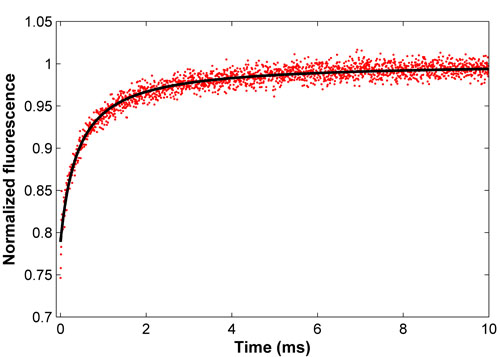
Figura 2. Curva de recuperación normalizada de FITC-BSA (rojo) y el correspondiente ajuste de mínimos cuadrados (negro). Este ajuste se obtiene un coeficiente de difusión del 52,9 UM2 / s, de acuerdo con la literatura.
Discusión
El poder de la multi-fotón recuperación de fluorescencia después de photobleaching radica en su capacidad de conseguir que las muestras de espesor con una resolución en 3D. Desde su desarrollo en la década de 1990, MP-FRAP se ha utilizado para determinar el coeficiente de difusión (o parámetros análogos de transporte) en los cuerpos celulares, ex rebanadas gruesas de tejido vivo, y en el tejido vivo y el intersticio. En este artículo, presentamos el equipo necesario para real...
Agradecimientos
Este trabajo fue financiado por el Departamento de Defensa de la concesión era de esperanza Scholar (N º W81XWH-05-0396) y una beca Pew en el Premio de Ciencias Biomédicas de Edward B. Brown III.
Materiales
| Name | Company | Catalog Number | Comments |
| Ti:sapphire laser | Newport Corp. | Mai Tai | |
| Pockels Cell | Conoptics | 350-80 | |
| Laser Scanning Microscope | Olympus Corporation | Fluoview | |
| Short pass dichroic mirror | Chroma Technology Corp. | 670 DCSX-2P | |
| Photomultiplier tube | Hamamatsu Corp. | HC125-02 | |
| Photon counter | Stanford Research Systems | SR 400 | |
| Multi-channel scaler/averager | Stanford Research Systems | SR 430 | |
| Pulse Generator | Stanford Research Systems | DG 535 | |
| FITC-BSA | Invitrogen | -- |
Referencias
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Biophys J. 60, 73-76 (1990).
- Brown, E. B., Wu, E. S., Zipfel, W., Webb, W. W. Measurement of molecular diffusion in solution by multiphoton fluorescence photobleaching recovery. Biophys J. 77, 2837-2849 (1999).
- Sullivan, K. D., Sipprell, W. H. B. r. o. w. n., Jr, E. B., Brown, E. B. Improved model of fluorescence recovery expands the application of multiphoton fluorescence recover after photobleaching in vivo. Biophys J. 96, 5082-5094 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados