Method Article
El establecimiento de xenoinjertos de tumor cerebral intracraneal, con posterior análisis del crecimiento tumoral y respuesta al tratamiento con imágenes de bioluminiscencia
En este artículo
Resumen
Luciferasa modificados xenoinjertos de tumores humanos el cerebro puede ser establecida por vía intracraneal en ratones atímicos, con posterior seguimiento del crecimiento del tumor y la respuesta a la terapia que utiliza imágenes de bioluminiscencia. En combinación con el análisis de supervivencia, la supervisión de bioluminiscencia es una herramienta esencial para la investigación pre-clínica de las terapias que se consideran para el tratamiento de tumores cerebrales.
Resumen
Modelos de trasplante con células humanas de tumor en el cerebro han servido una función esencial en la investigación neuro-oncología por muchos años. En el pasado, el procedimiento más utilizado para el establecimiento humano xenoinjerto de tumor consistió en la recolección de las células de los frascos de cultivo, seguida de la inyección subcutánea de las células recogidas en ratones inmunodeprimidos. Considerando que este enfoque todavía ve el uso frecuente en muchos laboratorios, ha habido un cambio significativo en el énfasis en la última década hacia el establecimiento de xenoinjertos ortotópico, que, en el caso de los tumores cerebrales, requiere de la inyección de células tumorales en las adecuadas estructuras neuroanatómicas. Debido a que el establecimiento de xenoinjerto intracraneal elimina la posibilidad de controlar el crecimiento del tumor a través de la medición directa, como por el uso de pinzas, el cambio de énfasis hacia los modelos de xenoinjerto de tumor cerebral ortotópico ha requerido la utilización de imagen no invasivas para la evaluación de la carga tumoral en los animales huéspedes. De los métodos de imagen disponibles en la actualidad, la supervisión de bioluminiscencia se considera generalmente ofrecen la mejor combinación de sensibilidad, conveniencia y costo. Aquí, vamos a demostrar los procedimientos para el establecimiento ortotópico tumor cerebral, y para vigilar el crecimiento del tumor y la respuesta al tratamiento cuando se prueban tratamientos experimentales.
Protocolo
1. Preparación de las células tumorales.
Las células de xenoinjertos de tumores cerebrales pueden ser originados por tumores propaga como tumores subcutáneos en ratones atímicos, o de cultivos celulares. La utilización de ambas fuentes de células se discute a continuación, junto con la demostración de un método para la implantación de células.
Para preparar las células de tumores subcutáneos para la transferencia en el compartimento intracraneal, tumores extirpados flanco se colocan en placas de cultivo, donde el tejido es inicialmente picada con un bisturí y luego interrumpido mecánicamente por pipeteo repetitivo para crear una suspensión total de la celda 1. La suspensión total de la célula se hace pasar por una malla de nylon 70 M de filtros para producir una suspensión de células individuales para inyección intracraneal. La suspensión celular se centrifuga a 1000 rpm durante 10 minutos a 4 ° C, y el sobrenadante aspirado antes de resuspender el pellet de células en un volumen apropiado de medio libre de suero para obtener una concentración de trabajo final (ver más abajo). Para la preparación de líneas celulares establecidas para la implantación intracraneal, se cosechan las células por monocapas trypsinizing, o mediante la recopilación de las culturas neuroesfera suspensión, la centrifugación y resuspensión de las células como se ha indicado 2. El número de células inyectadas es variable dependiente de la localización neuroanatómica de la inyección. Para las inyecciones supratentorial que habitualmente se inyectan 5.3 x 10 5 células en 3 L de medio libre de suero (DMEM), mientras que para las inyecciones de tronco cerebral 3, tan sólo 5 x 10 4 células se inyectan en 0,5 mL. Inyección de grandes volúmenes de lo recomendado puede provocar el reflujo de las células tumorales a través del trayecto de la aguja, con exofítico resultante (Figura 1), en lugar de crecimiento de los tumores intracraneales. Después de retirarse de la muestra para la inyección intracraneal, la suspensión de células restantes deben ser colocados en hielo, con el contenido puede mezclarse con frecuencia para mantener la concentración adecuada al completar el establecimiento del tumor intracraneal entre los miembros de una serie de inyecciones.
2. Implantación de células tumorales
Tenga en cuenta que todos los procedimientos que se describen a continuación han sido revisados y aprobados por el Uso de Animales institucional y el cuidado en la Universidad de California en San Francisco.
- El área quirúrgica debe estar preparado rociando todas las superficies con un desinfectante, como la solución de clorhexidina al 2%. Después de usar el desinfectante, los siguientes materiales deben ser colocados en el área quirúrgica:
- Almohadilla eléctrica para mantener la temperatura del cuerpo del ratón
- Dos pequeñas cápsulas de Petri, que contiene 3% de peróxido de hidrógeno, y otro que contiene clorhexidina al 2%
- Hisopos estériles de gasa y algodón
- Bisturís estériles desechables
- Grapadora quirúrgica autoclave
- Para la anestesia de una inyección de anestesia se debe utilizar, por lo general una mezcla de ketamina-xilazina.
- Una vez que un ratón es anestesiado, el cuero cabelludo se prepara limpiando varias veces con un trozo de gasa estéril empapado en la solución de clorhexidina. Pomada para los ojos se deben aplicar para mantener la humedad adecuada durante el procedimiento. Con un bisturí estéril, realizar una incisión sagital sobre el hueso parieto-occipital, aproximadamente 1 cm de largo. La superficie del cráneo expuesta se limpia con un algodón empapado en una solución de peróxido de hidrógeno al 3%. El bregma debe ser evidente en este punto (ver video).
- Las coordenadas para la inyección de las células tumorales puede variar de acuerdo con el sitio deseado para el establecimiento del tumor. A continuación figura el procedimiento que usamos para el establecimiento del tumor intracerebral 2 en una localización neuroanatómica en el que muchos pacientes con tumores cerebrales experiencia en el desarrollo del tumor. Otros lugares de interés en la investigación de tumores cerebrales incluyen el puente, para el modelado anatómico del tallo cerebral tumores 3, y las inyecciones subdural para el modelado de la ubicación de los tumores meníngeos 4. Antes de la inyección de células tumorales, utilice una aguja de calibre 25 estéril afilado para perforar el cráneo de 2 mm a la derecha del bregma y 1 mm por delante de la sutura coronal, creando una apertura para la inyección de células tumorales (ver video). Este procedimiento funciona bien tanto para los ratones y las ratas (22 aguja de calibre para las ratas).
- Antes de recurrir las células dentro de la jeringa, mezclar el contenido de la suspensión celular golpeando con el dedo. Cargue la jeringa con la cantidad deseada de suspensión celular, teniendo cuidado de evitar la creación de burbujas de aire. El exterior de la jeringa luego se deben limpiar con una gasa con alcohol para limpiar el exterior libre de células adherentes, lo que ayudará a prevenir el establecimiento y el crecimiento del tumor extracraneal (Figura 1). Para asegurarse de que la profundidad de la inyección adecuada es importante utilizar un bisturí para cortar de 3 mm de la punta de una punta de P20 pipetteman. En esta sección de la punta se puede montar sobre la jeringa y actuará para limitar la profundidad de la inyección, y se asegurará, además, que el tip de la aguja de la jeringa es de 3 mm de la parte inferior del cráneo. Coloque la jeringa perpendicular al cráneo y en el agujero creado con anterioridad, e inyecte lentamente la suspensión de células (una suspensión 3μL debe inyectarse en un período de 1 minuto). Un ángulo inadecuado de la inserción puede resultar en una jeringa de inyección intraventricular de las células y su posterior difusión espinal (Fig. 1B: Derecha) Al término de la inyección, deje la aguja en su lugar por un minuto, luego retire lentamente (ver video): estos pasos le ayudará a reducir reflujo de las células tumorales.
- Como una alternativa al enfoque sin ayuda o sin mano de la implantación de células tumorales intracraneales 5, se puede utilizar un marco estereotáxico animales pequeños (F panel de visión esquemática), que generalmente promueve la ubicación de la inyección más consistente, pero a costa de grandes cantidades de tiempo de procedimiento. En nuestra experiencia, dos miembros del personal quirúrgico puede inyectar hasta 60 ratones / hora cuando se utiliza el enfoque a mano, mientras que la tasa máxima de inyección con un marco estereotáxico pequeños animales es de aproximadamente 15 ratones / hora. La conveniencia de procedimiento es una consideración importante cuando se inyectan grandes series de los ratones, y ayuda a reducir el tiempo en que las células tumorales, que se inyecta, se dejan en el hielo.
- Limpia el cráneo con el peróxido de hidrógeno al 3% y secar con un hisopo de algodón estéril seca. Aplicar cera de hueso estéril en el orificio. Con una pinza, sacar el cuero cabelludo junto a la calavera y grapas para cerrar. Para una cicatrización óptima, el cuero cabelludo debe grapar con la dermis de cada lado del cuero cabelludo contra la otra (parte inferior contra la parte inferior). El cuero cabelludo con grapas deben limpiarse con solución de clorhexidina, y la buprenorfina se administra por inyección subcutánea para el alivio del dolor post-operatorio.
- Controlar todos los ratones después de la operación hasta que se ambulantes y mantener la actividad normal. Por lo general, el tiempo de recuperación es de alrededor de 30 minutos.
3. Bioluminiscencia control del crecimiento tumoral
- De fondo. Imágenes de bioluminiscencia (BLI) se basa en la oxidación de la luciferina [d-(-) -2 - (60-hidroxi-20-benzotiazolilo)-thiazone-4-carboxílico] en presencia de oxígeno y el trifosfato de adenosina (ATP). Esta reacción es catalizada por la enzima luciferasa, que convierte la energía química en fotones con la emisión resultante de la luz. Las células humanas pueden ser modificados para expresar la luciferasa (ver más abajo), y sólo las células que expresan luciferasa capaz de emitir luz en presencia del sustrato luciferina. No es la luminiscencia de fondo mínimo de los animales tratados con luciferina anfitriones, de tal manera que hay una muy favorable relación señal-ruido para la detección de las emisiones de luminiscencia de la luciferasa modificado las células tumorales, permite un seguimiento muy sensible del crecimiento tumoral y respuesta al tratamiento in vivo. Por otra parte, la luciferasa y su sustrato, la luciferina, se ha demostrado que no es tóxico para las células de mamíferos, y no hemos encontrado diferencias funcionales entre las células que expresan luciferasa relativa a las células correspondientes modificaciones. Luciferina atraviesa fácilmente las membranas celulares y la barrera sanguínea del cerebro después de la intraperitoneal (ip) o intravenosa (iv) la inyección en ratones, lo que permite imágenes de cada compartimento que contiene luciferasa modificados células. El nivel de emisión de fotones y el espectro de luz emitido por la luciferasa modificados células es suficiente para penetrar en los tejidos de los animales de investigación pequeños, como ratones y ratas, y se puede detectar el exterior con cámaras de imagen con poca luz. La naturaleza no invasiva de imágenes de bioluminiscencia permite la monitorización repetida del crecimiento tumoral y respuesta al tratamiento en pacientes individuales de los animales.
- Fuentes de células implantadas deben ser modificados de forma estable para la expresión de luciferasa de luciérnaga. Estas fuentes de células se pueden comprar o se han producido en los laboratorios individuales mediante lentivirus que se han construido para la expresión constitutiva de la luciferasa. Se recomienda encarecidamente el uso de células modificadas con lentivirus que codifica la luciferasa, en lugar de plásmido, para asegurar la expresión estable de la luciferasa celulares in vivo, lo cual es necesario para obtener imágenes de luminiscencia cuantitativas para proporcionar una indicación precisa de los cambios en la carga tumoral de los sujetos individuales de los animales que se repiten reflejado en el transcurso de un experimento.
- BLI control. Recomendamos la realización de imágenes de bioluminiscencia cuantitativa (qBLI) 1x-2x por semana, comenzando una semana después de la inyección de células tumorales. Nuestra qBLI se lleva a cabo utilizando el IVIS Lumina imágenes estación (Caliper Life Sciences), y nuestros resultados indican datos similares se obtienen en el uso del Lumina IVIS, el IVIS 150, o la estación de IVIS 200 imágenes. En preparación para las imágenes, los ratones son a la vez anestesiados con ketamina / xilazina y administrado luciferina (D-luciferina sal de potasio, 150 mg / kg, Caliper Life Sciences) mediante inyección intraperitoneal, con ratones imágenes 12 minutos después de la inyección. La farmacocinética de la luciferina indican que el tiempo entre la administracióntración de la luciferina y la determinación de la luminiscencia celular debe estar entre 10-15 minutos después de la inyección de la luciferina, a fin de obtener el máximo de emisión de luminiscencia y la mayor sensibilidad de detección. El período de tiempo seleccionado en el intervalo de 10-15 minutos de tiempo se debe mantener lo más constante entre los animales que se va a examinar. Es de suma importancia para mantener la consistencia en la longitud de tiempo entre la inyección de luciferina y la obtención de lecturas de BLI. Las regiones de interés que abarcan la zona intracraneal de la señal se definen mediante el software de vida de la imagen (Figura 2), y el photons/s/sr/cm2 total (fotones por segundo por estereorradián por centímetro cuadrado) se registran (ver video).
- Análisis de datos. Mientras que el crecimiento del tumor y la respuesta al tratamiento se controlan en los animales, le recomendamos los grupos de tratamiento de al menos 8 para aumentar la certeza estadística de conclusiones sobre la respuesta del tumor, o falta de ella, a la terapia. Con respecto a la presentación de los resultados qBLI, las lecturas de luminiscencia se convierten en valores normalizados dividiendo luminiscencia cada ratón s, obtenidos durante y posterior a la finalización del régimen terapéutico, con su correspondiente tratamiento previo luminiscencia máxima de lectura 6,7. Para el análisis de la supervivencia, el estimador de Kaplan-Meier 8 se utiliza, y de la cual las curvas de supervivencia se generan, y determinar los valores de la mediana de supervivencia. Las diferencias entre las curvas de supervivencia se compararon mediante una prueba de log-rank 9.
- Recuperación del cerebro para su posterior análisis de tumor tratado y no tratado. Sobre la eutanasia de los animales, el cerebro del ratón debe ser rápidamente eliminado (ver video), y, o bien colocado en formalina para su posterior análisis de la morfología del tumor y la inmunohistoquímica, o debe ser montado en octubre para la congelación de la muestra.
4. Resultados representante
En el ejemplo que se muestra en la Figura 3A, los ratones que recibieron inyecciones de células tumorales intracraneales fueron controlados por luminiscencia intracraneal hasta que los sucesivos valores de luminiscencia significa que señalan un crecimiento progresivo del tumor, y en el que se inició la terapia de tiempo (a partir de la flecha gris en el día 34: erlotinib administrado diariamente a 150 mg / kg hasta que la eutanasia es necesario). Los valores de luminiscencia para cada ratón se establece en un valor normalizado de una en el momento de iniciar el tratamiento, con las lecturas de luminiscencia posterior de cada ratón normalizado a su valor final de imagen antes del tratamiento. A modo de ejemplo, un ratón con una lectura de luminiscencia final pre-tratamiento de 2,0 x 10 7 fotones / seg en el día 34, cuya luminosidad se había incrementado a 6.0 x 10 7 fotones / seg en el día 38, tendría un valor de luminosidad día 38 normalizado de 3,0. La media de la bioluminiscencia normalizado y el error estándar correspondiente para el control de los grupos de tratamiento y se trazan para cada punto de la imagen en tiempo. En este ejemplo, una diferencia significativa en la luminiscencia normalizada promedio es evidente en el punto de imagen por primera vez con posterioridad al inicio del tratamiento (día 38), con la diferencia de luminosidad media del grupo que muestran un aumento más en los tiempos posteriores. En la mayoría de los casos, la actividad antitumoral de la terapia, según lo indicado por qBLI, está acompañada por una correspondiente diferencia significativa en la supervivencia (es decir, p <0,05), como es el caso aquí (Figura 3B). Paneles 3C y 3D muestran adyacentes hematoxilina y eosina y anti-EGFR secciones teñidas de cerebro de ratón obtenido en el momento de la eutanasia, después de la colocación del cerebro resecado en formalina y posterior inclusión en parafina para el corte.
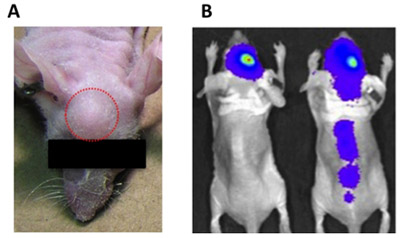
Figura 1. Indicaciones de errores de inyección intracraneal. A) exofítico (extracraneal) el crecimiento del tumor (círculo rojo) puede ser causada por muy grande un volumen de inyección, suspensión de células residuales unido a la jeringa, o de retirar la jeringa con demasiada rapidez después de la inyección de las células tumorales. B) Inyección de células tumorales en los ventrículos puede causar la difusión de la columna vertebral del tumor (ratón hacia la derecha), en contraste con las células tumorales inyectadas correctamente, la señal para que se queda localizado en el sitio de inyección (ratón hacia la izquierda).
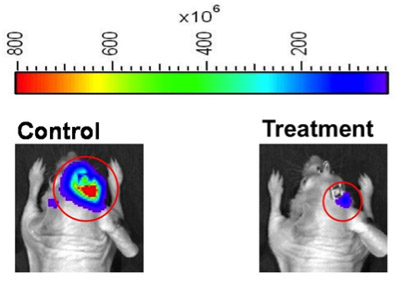
Figura 2. Calor representaciones de mapas de imagen de la intensidad de la bioluminiscencia de los ratones representante de control (izquierda) y tratamiento (derecha), los grupos de un experimento de la respuesta al tratamiento. El software de imagen viva se puede configurar para definir las regiones de interés (círculos rojos), u operadores del instrumento se pueden definir las regiones de interés de forma manual. Para el uso de imágenes como estas para la construcción de la figura, se recomienda que el operador del instrumento muestra imágenes de mapas de calor con el mismo calor bioluminiscencia de Gama (parte superior de la figura), para proporcionar una representación visual de la magnitud de la diferencia entre los sujetos bioluminiscencia animal.
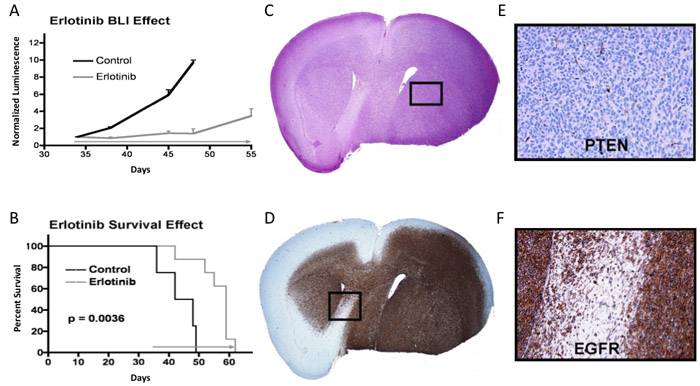
Figura 3. Bioluminiscencia, la supervivencia y el análisis de tejido tumoral de un experimento en el que la respuesta terapéutica es evidente. Un gráfico) de las lecturas de la bioluminiscencia significa para el control y tratamiento de los ratones del grupo, con un error estándar indicado para cada punto de imagen. B) Representar la supervivencia de los ratones mismo p-valor determinado mediante el uso de la prueba de log-rank 7. C) H & E manchadas sección del cerebro de los ratones con tumor. D) EGFR manchado sección. E y F) Aumentos de las áreas indicadas de los paneles C y D, respectivamente, con E panel que muestra tinción negativa para tumor supresor de proteína PTEN.
Discusión
Ortotópico (intracraneal) tumor cerebral establecimiento xenoinjerto proporciona un microambiente adecuado para el desarrollo de cáncer 10 CNS a hacerse la prueba de la respuesta terapéutica. Este tipo de modelo, además, proporciona información sobre el acceso terapéutico al cerebro y el tumor cerebral, que es de importancia crítica para determinar si un agente experimental se debe avanzar a la evaluación de ensayos clínicos en pacientes. Debido a la cantidad de xenoinjerto de tumor intracraneal no se puede medir directamente, por ejemplo, pinzas, el seguimiento longitudinal de crecimiento de los tumores intracraneales y respuesta al tratamiento requiere de imagen no invasivas, con nuestra experiencia de formación de imágenes de bioluminiscencia que indica que el enfoque más práctico para los experimentos cuyo objetivo primordial está evaluando el alcance de la respuesta del tumor a la terapia. Cuando los resultados de las imágenes de bioluminiscencia se combinan con el análisis de supervivencia de los animales sujetos, los dos conjuntos de datos proporcionan un enfoque poderoso y confiable para evaluar la eficacia terapéutica experimental.
Por último, es de suma importancia que los xenoinjertos de tumores intracraneales del cerebro se cosechan a partir de materias animales sacrificados con el fin de evaluar los efectos morfológicos y moleculares de la terapia, y para ello prefiere la resección de todo el cerebro en el momento de la eutanasia, con la preservación del cerebro resecado para su posterior análisis.
Considerando que la presentación anterior se ha concretado a la investigación de tumores cerebrales, los conceptos son sin duda generalizables a otros tipos de cáncer humano que son susceptibles de modelado ortotópico en los roedores.
Divulgaciones
Agradecimientos
Materiales
| Name | Company | Catalog Number | Comments |
| Disposable Scapels | Feather Safety Razor Co, Ltd. | 2975 | No.21 |
| Heating Pad | Dunlap | HP950 | |
| Gauze | Fisher Scientific | 22028563 | |
| Cotton Swabs | Fisher Scientific | 23-400-100 | |
| 2% Chlorhexidine | Fisher Scientific | NC9756995 | |
| 3% Hydrogen Peroxide | Fisher Scientific | H312P-4 | |
| 25g Needle | BD Biosciences | 305122 | |
| 10ul Hamilton Sharp Microsyringe | Hamilton Co | 20734 | |
| Skin Stapler and Staples | Stoelting Co. | 59020 | |
| Stereotaxic Frame | Stoelting Co. | 51725 | |
| Living Image Software |  Caliper Life Sciences Caliper Life Sciences | ||
| D-luciferin | Gold Biotechnology | LUCK-1G | Potassium Salt |
| Xenogen Lumina |  Caliper Life Sciences Caliper Life Sciences |
Referencias
- Giannini, C., Sarkaria, J. N., Saito, A., Uhm, J. H., Galanis, E., Carlson, B. L., Schroeder, M. A., James, C. D. Patient Tumor EGFR and PDGFRA Gene Amplifications Retained in an Invasive Intracranial Xenograft Model of GBM. Neuro-Oncol. 7, 164-176 (2005).
- Ozawa, T., Wang, J., Hu, L. J., Bollen, A. W., Lamborn, K. R., Deen, D. F. Growth of human glioblastomas as xenografts in the brains of athymic rats. In Vivo. 1, 55-60 (2002).
- Hashizume, R., Ozawa, T., Dinca, E. B., Banerjee, A., Prados, M. D., James, C. D., Gupta, N. A human brainstem glioma xenograft model enabled for bioluminescence imaging. J Neurooncol. , (2009).
- Baia, G. S., Dinca, E. B., Ozawa, T., Kimura, E. T., McDermott, M. W., James, C. D., VandenBerg, S. R., Lal, A. An orthotopic skull base model of malignant meningioma. Brain Pathol. 2, 172-179 (2007).
- Ozawa, T., James, C. D., Van Meir, E. Human Brain Tumor Cell and Tumor Tissue Transplantation Models. CNS Cancer: Models, Markers, Prognostic Factors, Targets, and Therapeutic Approaches. , 147-162 (2009).
- Sarkaria, J. N., Yang, L., Grogan, P. T., Kitange, G. J., Carlson, B. L., Schroeder, M. A., Galanis, E., Giannini, C., Wu, W., Dinca, E. B., James, C. D. Identification of Molecular Characteristics Correlated with Glioblastoma Sensitivity to EGFR Kinase Inhibition Through Use of an Intracranial Xenograft Test Panel. Mol. Cancer Ther. 6, 1167-1174 (2007).
- Dinca, E. B., Sarkaria, J. N., Schroeder, M. A., Carlson, B. L., Voicu, R., Gupta, N., Berger, M. S., James, C. D. Bioluminescence Monitoring of Intracranial Glioblastoma Xenograft Response to Primary and Salvage Temozolomide Therapy. J. Neurosurg. 107, 610-616 (2007).
- Kaplan, E. L., Meier, P. Non-parametric estimation from incomplete observations. J. Am. Stat. Assoc. 53, 457-481 (1958).
- Peto, R., Peto, J. Asymptotically efficient rank invariant procedures. J. R. Stat. Soc. Ser. A. Stat. Soc. 135, 185-207 (1972).
- Camphausen, K., Purow, B., Sproull, M., Scott, T., Ozawa, T., Deen, D. F., Tofilon, P. J. Influence of in vivo growth on human glioma cell line gene expression: convergent profiles under orthotopic conditions. Proc. Natl. Acad. Sci. U. S. A.. 102, 8287-8292 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados