Method Article
Evaluación de la absorción de nanopartículas en los tumores en tiempo real utilizando intravital imagen
En este artículo
Resumen
Se presenta un nuevo enfoque para cuantificar la localización de las nanopartículas en los vasos sanguíneos de los tumores humanos transplantados con dinámica y en tiempo real de imágenes intravital en un modelo de embrión aviar.
Resumen
Las tecnologías actuales para obtener imágenes de tumores, tales como ultrasonido, resonancia magnética, PET y la TC, no son capaces de producir imágenes de alta resolución para la evaluación de la absorción de nanopartículas en los tumores a nivel microscópico 1,2,3, destacando la utilidad de un modelo de xenoinjerto adecuado en el que llevar a cabo análisis detallados de la absorción. Aquí, nosotros usamos imágenes de alta resolución intravital para evaluar la absorción de nanopartículas en xenoinjertos de tumores humanos en una versión modificada, el modelo de embrión de pollo sin caparazón. El modelo de embrión de pollo es particularmente adecuado para estos análisis in vivo, ya que favorece el crecimiento de tumores humanos, es relativamente barato y no requiere anestesia o cirugía 4,5. Las células tumorales forma totalmente xenoinjertos vascularizados plazo de 7 días cuando se implanta en la membrana corioalantoidea (CAM) 6. Los tumores resultantes se visualizan imágenes no invasivo en tiempo real de alta resolución que puede mantenerse hasta por 72 horas con poco impacto en el host o sistemas de tumor. Las nanopartículas con una amplia gama de tamaños y formulaciones administradas distal al tumor se pueden visualizar y cuantificar, ya que el flujo a través del torrente sanguíneo, extravasación de la vasculatura del tumor con goteras, y se acumulan en el sitio del tumor. Se describe aquí el análisis de las nanopartículas derivadas de virus del mosaico del caupí (CPMV), decorado con el infrarrojo cercano tintes fluorescentes y / o polímeros de polietilenglicol (PEG) 7, 8, 9,10,11. Tras la administración intravenosa, estas nanopartículas virales son rápidamente internalizados por las células endoteliales, lo que resulta en el etiquetado global de la vasculatura, tanto fuera como dentro del tumor 7,12. PEGilación de las nanopartículas viral aumenta su vida media en plasma, extiende su tiempo en la circulación, y en última instancia, aumenta su acumulación en los tumores a través del aumento de la permeabilidad y retención (EPR) Efecto 7, 10,11. La velocidad y el grado de acumulación de nanopartículas en un tumor se mide con el tiempo el uso de software de análisis de imagen. Esta técnica proporciona un método para visualizar y cuantificar tanto la dinámica de las nanopartículas en los tumores humanos.
Protocolo
1. La inoculación del tumor en CAM de embriones aviar
- Prepare caparazón fecundado embriones de pollo como se describe 8.
- El día 9 del desarrollo embrionario, montar una micro-inyección con una aguja de calibre 18 conectada a una jeringa de 1 ml. Corte un pedazo de 5.6 pulgadas de tubo Tygon (1 / 32 "de diámetro interior de 3 / 32" de diámetro exterior, 1 / 32 "espesor de pared) e inserte con cuidado el bisel de la aguja en el tubo. Aproximadamente 5.4 pulgadas de la tubería debe se extienden desde la punta de la aguja (Figura 1a).
- Llene la jeringa y el tubo con la suspensión celular. A continuación, insertar una aguja de vidrio microinyección en el extremo del tubo y retirar con cuidado las burbujas de aire.
- Día 9 inyectar embriones (Figura 1b) con un alcance de disección con un iluminador con 10.000-100.000 células cancerosas como un bolo dentro de la CAM (Figura 1c). Inyecte lentamente y con cuidado las células asegurar que la aguja está en el lugar correcto para que las células para formar un bolo visible dentro de la CAM. Las células que caiga agua sobre la superficie de la CAM se pueden limpiar con aplicador Kimwipe u otros.
- Volver a los embriones humidificado incubadora a 38 ° C a 60% de humedad y permitir que el tumor crezca y vascularizan (hasta 7 días).
2. Preparación de nanopartículas
- Para preparar la etiqueta fluorescente nanopartículas CPMV para la inyección en el embrión de pollo, diluir las nanopartículas viral (sintetizado como en 8 en PBS, pH 7,4, a una concentración de la mezcla de Vortex 100 ug / ml antes de usar y centrifugar durante un minuto para eliminar cualquier. agregados. sonicación también puede ser útil en función de los conjugados y el grado de agregación. Las existencias de CPMVs marcados con fluorescencia son estables durante al menos 1 año cuando se almacenan a 4 ° C en la oscuridad. Revise periódicamente las existencias por poner un par de gotas en un portaobjetos de vidrio y la comprobación de la fluorescencia. Microscopía Electrónica de Transmisión (TEM) también se puede utilizar para determinar si las partículas se mantuvo intacta después de la conjugación.
- En pocas palabras, un microgramo de nanopartículas viral (en un volumen final de 2 l) se pueden agregar a las redes de cobre recubierto. A continuación, agregue un volumen igual de acetato de uranilo al 2% durante 1 minuto a microscopio electrónico (Philips EM 410).
3. La inyección intravenosa de fluorescencia marcado con nanopartículas viral
- El día 16, ensamblar micro-inyector como se describió anteriormente. Elaborar volumen deseado de nanopartículas viral a través de la tubería en la jeringa (> 200 l). Retire con cuidado las burbujas de aire. Inserte la aguja de microinyección de vidrio en el extremo de la tubería. Asegúrese de que la aguja es tan larga y afilada como sea posible (Figura 2a). Si la aguja es demasiado contundente, que no será capaz de penetrar a través del ectodermo y no podrá penetrar en el buque. Si la aguja es demasiado fuerte, la punta se derrumbará al penetrar los tejidos.
- Por vía intravenosa se inyectan 100 l de una dextrano mg / ml de fluoresceína (MW 70.000 Da, Invitrogen) en embriones portadores de tumores distales del sitio que se desea visualizar (Figura 3d). La canalización de la vena CAM éxito es evidente por la limpieza de sangre en el camino de la inyección en flujo (Figura 2b). Evaluar vascular fuga una hora después de la inyección.
- Por vía intravenosa inyectar 50 l de 1 mg / ml de solución de CPMV-Alexa Fluor 647 (CPMV AF-647) o pegilado CPMV-Alexa Fluor 647 (CPMV-PEG-AF 647) en embriones que contienen los tumores con fuga vascular distal desde el sitio deseado ser visualizado.
- Tumores de la imagen de inmediato y cada hora después de la inyección con un Zeiss examinador Z1 microscopio vertical equipado con un disco giratorio Yokogawa, Hamamatsu Imagen 9100-12 EM-CCD de la cámara.
4. En tiempo real intravital de imágenes
- Para montar la unidad de imagen embrión, aplique una fina capa de grasa de vacío alrededor de la circunferencia de la imagen del puerto en la parte inferior de la tapa de la unidad de imagen de embriones, y monte un cubreobjetos de 18 mm de vidrio en el puerto.
- La posición del embrión de tal manera que el cubreobjetos se cubra el área deseada para la imagen. Baje lentamente la tapa hasta que el cubre sólo se pone en contacto con el embrión, y luego el tornillo de la tapa sobre la unidad para mantenerla en su lugar (figura 2c).
- Agregar agua caliente a 37 ° C en la unidad de imagen embrión fuera de la cápsula que contiene el embrión, y luego poner el equipo completo en el escenario de un microscopio confocal en posición vertical con la cámara en el interior del medio ambiente equilibrado a 37 ° C.
- La posición de la unidad de imagen que contiene el embrión con el microscopio de fluorescencia confocal de disco giratorio (Figura 2e). La unidad de imagen tendrá el embrión en su lugar y mantener el campo de vista fijo, mientras que la captura de imágenes, teniendo en cuenta tanto en tres dimensiones pilas Z y las imágenes con lapso de tiempo para ser capturado. Nos adquirir y analizar en tres dimensiones del tiempo-lapso imágenes utilizando Perkin Elmer (antes Improvisación) paquete de software Volocity (Figura 3a). Adquirir una alta resolución en tres dimensiones de la pila de tumor y los vasos sanguíneos circundantes para visualizar detailed análisis estructurales en determinados puntos de tiempo. Adquirir en tres dimensiones las pilas a intervalos regulares de tiempo a los puntos de mapa detallado los cambios estructurales en la vasculatura tumoral. Imágenes de tumores cada hora después de la inyección.
- Cuantificar la absorción de las nanopartículas viral mediante el cálculo de la media Alexa Fluor (AF) 647 de la señal dentro de las regiones seleccionadas en el tumor o en el estroma (tejido no tumoral del área) utilizando software de cuantificación de imágenes como Volocity (Perkin Elmer). El tumor de estroma relación se calcula dividiendo la media de la señal AF 647 en el tumor durante la media de la señal de AF 647 en el estroma. Una relación tumor / estroma superior a 1 indica que las nanopartículas se está tomando por el tumor.
5. Los resultados representativos:
En el ejemplo descrito aquí, se inyectó células HT-29 de cáncer de colon para formar un bolo de aproximadamente 1 mm de tamaño dentro de la CAM de embriones de pollo 9 días (Figura 1b). Después de la inoculación, los embriones se cultivaron durante 7 días en un incubador humidificado para permitir el crecimiento del tumor y la vascularización suficiente (Figura 1c). Los embriones fueron inyectados por vía intravenosa con un dextrano de bajo peso molecular para confirmar la vascularización del tumor, y los tumores se visualizaron con un microscopio Zeiss AxioExaminer Z1 en posición vertical (Figura 2d).
Tras la administración intravenosa de CPMV AF-647 o CPMV-PEG-AF nanopartículas 647 (Figura 3a yb), de alta resolución en tiempo real microscopía confocal (Figura 2e) reveló que los dos CPMV y PEG-CPMV nanopartículas rápidamente la etiqueta de la vasculatura todo, pero la captación de CPMV-PEG por el tumor fue de aproximadamente 3 veces mayor que CPMV después de 12 horas (Figura 3a). La captación del tumor en relación de las nanopartículas se determinó utilizando el software de análisis de imagen (Volocity de Perkin Elmer). Las regiones de interés fueron seleccionados dentro y fuera del tumor (en el compartimiento del estroma) y la media de intensidad de fluorescencia de cada determinó. Los datos se expresan como la relación tumor / estroma.
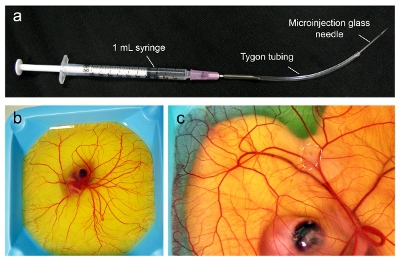
Figura 1. Microinyección de los tumores en la CAM de un embrión aviar. (A) El aparato de microinyección se ensambla a partir de los componentes como se indica. (B) embriones de aves en el día 9 están listos para ser inoculados con el tumor cuando la CAM se ha extendido para cubrir toda la superficie. (C) En el día 16, el tumor ha crecido a un máximo de 1 cm de diámetro (línea discontinua) y está listo para la inyección de nanopartículas.
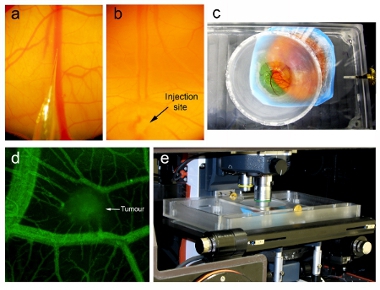
Figura 2. Inyección de nanopartículas y de imagen intravital. Inyección debajo de un microscopio de disección que muestran (a) la punta de la aguja microinyector lista para ser inyectada en la vena CAM y (b) la aguja microinyector inserta en la vena (indicado por la flecha) y nanopartículas inyectadas en el flujo de sangre (se observa en la limpieza de de la sangre). (C) Unidad de imagen que contiene embrión aviar con el cubreobjetos interconectados directamente con la CAM. (D) Antes de la inyección de nanopartículas, la vascularización del tumor se evaluó a través de imágenes intravital después de la inyección de fluoresceína dextrano. (E) Unidad de imagen que contiene el embrión situado en la platina de un microscopio confocal en posición vertical dentro de una temperatura regulada conjunto recinto a 37 ° C.
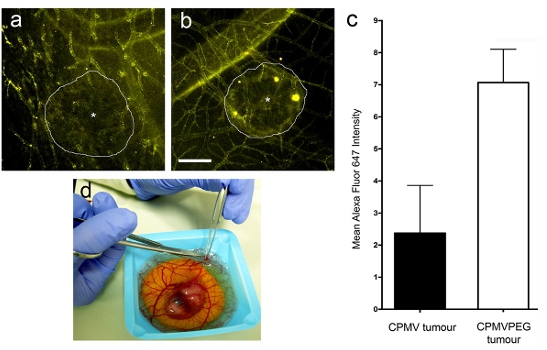
Figura 3. Intravital visualización de la absorción de nanopartículas en los tumores humanos. Los tumores se visualizan siete horas después de la inyección de (a) CPMV-AF647 y (b) CPMV-PEG-AF647. d) Escisión de tumor de embrión aviar para su posterior análisis.
Discusión
La membrana corioalantoidea (CAM) del embrión aviar es un modelo útil para evaluar la dinámica vascular y la farmacocinética de los tumores humanos. La estructura y la posición de la CAM permite la adquisición de imágenes de alta calidad y capacidad de muchos tipos de xenoinjertos de cáncer, sin procedimientos quirúrgicos invasivos. Por otra parte, xenoinjertos de cáncer de tumor implantado en la membrana corioalantoidea ser vascularizado dentro de 7 días, que ofrece un medio rápido, barato y semi-alto rendimiento-para evaluar la acumulación de nanopartículas en el tejido tumoral. Desde xenoinjertos de cáncer de implantado en el CAM de embriones de pollo sin caparazón se puede acceder a la óptica de alta resolución de un microscopio de epifluorescencia vertical o confocal, la información contextual y temporal en relación con la absorción de nanopartículas en los vasos sanguíneos del tumor se pueden obtener fácilmente. Xenoinjertos de cáncer en este modelo tienden a crecer lateralmente a través de la CAM, dando lugar a tumores que son grandes sin dejar de ser menos de 200 m de profundidad. Esto los hace especialmente adecuado para la imagen intravital porque estándar de los microscopios de epifluorescencia efectivamente puede penetrar en la masa tumoral completa. Por el contrario, los tumores implantados en cualquiera de los sitios superficiales o ortotópico en el ratón proliferan en tres dimensiones, lo que hace difícil localizar con precisión las nanopartículas en lo profundo de estos tumores por técnicas no invasivas. Hemos utilizado este modelo para evaluar la absorción de los puntos cuánticos, liposomas, nanopartículas de óxido de hierro y en una serie de xenoinjertos de tumores humanos, destacando el potencial de este modelo es adecuado para el análisis in vivo de una amplia gama de formulaciones de nanopartículas.
Divulgaciones
Agradecimientos
Este estudio fue apoyado por CCSRI # 700537 Grant y CIHR subvención n º 84535 de JDL y los NIH / NCI subvención # CA120711-01A1-01A1 y CA120711 a AZ. Todos los experimentos se realizaron de acuerdo con los reglamentos y directrices del animal de Atención Institucional y el empleo Comisión de la Universidad de California en San Diego, Cuidado de Animales y Uso de la Universidad de Western Ontario.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo Nombre / Equipo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Fecundado los huevos Leghorn | Criadero de Frey `s, St. Jacobs | N / A | |
| Herramienta rotativa Dremel | Dremel | Se puede usar cualquier modelo | |
| Dremel ruedas de corte no. 36 | Dremel | 409 | |
| Deportista nacedora | Berry Hill | 1550HA | |
| Deportista incubadora | Berry Hill | 1502EA | |
| Etanol | 70% (vol / vol) | ||
| Poliestireno pesan barcos | VWR | 12577-01 | |
| Plaza de Petri | Simport, VWR | 25378-115 | |
| Rubbermaid un recipiente con tapa de goma | Guillevin | RH3-228-00-BLU | agujeros perforados en los lados |
| Vertical tirador de la pipeta | David Kopf Instruments | modelo 720 | Ajustes: 16,3 (calefacción) y 2.3 (solenoide) |
Borosilicato de sodio tubos capilares | Sutter Instrumento | BF100-58-10 | (OD, 1,0 mm; ID 0,58 mm, 10 cm de longitud) |
| 1X Dulbecco Eagle modificado (DMEM) | Invitrogen | 11995073 | |
| Dulbecco | Invitrogen | 14190250 | pH 7,4 |
| De buffer fosfato salino (D-PBS) (1X), líquido | |||
| Tripsina, 0,05% (1X) con EDTA 4NA, líquido | Invitrogen | 25300054 | |
| De suero fetal bovino | Invitrogen | 12483-020 | El calor inactiva |
| Hemocitómetro | Hausser Científico, VWR | 15170-090 | |
| Centrífugo | Eppendorf modelo 5810R | 5811 000.010 | |
| Pinzas de punta fina | VWR | 25607-856 | |
| Tygon R-3603 tubos | VWR | 63009-983 | (50 pies de diámetro 1/32-inch interior, diámetro exterior 3/32-inch, espesor de la pared 1/32-inch |
| Agujas hipodérmicas para las inyecciones de calibre 18 agujas | BD | 305195 | Caja de 100 |
| Jeringas de 1 ml para inyección | BD | 309602 | Caja de 100 |
| De fibra óptica de microscopio iluminador | Amscope | HL250-AY | 150W |
| Kimwipes | VWR | 10805-905 | |
| V. unguiculata semillas (California negro de ojos no. 5) | Burpee | 51771A | |
| Las luces interiores del crecimiento | SunLite, suministro del jardinero | ||
| Metil-éster-NHS PEO4 | Atravesar | PI22341 | |
| mPEG-NHS, el PEG succinimidil éster, 2000 MW | NANOCS | PEG1-0002 | |
| Alexa Fluor 647 carboxílico (succinimidil éster) | Invitrogen | A20006 | |
| Oregon Green 488 éster de succinimidilo * 6-isómero * | Invitrogen | O-6149 | |
| Dimetilsulfóxido (DMSO) | Sigma | D8418 | |
| Dibásico monohidrógeno fosfato | Sigma | 379980 | K2HPO4 (para el tampón phopshate) |
| Monobásico dihidrogenofosfato | P5655 | KH2PO4 (para el tampón phopshate) | |
| Superose 6 columna de exclusión por tamaño | GE Healthcare ciencias de la vida | 17-0673-01 | |
| ÄKTA Explorer 100 cromatógrafo | GE Amersham Pharmacia | WS-AKTA100 | |
| ÄKTA kit de alto flujo | GE Healthcare ciencias de la vida | 18-1154-85 | |
| Sacarosa | Sigma | S0389 | |
| Ultracentrífuga | Beckman | ||
| SW 28 Ti rotor | Beckman | 342204 | Basculantes |
| 50.2 Ti rotor | Beckman | 337901 | Ángulo fijo |
| Amicon Ultra-15 unidades de filtración centrífuga | Millipore | UFC910008 | 100 kDa cortar |
| Gradiente de ex | Biorad | ||
| dextrano, fluoresceína, 70.000 MW, aniónicos | Invitrogen | D1823 | |
| Spinning microscopio de fluorescencia confocal de disco | Quórum, Yokogawa CSU 10, Yokogawa | N / A | |
| Epifluorescencia amplio campo del microscopio | Quórum; Zeiss Axio Examiner, Zeiss | N / A | |
| Hamamatsu Imagen 9100-12 EM-CCD de la cámara | Quórum; Hamamatsu | N / A | |
| Temperatura de la unidad de caja microscopio | Plásticos de precisión | N / A | |
| Grasa de vacío | VWR | 59344-055 | |
| Cubreobjetos de vidrio circular no. 1 (18 mm) | VWR | 16004-300 | |
| Volocity software | Perkin Elmer | ||
| Polluelo recinto embrión | fabricados a medida | ||
| Tijeras delicadas | VWR | 25608-203 | |
| Formalina | Bioshop | FOR201.500 | Su uso en fumehood |
| De corte óptimo | Fisher, Tissue Tek | 1437365 | |
| Temperatura (OCT) | |||
| Moldes de plástico | Pescador | 22-038217 | |
| VWR VistaVision HistoBond adhesivo Diapositivas | VWR | 16004-406 | |
| Prolongar oro con DAPI | Invitrogen | P36931 | |
| Cuchillas desechables de criostato | Pescador | 12-634-2 | |
| Criostato | Leica CM 3050 S | 14047033518 |
Referencias
- Halin, C., Mora, J. R., Sumen, C., von Andrian, U. H. In vivo imaging of lymphocyte trafficking. Annu Rev Cell Dev Biol. 21, 581-603 (2005).
- Judenhofer, M. S. Simultaneous PET-MRI: a new approach for functional and morphological imaging. Nat Med. 14, 459-465 (2008).
- Weissleder, R., Pittet, M. J. Imaging in the era of molecular oncology. Nature. 452, 580-589 (2008).
- Chambers, A. F., Ling, V. Selection for experimental metastatic ability of heterologous tumor cells in the chick embryo after DNA-mediated transfer. Cancer Res. 44, 3970-3975 (1984).
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clin Exp Metastasis. 22, 225-236 (2005).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer cell. 13, 221-234 (2008).
- Lewis, J. D. Viral nanoparticles as tools for intravital vascular imaging. Nature medicine. 12, 354-360 (2006).
- Leong, H. S. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature protocols. 5, 1406-1417 (2010).
- Chatterji, A. New addresses on an addressable virus nanoblock; uniquely reactive Lys residues on cowpea mosaic virus. Chemistry & biology. 11, 855-863 (2004).
- Brunel, F. M. Hydrazone ligation strategy to assemble multifunctional viral nanoparticles for cell imaging and tumor targeting. Nano letters. 10, 1093-1097 (2010).
- Steinmetz, N. F., Manchester, M. PEGylated viral nanoparticles for biomedicine: the impact of PEG chain length on VNP cell interactions in vitro and ex vivo. Biomacromolecules. 10, 784-792 (2009).
- Steinmetz, N. F., Cho, C. F., Ablack, A., Lewis, J. D., Manchester, M. CPMV nanoparticles target surface vimentin on cancer cells. Nanomedicine. , (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados