Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En uncoating in vitro del VIH-1 Cores
En este artículo
Resumen
Uncoating es un paso esencial en la fase temprana del ciclo de vida del VIH-1 y se define como el desmontaje de la cápside y la liberación de los complejos de ribonucleoproteína viral (vRNP). En este sentido, demostrar las técnicas para el aislamiento de los núcleos intactos del VIH-1 viriones y cuantificar sus uncoating In vitro.
Resumen
El genoma de los retrovirus está encerrado en una cápside rodeado por una envoltura lipídica. Para los lentivirus como el VIH-1, la cónica cápside está compuesta de proteína CA organizó como una red de hexágono. La cápside está cerrado por siete pentámeros en la punta gruesa y 5 en el extremo estrecho del cono 1, 2. Encerrado en esta cápside se encuentra el complejo ribonucleoproteína viral, y juntos constituyen el núcleo.
Después de la fusión de la membrana viral con la membrana celular de destino, el VIH-1 es liberado en el citoplasma. La cápside se desmonta la liberación libre de CA en forma soluble 3 en un proceso conocido como uncoating. La localización intracelular y el momento del VIH-1 uncoating son poco conocidos. Solo sustituciones de aminoácidos en la CA que alteran la estabilidad de la cápside también afectar la capacidad del VIH-1 para infectar las células 4. Esto indica que la estabilidad de la cápside es fundamental para la infección VIH-1. VIH-1 uncoating ha sido difícil de estudiar debido a la falta de disponibilidad de ensayos sensibles y fiables para este proceso. Aquí se describe un método cuantitativo para el estudio de uncoating in vitro utilizando núcleos aislados de infecciosas del VIH-1 partículas. El enfoque incluye el aislamiento de los núcleos por la sedimentación de los viriones concentrada a través de una capa de detergente y en un gradiente lineal de sacarosa, en el frío. Para cuantificar uncoating, los núcleos aislados se incuban a 37 ° C durante varios intervalos de tiempo y, posteriormente, se sedimentaron por ultracentrifugación. El grado de uncoating se analiza mediante la cuantificación de la fracción de CA en el sobrenadante. Este enfoque ha sido empleado para analizar los efectos de las mutaciones virales de VIH-1 en la estabilidad de la cápside 4, 5, 6. También puede ser útil para estudiar el papel de los factores celulares del VIH-1 uncoating.
Protocolo
1. La producción de partículas de VIH-1
Antes de continuar, usted debe obtener el permiso y seguir las directrices de la oficina de Bioseguridad de la institución para trabajar en un centro de bioseguridad aprobada por el VIH infeccioso. Usted debe asegurarse de que el cuidado y las precauciones de seguridad son seguidos durante el trabajo en el laboratorio de bioseguridad.
La producción de partículas de VIH-1 se realiza típicamente mediante transfección transitoria de células 293T con el VIH-1 proviral DNA utilizando un fosfato de calcio método de transfección 7, 8. Las reservas de virus de alto título crecido en la cultura de las células T infectadas son también adecuados.
- Cultura células 293T en Dulbecco modificado del medio Eagle (DMEM) que contiene 10% de suero fetal bovino (SFB) y complementado con antibióticos [penicilina (100 UI / ml) y estreptomicina (100 ug / ml)] a 37 ° C, 5% de CO 2 .
- Separar las células de los platos casi confluentes con 0,25% de tripsina-EDTA y las semillas de 2x10 6 células en 9 ml por cada 100 mm placa de cultivo de un día antes de la transfección. Semillas de seis platos de 100 mm de cultivo para la producción de viriones. Si la preparación del concentrado de los núcleos se requiere, más platos podría ser cabeza de serie para la transfección.
- Al día siguiente, las monocapas de células debe ser alrededor del 25% confluentes y listo para la transfección. Por seis platos de las células a transfectar, trae 120 mg de material de ADN con un volumen de 2,7 ml con agua estéril. A esta mezcla se añaden 0,3 ml de 2,5 M CaCl 2 y 3 ml de 2XBBS, y mezclar bien con la pipeta hacia arriba y abajo varias veces. Deje que la mezcla repose a temperatura ambiente durante 10-20 minutos.
- Añadir 1 ml de la mezcla resultante gota a gota en el centro de cada plato mientras agita suavemente para mezclar. Coloque los platos durante la noche (~ 16 horas) en una incubadora a 35 ° C y 3% de CO 2.
- Aspirar el medio de cultivo y cuidado añadir 5 ml de PBS.
- Aspirar PBS y añadir 5 ml de medio fresco. Cultivar las células en la incubadora a 37 ygrados; C y 5% de CO 2 durante 24-48 horas adicionales.
- Recoger el sobrenadante de cultivo que contienen partículas virales, la transferencia a un tubo de 50 ml de centrífuga cónico. Combine los sobrenadantes de todos los platos y se centrifuga a 1.500 g durante 5 min para precipitar las células y los escombros. Se filtra el sobrenadante con 0.45 micras de tamaño de poro, filtros de jeringa. Se deben tomar precauciones para reducir al mínimo la formación de aerosoles al trabajar con el virus vivo. Esto incluye el uso de tubos cónicos con anillos o cubiertas cubo del rotor durante la etapa de centrifugación. Si esto no es posible, los tapones de rosca de los tubos deben ser envueltas con parafilm.
2. La concentración del VIH-1 viriones por ultracentrifugación
- Coloque el sobrenadante del cultivo (30 ml) en un tubo de centrífuga de 38,5 ml polyallomer (por Beckman rotor SW32Ti o equivalente). Suavemente subyacen en el sobrenadante que contiene virus con 5 ml de solución de sacarosa al 20% en PBS utilizando una pipeta de 5 ml.
- Centrifugar durante 3 horas a32.000 rpm a 4 ° C (175.000 xg en r max) a las partículas de virus de pellets.
- Aspirar el sobrenadante por aspiración, teniendo cuidado de no perturbar el sedimento en el fondo del tubo. Añadir 0,5 ml de 1XSTE buffer (10 mM Tris-HCl [pH 7.4], 100 mM NaCl, 1 mM EDTA) en el tubo y el lugar a 4 ° C durante 1 hora para aflojar el sedimento. El uso de un gran calibre una punta de la pipeta suavemente ml pipeta hacia arriba y abajo varias veces para separar el sedimento del fondo del tubo. A continuación, la transferencia de la suelta de pellets a un tubo de microcentrífuga de 1,5 ml, teniendo cuidado de evitar la formación de espuma. Incubar a 4 ° C durante 1-3 horas a otro para permitir que el pequeños grupos de virus que se dispersaran. Durante este periodo, preparar el gradiente de sacarosa como se describe en el paso 3.1.
- Pipeta suavemente la suspensión de virus de arriba a abajo varias veces y centrifugar a 8.000 rpm (6.000 xg) a 4 ° C en una microcentrífuga refrigerada durante 1 minuto para eliminar acumulaciones residuales. Mantener el frío de la muestra durante este proceso.
3. Gradiente de sacarosacentrifugación para aislar los núcleos
VIH-1 en núcleos aislados mediante un "spin-thru" método 9 que es una modificación del método descrito anteriormente para la purificación del VIH-2 núcleos de 10.
- Prepare un 12 ml lineal del 30% al 70% de gradiente de sacarosa en tampón 1XSTE en un tubo de centrífuga de 14,5 ml polyallomer para SW32.1Ti rotor. Para preparar el gradiente, use un gradiente de 20 ml primero, el lugar de 6 ml de solución de sacarosa al 70% en el lado cercano (cerca del puerto de salida) y 6 ml de solución de sacarosa al 30% en el otro lado. Asegúrese de que las burbujas de aire no están atrapados en el canal que conecta las dos cámaras. Utilice el Auto Densi-Flow pendiente anterior a la bomba de la pendiente de la parte inferior de la parte superior del tubo que contiene 1 ml de solución de sacarosa al 85% en la parte inferior. Coloque con cuidado el gradiente a 4 ° C hasta que se enfríe (2-4 horas).
- El uso de un gran calibre una punta de la pipeta ml suavemente el gradiente de superposición con 0,25 ml de solución de sacarosa al 15% en ECE contiene 1% de Triton X-100.
- Suavemente superposición con 0,25 ml de solución de sacarosa al 7,5% en ECE con un gran calibre una punta de la pipeta ml. Tenga cuidado de no mezclar las capas.
- Suavemente superposición con 0,5 ml de suspensión del virus a partir del paso 2.4. Este paso debe realizarse con cuidado para evitar cualquier alteración en el gradiente y la mezcla de las capas de sacarosa underlaid.
- Colocar los tubos en el cubo de pre-enfriado SW32.1Ti y centrifugar a 32.000 rpm (187.000 xg en r max) durante la noche (16-20 horas) a 4 ° C. Para evitar hacer una pausa de la centrífuga, no comience hasta que el vacío de centrifugación en la centrífuga alcanza los 250 m
- Recoger fracciones de 1 ml de arriba a abajo de la pendiente con el fraccionador gradiente de Auto-densidades de flujo. Coloque los tubos en hielo inmediatamente después de la recolección. Mezclar el contenido de los tubos por inversión varias veces, y retirar 50 l de cada fracción para la cuantificación por ELISA o ensayo de la actividad de la transcriptasa inversa.
4. La localización de los núcleos de VIH-1y el almacenamiento de núcleos
- Antes de realizar los ensayos de uncoating, es importante para determinar qué fracciones contienen intacto el VIH-1 núcleos. Esto puede ser determinado por p24 ELISA o ensayo de actividad de la transcriptasa inversa con el 50 alícuotas a partir del paso 3.6.
- La recuperación de la CA asociada a los núcleos es a menudo relacionado con la estabilidad de los núcleos. Medir el núcleo asociado CA por p24 ELISA 9 con una muestra de cada fracción. Por otra parte, medir la actividad de la transcriptasa inversa de cada fracción. Utilizando ambos métodos, el pico debe estar alrededor de la fracción 10.
- Piscina de las fracciones que contienen núcleos. Si los núcleos no se van a utilizar para el ensayo de uncoating inmediatamente, alícuota de los núcleos agrupados en 0,2 a 0,3 ml alícuotas, flash de congelación en N2 líquido y se almacena a -80 ° C. Núcleos congelados de esta manera son adecuadas para el ensayo de uncoating. El rendimiento de la CA de núcleo asociados es típicamente 1-2 mg por mililitro de p24 o alrededor del 15% del total del virión asociadasp24.
5. Ensayo de cinética del VIH-1 uncoating
- La cantidad de VIH-1 requiere núcleos por reacción uncoating es de aproximadamente 50 ng. Para realizar el ensayo in vitro uncoating, Prediluya la alícuota de los núcleos con un volumen igual de tampón 1XSTE frías para reducir la viscosidad de la suspensión y minimizar los errores de pipeteo.
- Volver a diluir 100 l de los núcleos a 0,15 ml de solución tampón 1XSTE el resfriado que contienen 10 mg / ml de BSA en un tubo de microcentrífuga de 1,5 ml. Nosotros complementamos el tampón STE con BSA (10 mg / ml) para minimizar la adsorción de CA a las paredes del tubo. Mix de veces la vuelta al tubo varias. No vórtice de las muestras. Incubar los tubos en un baño de agua a 37 ° C durante intervalos de tiempo (15, 30, 60 y 120 minutos). Los tubos se deben sumergir en un baño de agua por lo menos hasta el nivel de la muestra interna con el fin de garantizar incluso el calentamiento.
- Durante la incubación, mezcle suavemente el contenido del tubo de forma periódica (por lo general 5 -10 min) por el parpadeo del tubo. Para un control minuto cero, diluir 100 l de núcleos en 0,15 ml de solución tampón 1XSTE frío e incubar en hielo durante toda la duración del experimento (120 min). El control de minuto cero nos da el valor basal uncoating y se utiliza para determinar aumento de uncoating de los núcleos se incuba a 37 ° C durante diferentes intervalos de tiempo.
- Al final del período de incubación, detener el proceso de uncoating colocando los tubos en hielo durante 10 minutos.
- Centrifugar los tubos a 45.000 rpm (TLA-55 de rotor, 125.000 xga r max) durante 20 minutos a 4 ° C. Esto pellet los núcleos intactos y la libre circulación de CA liberados como resultado de uncoating de núcleos que permanecen en el sobrenadante. El rotor debe ser pre-enfriado a 4 ° C antes de cargar las muestras.
- Transferir el sobrenadante a tubos de microcentrífuga nuevo preenfriado preferiblemente con carga de gel-tips almacenarse a temperatura ambiente. Tenga en cuenta que la pastilla no será visible a simple vista, a fin de tomar extremo cuidado wientras pipeteo con el sobrenadante. Volver a suspender las pastillas en 250 ml del diluyente de la muestra de ELISA (0,5% Triton X-100 y el 5% de los donantes de suero de ternera en PBS). Eficiente para asegurar la disolución de la pastilla, torbellino después de agregar el diluyente de la muestra de ELISA. Cuantificar el contenido de CA de la pastilla y el sobrenadante utilizando p24 ELISA como se describe en la siguiente sección.
- El grado de uncoating se obtiene mediante el cálculo de la fracción de CA presentes en el sobrenadante.
6. Ensayo para CA por p24 ELISA
- Muchos kits comerciales de ELISA están disponibles y pueden ser utilizados para cuantificar CA. Uso comercial o de cualquier "in-house" ELISA e incluyen normas p24 para determinar la linealidad del ensayo. Diluciones de las muestras deben analizarse para asegurar la exactitud.
- Hemos desarrollado un ELISA caseros que utilizan habitualmente para el ensayo de CA. El procedimiento es una adaptación del anterior informe 11 y se realiza con anticuerpos de captura y el detector dispone de la AID NIHS Programa de Investigación y reactivos de referencia.
7. Los resultados representativos:
Un ejemplo de un resultado de ELISA para la determinación de las fracciones que contienen núcleo se muestra en la Figura 1. Después de recoger las fracciones (1 ml cada uno), 50 l de muestra de cada fracción se utilizó para hacer diluciones seriadas y se analizaron por ELISA. El p24 total obtenido al sumar los valores de los doce fracciones fue de 14,5 mg. Como se muestra en las fracciones de la figura 8 a 10 núcleos de contenidos. El valor de p24 en las fracciones de núcleo que contiene 2,17 mg fue. El porcentaje de cursos asociados a p24 (14,97%) se determinó tomando la relación entre el valor de p24 en las fracciones de núcleo (2,17 mg) en el valor total de p24 (14,5 mg). Fracción de 1 o 2 siempre contendrá mayor cantidad de p24, lo que representa CA libre que no está asociado con los núcleos. Esto es seguido por una reducción gradual en los valores de p24 con cada fracción posterior, y luego un fuerte incremento y, finalmente, una fuerte caída de la p24valores. Si se cuida bien durante la carga de la pendiente entonces el pico de la central asociada a CA se encuentra alrededor de la fracción 10.
Un resultado típico obtenido mediante el análisis de la cinética de uncoating del VIH-1 núcleos se muestra en la Figura 2. El gráfico muestra un incremento en función del tiempo en uncoating de tipo salvaje VIH-1 en los núcleos. El porcentaje uncoating valor se obtuvo mediante el cálculo de la fracción de CA presentes en el sobrenadante. Con la práctica, el ensayo es altamente reproducible y es útil para determinar la estabilidad de los núcleos viral in vitro. Tenga en cuenta que la reproducibilidad de la prueba depende en gran medida el manejo adecuado de las muestras durante el procedimiento. Puesto que los núcleos son inestables al calor, las muestras deben mantenerse a 4 ° C durante todo el ensayo, excepto durante el período de incubación.
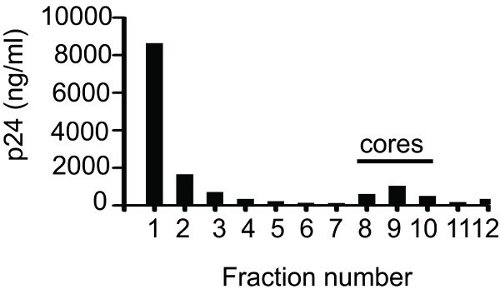
Figura 1 densidad de equilibrio centrifugación en gradiente deVIH-1 en los núcleos. Una suspensión de virus concentrado se aplicó a la parte superior de un gradiente de sacarosa 30 a 70% lineal superpuesto con el 1% de Triton X-100. Después de la centrifugación a 187.000 xg durante la noche y 4 ° C, fracciones de 1 ml se obtuvieron de la parte superior (fracción 1) hacia abajo (Fracción 12) y p24 se cuantificó por ELISA.
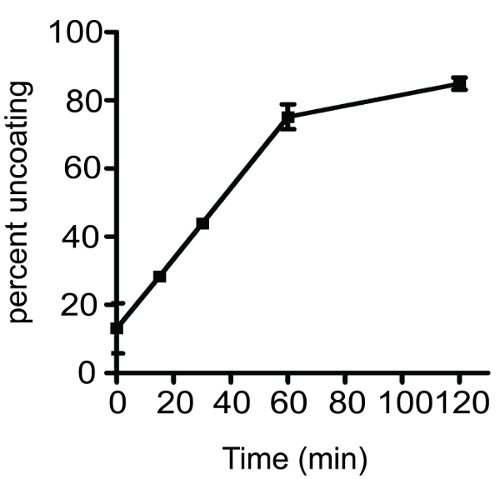
Figura 2 Evolución temporal del VIH-1 uncoating in vitro. Purificada del VIH-1 núcleos se diluyeron y se incuba a 37 ° C durante los intervalos de tiempo indicado. La muestra min cero se incubó en hielo durante toda la duración del experimento. Después de la incubación, las muestras fueron ultracentrifuga a 125.000 g durante 20 minutos a 4 ° C. Sobrenadante y los pellets se separaron y se analizaron por ELISA p24. El grado de uncoating se determinó como se describe en el texto del protocolo. Cada reacción uncoating se realizó por duplicado, las barras de error abarcan todo el rango de los dos valores.
Discusión
El método descrito aquí para purificar el VIH-1 para estudiar los núcleos uncoating in vitro es útil para el estudio de esta fase del ciclo de vida del VIH-1, sobre todo debido a la falta de un método validado para analizar el VIH-1 uncoating en las células diana. Aunque este método utiliza el equilibrio ultracentrifugación para purificar los núcleos, otros han utilizado granulación directa después de la lisis breve con un 1% Triton X-100-12, 13 o granulación a través de un colchón de sacarosa r...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
VIH-1 uncoating estudios en el laboratorio Aiken fueron apoyados por las subvenciones del NIH AI40364, AI50423 y AI076121. Varios materiales clave, como los reactivos utilizados en el p24 ELISA, fueron proporcionados por la Investigación y el Programa de SIDA de los NIH de referencia de la División de SIDA, NIAID, NIH.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| DMEM | Cellgro | 10 a 013 CV | |
| PBS | Cellgro | 21 a 031 CV | |
| Triton-X-100 | Mallinckrodt Baker Inc | 9002-93-1 | |
| Tween 20 | Acros | 9005-64-5 | |
| 0,25% de tripsina-EDTA | Cellgro | 25 a 053-CI | |
| 2XBBS | Composición: 50 mm BES [p H 6,95], 280 mM NaCl y 1,5 mM Na 2 HPO 4. Ajustar el pH a 6,95a temperatura ambiente. Filtro de esterilizar y almacenar en alícuotas a -20 ° C. | ||
| Anticuerpo de recubrimiento: Anticuerpo monoclonal para p24 (183-H12-5C) | SIDA de los NIH Programa de Investigación y Referencia Reactivo | 3537 | |
| Primaria de anticuerpos de VIH-Ig (suero hiperinmune paciente humano) | NIH Investigación sobre el SIDA Programa de referencia y los reactivos | 3957 | |
Anticuerpo secundario: De cabra anti-IgG humana, conjugado con peroxidasa | Atravesar | 31130 | |
| HRP sustrato | KPL Inc | 50-76-11 | |
| Immulon 2HB placas de 96 pocillos | Thermo Scientific | 3455 | |
| SW32Ti SW32.1 y rotores de Ti y ultracentrífuga compatible | Beckman Coulter | ||
| TLA-55 de rotor y ultracentrífuga de mesa | Beckman Coulter | ||
| Alta velocidad de los tubos de microcentrífuga | Beckman Coulter | 326823, 358123, 357448 | |
| Auto-Densi densidad de flujo gradiente fraccionador | Labconco Corp. | 4517000 | |
| Gradiente de ex | CBS Scientific Co. Inc. | GM-20 |
Referencias
- Ganser, B. K., Li, S., Klishko, V. Y., Finch, J. T., Sundquist, W. I. Assembly and analysis of conical models for the HIV-1 core. Science. 283, 80-83 (1999).
- Li, S., Hill, C. P., Sundquist, W. I., Finch, J. T. Image reconstructions of helical assemblies of the HIV-1 CA protein. Nature. 407, 409-413 (2000).
- Aiken, C. Viral and cellular factors that regulate HIV-1 uncoating. Curr. Opin. HIV. AIDS. 1, 194-199 (2006).
- Forshey, B. M., Schwedler, U. v. o. n., Sundquist, W. I., Aiken, C. Formation of a human immunodeficiency virus type 1 core of optimal stability is crucial for viral replication. J. Virol. 76, 5667-5677 (2002).
- Forshey, B. M., Aiken, C. Disassembly of human immunodeficiency virus type 1 cores in vitro reveals association of Nef with the subviral ribonucleoprotein complex. J. Virol. 77, 4409-4414 (2003).
- Wacharapornin, P., Lauhakirti, D., Auewarakul, P. The effect of capsid mutations on HIV-1 uncoating. Virology. 358, 48-54 (2007).
- Chen, C., Okayama, H. High-efficiency transformation of mammalian cells by plasmid DNA. Mol Cell Biol. 7, 2745-2752 (1987).
- Aiken, C., Prasad, V. R., Ganjam, K. V. . Methods in Molecular Biology. 485, 41-53 (2009).
- Kotov, A., Zhou, J., Flicker, P., Aiken, C. Association of Nef with the human immunodeficiency virus type 1 core. J. Virol. 73, 8824-8830 (1999).
- Kewalramani, V. N., Emerman, M. Vpx association with mature core structures of HIV-2. Virology. 218, 159-168 (1996).
- Wehrly, K., Chesebro, B. p24 antigen capture assay for quantification of human immunodeficiency virus using readily available inexpensive reagents. Methods. 12, 288-293 (1997).
- Welker, R., Hohenberg, H., Tessmer, U., Huckhagel, C., Kräusslich, H. G. Biochemical and structural analysis of isolated mature cores of human immunodeficiency virus type 1. J. Virol. 74, 1168-1177 (2000).
- Briggs, J. A., Wilk, T., Welker, R., Kräusslich, H. G., Fuller, S. D. Structural organization of authentic, mature HIV-1 virions and cores. EMBO J. 22, 1707-1715 (2003).
- Auewarakul, P., Wacharapornin, P., Srichatrapimuk, S., Chutipongtanate, S., Puthavathana, P. Uncoating of HIV-1 requires cellular activation. Virology. 337, 93-101 (2005).
- Accola, M. A., Ohagen, A., Göttlinger, H. G. Isolation of human immunodeficiency virus type 1 cores: retention of Vpr in the absence of p6(gag. J. Virol. 74, 6198-6202 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados