Method Article
Métodos locales y globales de evaluación de nocicepción térmica en
* Estos autores han contribuido por igual
En este artículo
Resumen
En este artículo, nos demuestran los ensayos para estudiar la nocicepción térmica en Drosophila Larvas. Un ensayo consiste en la estimulación espacialmente restringido (local) de los nociceptores térmicos 1,2 Mientras que el segundo implica una mayor (mundial) la activación de la mayoría o todas estas neuronas 3. En conjunto, estas técnicas permiten la visualización y cuantificación de las funciones de comportamiento de Drosophila Las neuronas sensoriales nociceptivas.
Resumen
En este artículo, nos demuestran los ensayos para estudiar la nocicepción térmica en larvas de Drosophila. Un ensayo consiste en la estimulación espacialmente restringido (local) de 1,2 nociceptores térmicos, mientras que la segunda implica una mayor (mundial) la activación de la mayoría o todas las neuronas tipo 3. En conjunto, estas técnicas permiten la visualización y cuantificación de las funciones de comportamiento de Drosophila neuronas sensoriales nociceptivas.
La larva de Drosophila es un modelo de sistema establecido para estudiar la nocicepción térmica, una respuesta sensorial a temperaturas potencialmente dañinos que es evolutivamente conservados a través de 1,2 especies. Las ventajas de Drosophila para estos estudios son la relativa simplicidad de su sistema nervioso y la sofisticación de las técnicas genéticas que se pueden utilizar para diseccionar las bases moleculares de la biología subyacente 6.4 En Drosophila, como en todos los metazoos, los response para estímulos nocivos térmicos en general, implica un "nocifensive" retirada de aversión al estímulo presentado 7. Tales estímulos son detectados a través de las terminaciones nerviosas libres o nociceptores y la amplitud de la respuesta organísmica depende del número de nociceptores que reciben el estímulo nocivo 8. En Drosophila, es la clase IV de las neuronas sensoriales arborización dendríticas que detectan los estímulos nocivos térmicos y mecánicos 9, además de su papel recientemente descubierto como fotorreceptores 10. Estas neuronas, las cuales han sido muy bien estudiados en el nivel de desarrollo, se ramifican en la hoja de la barrera epidérmica y hacer contactos con casi todas las células de la epidermis 11,12. El solo axón de cada neurona proyectos de clase IV en el cordón nervioso ventral del sistema nervioso central 11 donde pueden conectarse a las neuronas de segundo orden que se proyectan hacia el cerebro.
En condiciones basales, neuro sensorial nociceptivons no se disparará hasta un umbral relativamente alto que se alcanza. Los ensayos descritos aquí permiten que el investigador cuantificar las respuestas de comportamiento o de referencia, presumiblemente, la sensibilización que sobreviene el daño tisular siguiente. Cada ensayo provoca distintas pero relacionadas las respuestas de comportamiento locomotor de estímulos nocivos térmicos y permite al investigador para visualizar y cuantificar distintos aspectos de la nocicepción térmica en larvas de Drosophila. Los ensayos se pueden aplicar a las larvas de los genotipos deseados o de larvas criadas en diferentes condiciones ambientales que puedan afectar la nocicepción. Dado que la nocicepción térmica se conserva en todas las especies, los resultados recogidos de la disección genética en Drosophila es probable que nuestra comprensión de la nocicepción térmica en otras especies, incluyendo los vertebrados.
Protocolo
Un esquema típico de los pasos experimentales para la preparación de larvas normales o UV-sensibilizada para los dos ensayos nocicepción térmica se muestra en la Figura 1.
1. Preparación de larvas
- Las larvas de la progenie masculina y femenina de un genotipo deseado se puede probar directamente. Por otra parte, un cruce genético se puede configurar para obtener larvas de la progenie de un genotipo de interés definida. Establecer cruces en frascos que contienen los alimentos mosca con 20-30 hembras vírgenes y los hombres de 15-20.
- 5 días después de poner huevos, la cosecha y limpia las larvas de tercer estadio temprano mediante sacando la comida mosca blanda y suavemente el esfuerzo con un chorro de agua a través de un 630 micras (tamaño de poro) de la malla. Transferencia de las primeras larvas de tercer estadio (~ 3-4 mm de longitud a lo largo del eje antero-posterior) a una pequeña almohadilla húmeda de los alimentos para evitar hambrunas y la desecación. Si la sensibilización nociceptiva se va a probar, siga los siguientes pasos de 2,1 2.11. Si las larvas se van a probar en el absence de los daños en los tejidos, vaya directamente al paso 3.1.
2. Eterización y la radiación ultravioleta
- Construir una cámara de eterización.
- Corta el fondo de un tubo de microcentrífuga de 1,5 ml.
- Con una espátula de metal fundido en caliente el borde cortado del tubo de microcentrífuga.
- Coloque una malla fina de la superficie del tubo se derrita y dejar enfriar. La cámara de eterización permitirá la entrada de vapores de éter, sino impedir la fuga de las larvas.
- Use unas pinzas o un pincel para colocar con suavidad 10 larvas del tercer instar temprano dentro de una cámara eterización de fabricación casera.
- Colocar las larvas a lo largo del interior de la tapa y cerrar.
Nota: Los dos siguientes pasos deben realizarse en una campana de extracción como el éter es una sustancia química potencialmente explosivo y sus vapores pueden anestesiar a un ser humano, así como una larva.
- Coloque la cámara eterización con larvas dentro de un vaso de Coplin que contiene un vaso de precipitados de 10 ml que lleva unbola de algodón empapada con ~ 1,5 ml de éter dietílico.
- Tornillo de la tapa del vaso de Coplin para exponer las larvas a los vapores de éter de 2 a 2,5 minutos. Tenga en cuenta que más veces eterización puede afectar negativamente el comportamiento de las larvas o la supervivencia.
- Tras eterización, retire la cámara de eterización del Coplin jar / vaso de precipitados, dando unos segundos en la campana para vapores de éter se disipe. Ahora puede pasar de la campana de vuelta al laboratorio.
- Utilice una botella con atomizador de agua para lavar suavemente las larvas de la cámara de eterización en una pequeña placa de Petri.
- Use unas pinzas y un KIMWIPE para borrar las larvas anestesiado seco y colocar suavemente dorso hacia arriba en una tira de cinta adhesiva de doble cara fijado a una de 3 "x 1" portaobjetos de vidrio.
- Colocar el portaobjetos en la superficie inferior de una cámara de irradiación UV y exponer las larvas a la luz UV durante 6 segundos a 20 mJ / cm 2 intensidad.
- Sumergir el portaobjetos en el agua para flotar suavemente las larvas fuera de la scotc de doble carah cinta.
- Use unas pinzas o un pincel para colocar con cuidado las larvas irradiadas en un 15 x 45 mm de un vial de vidrio que contiene la cultura dram ~ 1,0 ml de alimentos con mosca en el que se puede recuperar durante un periodo variable de tiempo (8 -24 horas) a 25 ° C o otra cultura de la temperatura deseada antes de volver a la cosecha para los ensayos de nocicepción térmica.
3. Calor local de ensayo de la sonda
Entregamos un estímulo térmico nocivo para un segmento del cuerpo individual larvas utilizando una sonda térmica hecha a la medida fabricado por Pro-Dev Ingeniería (véase el cuadro de los materiales). Aunque esta sonda tiene características óptimas de diseño (una punta de metal pequeño de ~ 0,07 mm 2 de área y la capacidad de mantener con precisión una temperatura de punto fijo de 23 ° C a 65 ° C), en principio, cualquier herramienta con una punta pequeña que se puede calentar a una temperatura definida por un período de hasta 20 segundos debería ser suficiente. La punta de la sonda se utiliza para estimular principios de 3 º estadio las larvas precisamente en la parte dorsall línea media en el segmento abdominal A4 (ver Figura 2). En respuesta a este estímulo térmico, larvas generalmente exhiben un comportamiento retirada aversivo de rodadura lateralmente por 360 grados o más. Este comportamiento es distinto de su respuesta al toque de luz para una sonda de metal no tóxicas a temperatura ambiente que generalmente involucra una breve pausa en su actividad locomotriz 13.
Protocolo para el ensayo de sonda de calor:
- Pre-ajuste de la temperatura de la sonda térmica que desear punto de ajuste.
- Utilice un pincel o una pinza para transferir suavemente la larva de un individuo en una plataforma plana (por lo general utilizan una pequeña pieza de corte de vinilo de una carpeta) en el que se estimula a las larvas posteriormente. La larva debe estar cubierto por una fina película de agua antes del contacto con la sonda térmica. La película de agua que cubre la larva debe ser tan pequeño como sea posible y cubrir completamente la larva, garantizando al mismo tiempo que la larva no está seco al tocar el vinilo.
- Presione suavemente la punta de la sonda contra la larva en A4 segmento aplicando una ligera presión con la punta a aproximadamente un ángulo de 45 ° entre la sonda y la superficie de la larva (ver Figura 2). La presión debe provocar una ligera indentación en la superficie de la larva y normalmente será suficiente para impedir la locomoción. Si la larva continúa moviéndose, aplique una presión un poco más y se detendrá por lo general. No registrar los datos de las larvas que se mueven más allá del campo de visión o para los que el contacto de la sonda permanente no se puede lograr hasta que la respuesta o el corte de los 20 s.
- Continuar estimulando la larva hasta que una respuesta de retirada se exhibe o hasta que la corte de 20 segundos que se alcanza, lo que ocurra primero. Respondiendo las larvas normalmente primero muestran un comportamiento preliminar de levantar la cabeza y la cola. Esto es seguido generalmente por el comportamiento de retirada del material por lo menos 360 grados. Sólo un rollo completo de 360 grados es calificado como un comportamiento nocifensive (la HEA preliminard, o aumento de sueldo no es la cola).
- Una vez que el comportamiento de retirada se inició el contacto de liberación con la sonda y registrar la latencia o el tiempo para la retirada. Si no hay retraimiento que se observa dentro de los 20 segundos, y luego la larva es un no respondedor. Los encuestados se pueden dividir en 2 categorías. Si el comportamiento de la retirada se muestra dentro de los 5 segundos, luego la larva es una rápida respuesta. Si el comportamiento retirada se muestra entre 5-20 segundos, a continuación, la larva es un respondedor lento-(véase la figura 1 en Babcock, et al. 2009) 1.
4. Calor Global ensayo de placa
El ensayo de calor de placas fue diseñado para medir la nocicepción térmica en larvas de Drosophila, cuando el animal se enfrenta a un estímulo térmico nocivo. Individual a mediados 3 de las larvas se colocan en una caída de 80 l de agua en un plato de 60 x 15 mm Petri - vea la Figura 3 para el esquema y fotos del set de ensayoarriba. La placa de Petri se coloca entonces sobre un bloque de calentamiento sólido (referido como el "calor de placas"). A medida que la temperatura de los aumentos de gota de agua, la larva presenta una serie de cinco comportamientos estereotipados que hemos denominado movimiento de piernas la cabeza, rollo, látigo, convulsiones y parálisis. Como estos comportamientos son en cierta medida una función de la temperatura de referencia de la placa de calor y el volumen de agua en la que la larva se sumerge se presentan aquí lo que hemos encontrado que las condiciones óptimas (95 ° C de calor de placas, 80 gota l de agua) para observar todas las 5 de los comportamientos con solapamiento mínimo entre ellos.
Protocolo para el ensayo de calor de placas:
- Coloque las guías de luz de fibra óptica para asegurar que haya suficiente iluminación de alto contraste para la visualización de la larva. Utilizar una larva de prueba si es necesario. La potencia de la luz debería estar en baja para evitar el calor ambiental en la larva a ensayar.
- Coloque el bloque de calentamiento en la placa de calor con superficie plana y coloque la placa de calor enla base del microscopio. Girar en la placa de calor a la posición "alta", permiten aproximadamente 15 minutos para que la temperatura se estabilice, y ajustar en consecuencia para alcanzar una temperatura superficial de 95 ° C.
- Medir 80 l de agua destilada y colocar la gota de agua en el medio de la 60 x 15 mm plato de Petri de poliestireno con una micropipeta.
- Utilice pinzas para colocar suavemente una limpia mediados 3 ª larva en el centro de la gota de agua. Prueba para transferir la larva con el volumen mínimo de agua posible de manera que la gota que ser calentado se mantiene lo más cerca posible a la original 80 l.
- Coloque con cuidado la placa de Petri que contiene la gota de agua y larvas de la calefacción en el bloque sólido en el calor de la placa. Rápidamente ajustar la ubicación de la antena por lo que la larva de toda gota de agua y están a la vista. Véase la Figura 3 y de vídeos 1-6.
- Inicie el cronómetro en el momento en la placa de Petri se coloca en el bloque sólido que experimenta calentamiento de la placa de calor y de registroel momento de inicio de cada comportamiento. Si lo desea, los comportamientos también pueden ser de vídeo grabado - Ver Videos 1-5 para ejemplos representativos de cada comportamiento. El software Leica versión 3.7 se utilizó para la grabación de las películas, el modo de grabación fue "continua", cámara de 3 megapíxeles de resolución fue (nosotros usamos 0.63x zoom con el que la resolución de la imagen calculada es de 10 m / pixel) y fotogramas por segundo eran 44,5.
5. Los resultados representativos
Calor local de ensayo de la sonda:
En contacto con la sonda térmica, una larva típicamente muestra un comportamiento preliminar de levantar la cabeza y la cola. Típicamente, el levantamiento de la cabeza se ve en primer lugar seguido por elevación de la cola. Unos segundos después de este comportamiento preliminar de la larva por lo general comienza a rodar lateralmente la que nos referimos como el "retraimiento aversivo". El tiempo tras el cual se muestra el comportamiento preliminar o el retraimiento puede variar según la temperatura o la gede fondo magnético. En nuestro estudio inicial, se midió el porcentaje de larvas de exhibir la retirada de aversión a diferentes temperaturas de punto de ajuste de la sonda y se encontró que 48 ° C fue la temperatura más baja a la que todas las larvas respondió rápida (<5 s). En este caso, nos informan de que hay un límite a la respuesta de la nocicepción térmica larval (Figura 4). 100% de respuesta rápida se observó hasta una temperatura de la sonda de 52 ° C. Sin embargo, a 54 ° C y superior, 90% o más de las larvas no responden incluso después de 20 s de contacto. Estas larvas no seguir avanzando después de los 20 s de corte.
Como se señaló anteriormente 1, las categorías de retraimiento a cada temperatura pueden ser comparados estadísticamente. Teniendo en cuenta que se trata de un ensayo de conducta hay una cierta variabilidad de larva a larva y entre los usuarios individuales. Para tener en cuenta para ello suelen medir 3 series de 30 larvas por las condiciones de ensayo. Además de la simple categorización de wilatencia thdrawal que hemos informado anteriormente, se presenta aquí que la amplitud (número de rollos o tiempo de permanencia en el retraimiento social aversivo) también se puede medir (Ver Figura 4). Sorprendentemente, parece que hay una relación inversa entre la temperatura de entrada y la robustez de la respuesta porque las temperaturas más bajas parecen provocar un mayor número de rodillos (Figura 4B) y más tiempo de permanencia en la retirada aversivo (datos no presentados). Esto puede indicar que la duración de la exposición a una temperatura nocivo puede ser el factor determinante principal de la robustez.
El calor del ensayo de la placa:
Cinco comportamientos locomotores estereotipados se observan en la transferencia de la larva sumergido en agua a la placa de calor. Estos se describen a continuación y se muestra en el vídeo junto con el comportamiento típico de locomoción de una larva no calentado en agua. Las latencias media a la que estos comportamientos se observan se muestra en la Figura 5A, como son las temperaturas medias de agua gota medidos para cada uno de latencia. Bajo las condiciones óptimas de ensayo que aquí se presenta el porcentaje de larvas que presenten cada uno de distinto comportamiento varió desde 77 hasta 100% (Figura 5), aunque en ocasiones las conductas de rodadura y los azotes se omite, se superponen, o se producen en el orden inverso. Los comportamientos observados, en orden cronológico, se describen a continuación y se puede ver en el video en los tiempos indicados a continuación:
- El movimiento normal en ausencia de calor: la locomoción peristáltica acompañado de buscar movimientos de la cabeza. Vea el vídeo de 6:27.
- Thrash de la cabeza: se mueve la cabeza Larva rápidamente en un movimiento hacia adelante o lateral. Este movimiento es similar a su locomoción normal en el agua (ver vídeo 1), pero ocurre con más sacudidas y persistente. Vea el video de 6:40.
- Rollo: Larva rueda lateralmente al menos un total de 360 °. Vea el vídeo de 6:50. Esto puede ocurrirun número variable de veces y, a veces implica rollos incompletos. A los efectos de anotar el comportamiento que sólo cuentan rollos completos de 360 °. Este comportamiento es el más similar a la observada con la aplicación local de la sonda de calor.
- Látigo: Larva exposiciones de liberación rápida contracción de los movimientos a lo largo del eje antero-posterior que llevar la cabeza muy brevemente cerca de la cola. Vea el vídeo de 7:11. Azotar se observa a menudo en una sucesión rápida de o al mismo tiempo como la rodadura.
- Embargo: Larva se extiende a lo largo del eje antero-posterior y presenta una alta frecuencia de todo el cuerpo temblando, sin doblar el comportamiento. Vea el vídeo de 7:25.
- Parálisis: Larva cesa el movimiento. En algunas larvas de esto es permanente, mientras que otros a continuación muestran un movimiento de baja frecuencia de pulsación. Vea el vídeo de 7:36.
Estos datos sugieren que la temperatura de la gota de agua y la latencia de la aparición del char cincorísticas comportamientos observados después del calentamiento global de la caída de larvas / agua están altamente correlacionados.
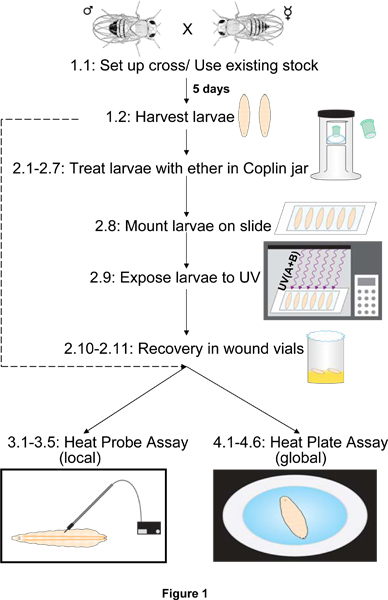
Figura 1. Esquema de pasos experimentales para la preparación y ensayo de las larvas. Antes del ensayo nocicepción con la sonda de calor o la placa de calor, las larvas derivadas de una acción particular o cruz genética se cosechan y se limpia de alimentos. Si la sensibilización nociceptiva (a diferencia de la nocicepción línea de base) se ha de evaluar, la cosecha es seguido por eterización (la exposición al éter), el montaje, la radiación UV, y un período de recuperación en los alimentos con mosca. Larvas cosechadas o recuperado se somete entonces a temperaturas de ensayo nocivos ya sea utilizando la sonda de calor (local) o la placa de calor (global) de ensayo. Los números se refieren a las secciones del texto que describen los métodos de la etapa (s) que se muestra.
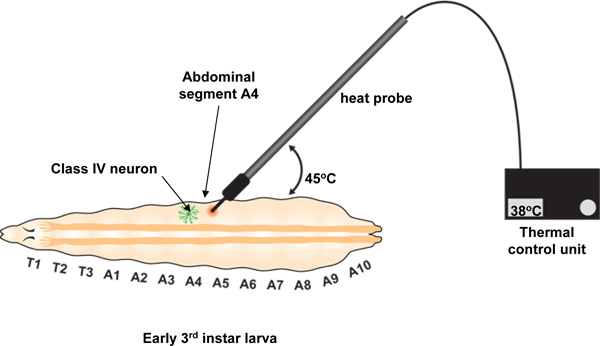
Figure 2. Experimental creado para el análisis local de la sonda de calor. La sonda de calor está controlado por una unidad de control térmico que se utiliza para establecer y mantener la temperatura de la sonda. La sonda se mantiene perpendicular al eje antero-posterior y se utiliza para estimular la larva en un ángulo de 45 ° con la horizontal. Contacto de la sonda se hace específicamente en el segmento abdominal A4 como se muestra. El usuario debe mantener este contacto con una suave presión hasta el punto de corte 20 segundos o hasta que el comportamiento de laminación comienza. Si la temperatura es percibida como nociva, la larva se muestran un comportamiento retirada aversivo caracteriza por al menos un rodillo de 360 °. El número de rollos pueden ser únicas o múltiples (véase la Figura 4B).
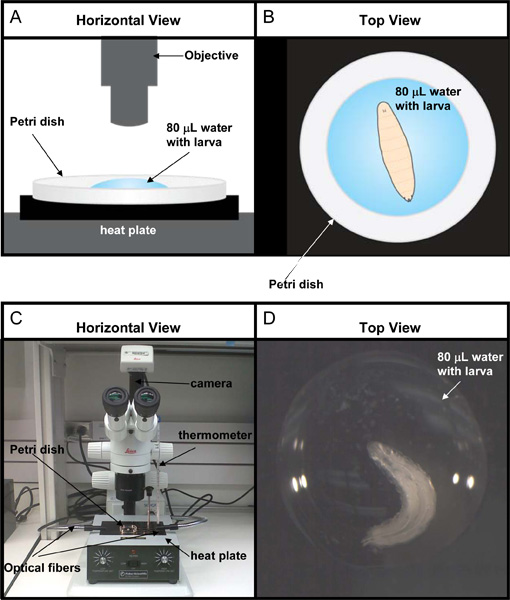
Figura 3. Montaje experimental para el ensayo de calor de placas. (A) de la historieta de una visión horizontal de la placa de 60 x 15 mm de Petri que contiene una media de 3 ªestrella de la larva en una gota de agua l 80. (B) de la historieta de una vista desde arriba de la larva coloca en el centro de la gota de agua según se ve a través del microscopio. (C) Fotografía de una vista horizontal de la estación de trabajo para este ensayo. (D) La fotografía de la larva como se ve a través del microscopio.

Figura 4. La cuantificación de la respuesta de comportamiento usando el ensayo de sonda de calor. (A) gráfico del porcentaje de respondedores que pertenece a cada categoría (rápido, lento, y no respondedores-) frente a la temperatura. (B) Parcela de la latencia de retraimiento aversión frente al número de rollos de cada larva expuesta en cuatro diferentes temperaturas de ensayo de nocividad aumentar a 42 ° C, 44 ° C, 46 ° C, 48 ° C, 50 ° C, y 52 ° C).
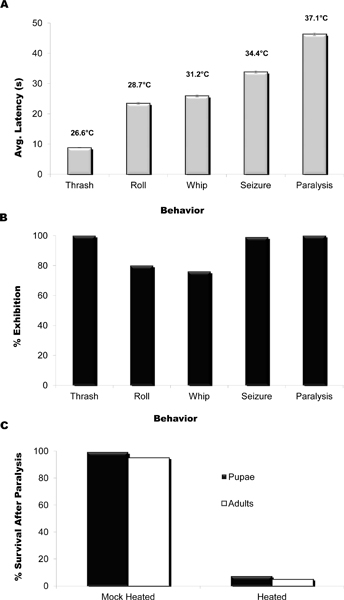
Figura 5. Calor placa de ensayo: la latencia y la temperatura vs BehAvior. (A) La latencia y la temperatura media gota de agua a cada respuesta de comportamiento en las condiciones óptimas de 95 ° C (temperatura de superficie de la placa caliente) y 80 l gota de agua (n = 150). Nótese que cada comportamiento se observa dentro de un intervalo de tiempo en particular. La temperatura del agua caída se midieron utilizando un termopar insertado en la parte superior o inferior de la gota (n = 10 gotas para cada lugar) y las mediciones de estos fueron en promedio. (B) por ciento de las larvas de exhibir cada respuesta de comportamiento bajo condiciones de ensayo óptimas. Thrashing, agarrando y parálisis se observó casi el 100% del tiempo mientras gira y se observan para batir 77 y 80% del tiempo, respectivamente. A la temperatura de la superficie inferior conjunto de puntos de convulsiones y parálisis, no se observan dentro de los 200 s, y en los puntos más altos para rodar y los azotes puede pasarse por alto o puede ocurrir de forma simultánea. n = 150. (C) El porcentaje de larvas que sobreviven tras el inicio del comportamiento de la parálisis. Las larvas se calentó hasta serla parálisis de desmotado y luego se retira a las condiciones estándar de cultivo para recuperarse. Maqueta tratada larvas recibió un trato equivalente a excepción de la exposición al calor. La formación de adultos y viable pupas se cuantificaron en los días 7-13. n = 120.
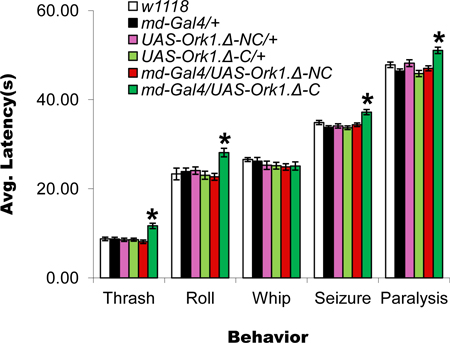
Figura 6. La inactivación de las larvas neuronas sensoriales nociceptivas aumenta latencias de comportamiento de respuesta. Parcela de la latencia de cada comportamiento de los genotipos indicados: w 1118, Gal4 109 (2) 80 = MD-Gal4 / +, UAS-Ork1.Δ-C / +, UAS-Ork1.Δ-NC / +, md- Gal4/UAS-Ork1.Δ-C, y md-Gal4/UAS-Ork1.Δ-NC. MD-Gal4 expresión de las unidades de UAS-regulados transgenes en todas las cuatro clases de neuronas sensoriales periféricas multidendritic; UAS-Ork1.Δ-C 14 expresa una versión modificada de la Drosophila abierto rectificador de canal de K + necesario para la transmisión sináptica, y U AS-Ork1.Δ-NC 14 expresa una nueva versión modificada de este mismo canal que no interfiere con la transmisión sináptica. Tenga en cuenta que las larvas sólo se lleva tanto el controlador md-Gal4 6 y los transgenes UAS-Ork1.Δ-C muestran incremento de latencias para cuatro de las cinco conductas observadas (thrash, rollo, convulsiones y parálisis). Tenga en cuenta también que, debido al aumento de la latencia para la introducción de estos animales el látigo antes de lanzar. Asterisco indica p <0,05 por la t de Student prueba. n = 30 larvas por genotipo.
Vídeo de consulta 1. Haga clic aquí para ver el video .
Vídeo de consulta 2. Haga clic aquí para ver el video .
Suplementario de vídeo 3."Target =" _blank "> Haga clic aquí para ver el video.
Vídeo de consulta 4. Haga clic aquí para ver el video .
Vídeo de consulta 5. Haga clic aquí para ver el video .
Vídeo suplementario 6. Haz clic aquí para ver el video .
Discusión
Los ensayos descritos aquí se pueden utilizar para evaluar cualitativa y cuantitativamente las larvas de los diferentes genotipos de respuesta a los estímulos nocivos térmicos. Una característica principal de la sonda de ensayo de calor es que el estímulo se da sólo en un solo locus. Se supone que esto da lugar a tiro de sólo un pequeño subconjunto de la clase IV de las neuronas en el segmento de contacto de la sonda y tal vez los de los segmentos adyacentes de inmediato 11. Debido a la estimulación local, el ensayo de la sonda de calor imita la experiencia común sensorial de la detección de un estímulo nocivo que se localiza en un cuerpo en particular la región, como una mano en contacto con una estufa caliente. Una desventaja del ensayo de sonda de calor es que tiene alguna variabilidad de usuario a usuario que probablemente se puede atribuir a tres factores: i) la presión con la que el usuario aplica la sonda a la larva, ii) la ubicación exacta de la sonda en la larva relativa a las neuronas subyacentes nociceptivos, y iii) la precisa angLe en el que la sonda contacto con la superficie de la larva.
Hemos informado anteriormente de una estrategia cuantitativa de las larvas de la categorización en los no respondedores, los respondedores lentos, y personal de respuesta rápida en base a su latencia de retirada a una temperatura determinada 1. Aquí nos informe sobre la capacidad de respuesta de larvas a temperaturas aún más altas. Curiosamente, nos encontramos con que hay un techo para las larvas las respuestas nociceptivas térmicas y que este límite máximo se encuentra entre 52 y 54 ° C. Esto puede indicar que las larvas no poseen un potencial de receptor transitorio (TRP) de canal capaz de compuerta a temperaturas superiores a 52 º C. Alternativamente, se podría sugerir que las neuronas o los músculos utilizados para iniciar o llevar a cabo la respuesta del motor se daña antes de que puedan funcionar en la retirada aversivo. También presenta un análisis diferente de la amplitud de la retirada de respuesta usando ya sea el número de rollos como un indicador de la "robustez" de la respuesta. Ingenuamente, unoCabría esperar que estos parámetros se incrementaría con el aumento de temperatura o tiempo de estimulación. Sorprendentemente, se encuentra que este no es el caso. Las larvas se estimularon durante un tiempo más largo a una temperatura en el extremo inferior del rango nocivo (42 ° C) muestran más rollos y más tiempo dedicado rodadura que las larvas probaron a altas temperaturas (48-52 ° C). Esto sugiere que, dentro de la ventana de temperatura nociva es principalmente la duración de la exposición que determina la amplitud de la respuesta. Dado que las larvas se exponen a temperaturas altamente nocivas (48-52 ° C) responden en promedio muy rápidamente, no exhiben como muchos rollos como larvas expuestas a una temperatura de menos nocivo para una longitud de tiempo más largo. El análisis de la amplitud de la respuesta que aquí añade una nueva dimensión cuantitativa a lo largo de la cual los diferentes genotipos o manipulaciones ambientales se pueden comparar.
Una característica principal de la placa de ensayo de calor es que implica una exposición global a la nocivacalor. Como tal, es más parecido al animal sentado en un caldero de calefacción que tocar una estufa caliente. Aunque no está claro cuando una larva puede experimentar un estímulo nocivo a nivel mundial en la naturaleza, en el laboratorio de las respuestas de comportamiento a esta exposición mundial son más complejas que las observadas después de la estimulación local. Una fuerza de la placa de ensayo de calor, también señalado por otros 3, es que tiene poco de usuario a usuario variabilidad desde tocar la larva no es un componente del protocolo. La única variación importante parece estar en la definición de cuándo comienza cada comportamiento, y esto puede ser minimizado con visión repetida / familiaridad. Una diferencia interesante entre los ensayos son las temperaturas a las que las conductas aversivas comenzar. Estos son mucho más baja en el ensayo de calor de placas que con la sonda de calor. El comportamiento exhibido por las larvas preliminar en contacto con la sonda de calor (cabeza y cola de subida) puede ser un correlato de la cabeza del movimiento de piernas observa en ~ 27 ° C en la plataforma de calore ensayo. Es posible que esta respuesta refleja el "malestar" más que "el dolor". No hemos observado una correlación de los azotes, la confiscación, y la parálisis, incluso a alta (hasta 48 ° C) las temperaturas en el ensayo de la sonda de calor y puede ser que una masa crítica de las neuronas sensoriales disparando desde más de una región del cuerpo es necesaria para que en esos comportamientos. Interesantemente, los comportamientos convulsivos y parálisis se observan a temperaturas (~ 34 a 37 ° C) por debajo del extremo inferior del umbral nociceptivo observado con la sonda de calor que indica que la estimulación global puede implicar suma de las respuestas neuronales que son insuficientes para provocar un comportamiento con locales aplicación de la sonda de calor. Que estas temperaturas son en realidad percibida como nociva para las larvas se apoya en la observación de que las larvas que comienzan el comportamiento parálisis y posteriormente se dejaron recuperar en alimentos mosca no en la mayoría de los casos sobrevivir (Figura 5C). Más apoyo a la tesis de que el calor de la plensayo comió está leyendo las respuestas nociceptivas es el hecho de que el bloqueo de la transmisión sináptica en las neuronas sensoriales nociceptivas conocidos aumenta la latencia de la mayoría de los comportamientos observados (Figura 6). La observación de que no hay aumento en la latencia para el comportamiento de mayor temperatura para batir sugiere que otros neuronas sensoriales que no expresan MD-Gal4 puede ser requerido para este comportamiento.
En suma, los dos ensayos implican la exposición de una larva de individuo a un estímulo nocivo térmica de la temperatura se define - la punta caliente de una pequeña sonda de metal en el ensayo local y la inmersión en una gota de agua rápidamente el calentamiento en el ensayo mundial. Las respuestas de comportamiento de las larvas de Drosophila de diferentes orígenes genéticos y / o expuestos a diferentes condiciones ambientales (por ejemplo, más o menos daño a los tejidos), se puede estudiar y cuantificar el uso de estos ensayos. En última instancia, los resultados de estos ensayos nos ayudará a comprender mejor las redes genéticas que controlan nociception en Drosophila y otras especies relacionadas.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Damos las gracias a Christian Landry para el calor diseño de la sonda, Daniel Babcock para el desarrollo de la prueba de fuego de la sonda de larvas, Sean Sweeney, por sugerir el ensayo de calor de placas, el Bloomington Drosophila Stock Center para las poblaciones de mosca, y los miembros Galko de laboratorio para la lectura crítica del manuscrito. Este trabajo fue apoyado por el NIH R01 NS069828 de MJG y un NIH MARC U-STAR Training Grant (T34GM079088 a la Universidad de Houston-Downtown Los eruditos de la Academia) para acceso de las minorías a las carreras de investigación (AVG).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Sonda térmica | Pro-Dev Ingeniería | Custom-construido sobre la demanda | La información de contacto puede ser proporcionada en la solicitud de |
| Baño seco Incubadora | Fisher Scientific | 11-718 | Un bloque de calentamiento sólido y un bloque de calentamiento con los pozos de 16 mm |
| Leica DFC290 12v/400mA Cámara en color | Leica Microsystems | 12730080 | Cualquier equivalente cámara hará. |
| Leica MZ6 microscopio | Leica Microsystems | El número de parte para el cuerpo de zoom MZ6 (portadora óptica) es 10445614 | |
| Schott Ace Modulamp Unidad | Schott North America, Inc. | A20500 | |
| Schott doble cuello de cisne de 23 pulgadas de fibra óptica de guía de luz | Schott North America, Inc. | Schott A08575 | |
| Unidad de control térmico | TSCI corp. | Custom Built | Los detalles pueden ser disponibles bajo petición |
| Zeiss Stemi 2000 microscopio | Zeiss | NT55-605 | Cualquier equivalente microscopiova a hacer. |
| Fórceps | FST | FS-1670 | |
| Malla de 1 mm | Genesee Científico | 57-101 | |
| Pincel | Dick Blick Art Materials | 06762-1002 | |
| Reticulante UV | Fisher Scientific | 1199289 | |
| Recipientes | Fisher Scientific | 08-816 | |
| Vaso de precipitados de 10 ml | Fisher Scientific | 02-540C | |
| Éter dietílico | Fisher Scientific | E138-500 | |
| 35 x 10 mm de poliestireno Petri | Halcón | 351008 | No hemos probado platos alternativos. |
| Portaobjetos del microscopio | Corning | 26003 | |
| Termopar | Omega Engineering, Inc. | HH802U | |
| Pedazo de vinilo | Office Depot | 480009 | |
| Microcentrífuga tubo | Denville CientíficoInc. | C-2170 |
Referencias
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Curr. Biol. 19, 799-806 (2009).
- Tracey, W. D., Wilson, R. I., Laurent, G., Benzer, S. painless, a Drosophila gene essential for nociception. Cell. 113, 261-273 (2003).
- Oswald, M., Rymarczyk, B., Chatters, A., Sweeney, S. A novel thermosensitive escape behavior in Drosophila larvae. Fly (Austin). 5, 17810 (2011).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Moore, A. W., Jan, L. Y., Jan, Y. N. hamlet, a binary genetic switch between single- and multiple- dendrite neuron morphology. Science. 297, 1355-1358 (2002).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Walters, E. T., Illich, P. A., Weeks, J. C., Lewin, M. R. Defensive responses of larval Manduca sexta and their sensitization by noxious stimuli in the laboratory and field. J. Exp. Biol. 204, 457-469 (2001).
- Woolf, C. J., Ma, Q. Nociceptors--noxious stimulus detectors. Neuron. 55, 353-364 (2007).
- Hwang, R. Y. Nociceptive neurons protect Drosophila larvae from parasitoid wasps. Curr. Biol. 17, 2105-2116 (2007).
- Xiang, Y. Light-avoidance-mediating photoreceptors tile the Drosophila larval body wall. Nature. 468, 921-926 (2010).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Sweeney, N. T., Li, W., Gao, F. B. Genetic manipulation of single neurons in vivo reveals specific roles of flamingo in neuronal morphogenesis. Dev. Biol. 247, 76-88 (2002).
- Kernan, M., Cowan, D., Zuker, C. Genetic dissection of mechanosensory transduction: mechanoreception-defective mutations of Drosophila. Neuron. 12, 1195-1206 (1994).
- Nitabach, M. N., Blau, J., Holmes, T. C. Electrical silencing of Drosophila pacemaker neurons stops the free-running circadian clock. Cell. 109, 485-495 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados