Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Los ensayos clínicos y de eliminación de la médula espinal en un modelo murino de esclerosis lateral amiotrófica (ELA)
En este artículo
Resumen
Un modelo de ratón para la esclerosis lateral amiotrófica (ELA) es un examen clínico y de comportamiento. Como un requisito previo para un análisis inmunohistoquímico acompaña la preparación de la médula espinal se representa en detalle.
Resumen
La esclerosis lateral amiotrófica (ELA) es un trastorno neurodegenerativo fatal que resulta en la degeneración progresiva de neuronas motoras. Pico de aparición es de alrededor de 60 años de la enfermedad esporádica y alrededor de 50 años para la enfermedad familiar. Debido a su curso progresivo, el 50% de los pacientes mueren dentro de los 30 meses del inicio de los síntomas. Con el fin de evaluar nuevas opciones de tratamiento para esta enfermedad, los modelos genéticos de ratón de la ALS se han generado sobre la base de las mutaciones humanas familiares en el gen SOD, tales como la SOD1 (G93A) mutación. Aspectos más importantes que tienen que ser evaluadas en el modelo son la supervivencia global, la evolución clínica y la función motora. En este caso, se demuestra la evaluación clínica, muestran la realización de dos pruebas de motor de comportamiento y proporcionar sistemas cuantitativos de calificación para todos los parámetros. Debido a un análisis en profundidad del modelo de ratón de ALS por lo general requiere un examen inmunohistoquímico de la médula espinal, que demuestran su preparación en detalle la aplicación de la vermétodo de laminectomía rsal. Los ejemplos de los hallazgos histológicos se ha demostrado. La aplicación completa de los métodos de examen que aparecen en los estudios sobre el modelo de ratón de la ELA permitirá a los investigadores para probar de forma fiable las futuras opciones terapéuticas que pueden servir de base para los ensayos clínicos más humanos.
Protocolo
Los animales fueron adquiridos de Jackson Laboratory (# 002726) 1. Se anotó clínicamente y se sometió a una prueba de función motora (rotarod prueba) y de la fuerza muscular (colgando prueba de hilo). Todas estas pruebas y el asesinato posterior de los animales a fin de preparar la médula espinal se han realizado de acuerdo muy cerca de las directrices locales para la correcta realización de los experimentos con animales.
1. Puntuación clínica
Aparte de la evaluación para los ratones de peso corporal se examinan en busca de signos de déficit motor con el siguiente sistema de puntuación de 4, punto 2:
4 puntos: normal (sin signos de disfunción motora)
3 puntos: los temblores de las extremidades traseras son evidentes cuando se suspendió por la cola
2 puntos: alteraciones de la marcha están presentes
1 punto: arrastrando de por lo menos una extremidad posterior
0 puntos: simétricaparálisis, incapacidad para derecho propio o pérdida de 20% del peso corporal máximo, en este caso los animales son sacrificados inmediatamente y el experimento se termina
2. Las pruebas de la función motora y la fuerza muscular
Suspensión de la cuerda
Esta prueba se utiliza para evaluar la fuerza muscular 3, 4. Todos los animales de realizar esta prueba por lo menos uno o dos días después de la prueba rotarod. Cada ratón se sitúa sobre una tapa de alambre a la medida, con intervalos de 0,8 cm y con cautela al revés, 60 cm por encima de una cubierta de paja inferior. Después de entrenar durante tres veces consecutivas de al menos 180 s la latencia se mide a caer. Cada ratón se da hasta tres intentos de aferrarse a la tapa invertida por un máximo de 180 s, y el período más largo se registra.
Rotarod prueba
El aparato rotarod (Ugo Basile, Comerio, Italia) se utilizó para medir la coordinación motora, el equilibrio y la capacidad de aprendizaje motor de 3, 4. Un buen desempeño requiere de un alto grado de coordinación sensoriomotora. La máquina debe ser colocado en un ambiente tranquilo y no molesto a evitar los estímulos de distracción para el animal a prueba. Se compone de un equipo controlado accionado por motor del husillo giratorio y cinco carriles durante cinco ratones. Caídas de los ratones se detectan automáticamente por la presión sobre una placa de plástico en la parte inferior. Después de la formación de tres veces consecutivas de al menos 180 s a una velocidad constante de 15 rpm, el tiempo para que un animal puede permanecer en la varilla giratoria se mide. Cada animal se somete a tres pruebas y el más largo de latencia, sin caer se registra. El tiempo de 180 s es elegido como corte de tiempo porque la mayoría de las diferencias significativas en la coordinación motora se detectan en este período de tiempo.
3. Preparación de la médula espinal
- Los animales se mataron por insuflación de CO 2 de acuerdo con las directrices locales y son inmediatamente perfundidos transcardialmente con solución de PBS seguido por una solución de paraformaldehído al 4%.
- A fin de preparar la médula espinal del ratón sacrificado, el animal se coloca sobre una mesa de operaciones y los cuatro miembros están fijos en el lado con el fin de exponer el lado posterior del ratón.
- Un corto de lavado con una solución de etanol al 70% limpia el sitio de la disección y se aplana la capa de pelo.
- A continuación, la piel se realiza una incisión con un bisturí afilado en la línea media. Con el fin de facilitar el corte de la piel se estira a ambos lados. Si los músculos de las piernas se prepararán, su piel también ha de realizarse una incisión.
- Después de la incisión de la piel se ha completado, se llevó a un lado con un par de pinzas para exponer la fascia subyacente superficial del cuerpo.
- La musculatura del cuello y el ligamento nucal tiene que ser eliminado y son carefully preparado. Tenga cuidado de no incidir en profundidad y la lesión de la médula espinal. Los músculos de los hombros también se puede quitar con el fin de exponer mejor la columna vertebral.
- Entonces los músculos paravertebrales se eliminan de toda la columna vertebral.
- Con el fin de abrir los laminectomías columna vertebral varios tienen que ser realizadas. Uno debe comenzar desde la parte superior de cráneo en el sitio de la articulación atlanto-occipital.
- Es más fácil para eliminar la fijación de la parte superior de dos miembros y estirar el cuello para estar en mejores condiciones para realizar la laminectomía de la primera vértebra. Estos se alejó, sin tocar la médula espinal cervical expuesta.
- Más vértebras se separan por primera transecting los arcos vertebrales en ambos lados con unas tijeras en ángulo y luego tirando de los procesos dorsales. El resto de las partes laterales de las vértebras debe ser eliminado para facilitar el posterior eliminación completa de la médula espinal.
- Un punto de referencia anatómica de la espina lumbarcable l es la intumescencia que también está presente en la médula espinal cervical.
- Una vez terminada la laminectomía de la médula espinal completa, asegúrese de que usted también seccionar todas las raíces ventrales y liberar la médula espinal de la duramadre de las meninges.
- A continuación, la médula espinal cervical se corta cranealmente y empezar a eliminar la médula espinal.
- Finalmente la médula espinal también se corta en la parte distal cauda equina, para ser completamente liberado.
- En última instancia, la médula espinal se coloca en una solución postfixating (por ejemplo paraformaldehído al 4%) durante la noche y se puede procesar más. Por lo general, criosección la médula espinal para prepararlo para el análisis inmunohistoquímico.
4. Los resultados representativos
La técnica de preparación de la médula espinal representa el foco de este artículo de vídeo. Es un requisito previo esencial para la sección de tejido más tarde y en última instancia, para el análisis inmunohistoquímico de la espinal secciones de la médula. Como un ejemplo de un resultado final, un estudio diagnóstico inmunohistoquímico de la región asta anterior de la médula espinal lumbar ratón de un tipo salvaje (wt) y de un SOD G93A transgén (TG) ratón se demuestra. Las neuronas motoras pueden ser identificados con un anticuerpo primario anti-CHAT anticuerpos y su posterior marcado fluorescente con una secundaria Cy3 anticuerpo. Además, un contador nuclear-mancha con DAPI (4,6-diamino-2-fenilindol) se ha realizado (Figura 1).
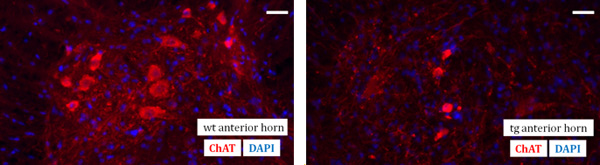
Figura 1. Fotomicrografías fluorescentes visualizar la inmunodetección de las motoneuronas con anti-CHAT anticuerpos (rojo) y núcleos celulares contra-tinción con DAPI (azul) en el ratón de la médula espinal lumbar de cuerno anterior de un tipo salvaje (wt) (a la izquierda) y de un SOD G93A transgénico (TG) (a la derecha) del ratón a la edad de 130 días. Barra de escala: 40 m.
A medida que el análisis inmunohistoquímico delos ratones SOD G93A no es el ámbito principal de este artículo, consulte la publicación original en el que estos ratones transgénicos han sido caracterizados y otras más recientes que estudian los enfoques terapéuticos para la referencia adicional de 1, 5, 6. Si los efectos terapéuticos se diferencian en el nivel inmunohistoquímico claramente definido algoritmos cuantitativos de evaluación debe ser aplicado con el apoyo de un software estereológicos (por ejemplo, ver 7).
Discusión
La SOD1 (G93A) modelo de ratón genético es un modelo animal útil para estudiar el curso de la enfermedad de la pérdida de las motoneuronas progresiva comparable a la humana esclerosis lateral amiotrófica 8. Una variedad de diferentes modelos de tratamientos se han evaluado en este modelo y representan una base para después probar en humanos 8-10 estudios clínicos. Con el fin de ser capaz de detectar diferencias significativas en un estudio de tratamiento experimental en estos ratones, es de ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
LT ha recibido apoyo económico del Forschungsförderungsprogramm de la Medicina de la Universidad de Gotinga. PL y MB fueron apoyados por el Centro de Investigación DFG para la Fisiología Molecular del Cerebro (CMPB), Göttingen. Los autores agradecen al Dr. Lars Tatenhorst para obtener ayuda con la videografía y Liebau Birgit ayuda para edición de audio y vídeo.
Materiales
| Name | Company | Catalog Number | Comments |
| Fabricante | Información para hacer pedidos | ||
| Las pruebas de comportamiento | |||
| Rota-Rod de los ratones | Ugo Basile, Comerio, Italia | # 47600 | |
| Colgar el dispositivo de alambre | Hechas a medida | ||
| Preparación de la médula espinal | |||
| Operación de la tabla Funcionamiento de la lámpara Guantes de protección | |||
| "Iris" Tijeras, en ángulo a otro | Herramientas de Bellas Ciencia, Heidelberg, Alemania | 14063-09 | |
| Cohan-Vannas Tijeras rectas de primavera, | Herramientas de Bellas Ciencia, Heidelberg, Alemania | 15000-10 | |
| Micro pinzas | Hammacher, Solingen, Alemania | HWC 111-10 | |
| Bisturí "präzisa más" | Dahlhausen, Colonia, Alemania | 11.000.00.510, la figura 10 | |
Referencias
- Gurney, M. E. Motor neuron degeneration in mice that express a human Cu, Zn superoxide dismutase mutation. Science. 264 (5166), 1772-1775 (1994).
- Weydt, P. Assessing disease onset and progression in the SOD1 mouse model of ALS. Neuroreport. 14 (7), 1051-1054 (2003).
- Crawley, J. N. Behavioral phenotyping strategies for mutant mice. Neuron. 57 (6), 809-818 (2008).
- Miana-Mena, F. J. Optimal methods to characterize the G93A mouse model of ALS. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 6 (1), 55-62 (2005).
- Zhong, Z. Activated protein C therapy slows ALS-like disease in mice by transcriptionally inhibiting SOD1 in motor neurons and microglia cells. J. Clin. Invest. 119 (11), 3437-3449 (2009).
- Pitzer, C. Granulocyte-colony stimulating factor improves outcome in a mouse model of amyotrophic lateral sclerosis. Brain. 131 (Pt. 12), 3335-3347 (2008).
- Gowing, G. Ablation of proliferating microglia does not affect motor neuron degeneration in amyotrophic lateral sclerosis caused by mutant superoxide dismutase. J. Neurosci. 28 (41), 10234-10244 (2008).
- Scott, S. interpretation of studies in the standard murine model of ALS. Amyotroph Lateral Scler. 9 (1), 4-15 (2008).
- Turner, B. J., Talbot, K. Transgenics, toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol. 85 (1), 94-134 (2008).
- Corse, A. M. Preclinical testing of neuroprotective neurotrophic factors in a model of chronic motor neuron degeneration. Neurobiol Dis. 6 (5), 335-346 (1999).
- Knippenberg, S. Significance of behavioural tests in a transgenic mouse model of amyotrophic lateral sclerosis (ALS). Behav Brain Res. 213 (1), 82-87 (2010).
- Burgess, R. W., Cox, G. A., Seburn, K. L. Neuromuscular disease models and analysis. Methods Mol. Biol. 602, 347-393 (2010).
- Hayworth, C. R., Gonzalez-Lima, F. Pre-symptomatic detection of chronic motor deficits and genotype prediction in congenic B6.SOD1(G93A) ALS mouse model. Neuroscience. 164 (3), 975-985 (2009).
- Ludolph, A. C. Guidelines for preclinical animal research in ALS/MND: A consensus meeting. Amyotroph Lateral Scler. 11 (1-2), 38-45 (2010).
- Boillee, S. Onset and progression in inherited ALS determined by motor neurons and microglia. Science. 5778 (3), 1389-1392 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados