Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mapeo de las secuelas de la theta ráfaga de estimulación sobre la corteza auditiva humana con imágenes funcionales
En este artículo
Resumen
El procesamiento auditivo es la base de la expresión y el procesamiento relacionado con la música. Estimulación Magnética Transcraneal (TMS) se ha utilizado con éxito para estudiar los sistemas cognitivos, sensoriales y motoras, pero rara vez se ha aplicado a la audición. Aquí investigamos TMS combinado con resonancia magnética funcional para comprender la organización funcional de la corteza auditiva.
Resumen
Auditory cortex pertains to the processing of sound, which is at the basis of speech or music-related processing1. However, despite considerable recent progress, the functional properties and lateralization of the human auditory cortex are far from being fully understood. Transcranial Magnetic Stimulation (TMS) is a non-invasive technique that can transiently or lastingly modulate cortical excitability via the application of localized magnetic field pulses, and represents a unique method of exploring plasticity and connectivity. It has only recently begun to be applied to understand auditory cortical function 2.
An important issue in using TMS is that the physiological consequences of the stimulation are difficult to establish. Although many TMS studies make the implicit assumption that the area targeted by the coil is the area affected, this need not be the case, particularly for complex cognitive functions which depend on interactions across many brain regions 3. One solution to this problem is to combine TMS with functional Magnetic resonance imaging (fMRI). The idea here is that fMRI will provide an index of changes in brain activity associated with TMS. Thus, fMRI would give an independent means of assessing which areas are affected by TMS and how they are modulated 4. In addition, fMRI allows the assessment of functional connectivity, which represents a measure of the temporal coupling between distant regions. It can thus be useful not only to measure the net activity modulation induced by TMS in given locations, but also the degree to which the network properties are affected by TMS, via any observed changes in functional connectivity.
Different approaches exist to combine TMS and functional imaging according to the temporal order of the methods. Functional MRI can be applied before, during, after, or both before and after TMS. Recently, some studies interleaved TMS and fMRI in order to provide online mapping of the functional changes induced by TMS 5-7. However, this online combination has many technical problems, including the static artifacts resulting from the presence of the TMS coil in the scanner room, or the effects of TMS pulses on the process of MR image formation. But more importantly, the loud acoustic noise induced by TMS (increased compared with standard use because of the resonance of the scanner bore) and the increased TMS coil vibrations (caused by the strong mechanical forces due to the static magnetic field of the MR scanner) constitute a crucial problem when studying auditory processing.
This is one reason why fMRI was carried out before and after TMS in the present study. Similar approaches have been used to target the motor cortex 8,9, premotor cortex 10, primary somatosensory cortex 11,12 and language-related areas 13, but so far no combined TMS-fMRI study has investigated the auditory cortex. The purpose of this article is to provide details concerning the protocol and considerations necessary to successfully combine these two neuroscientific tools to investigate auditory processing.
Previously we showed that repetitive TMS (rTMS) at high and low frequencies (resp. 10 Hz and 1 Hz) applied over the auditory cortex modulated response time (RT) in a melody discrimination task 2. We also showed that RT modulation was correlated with functional connectivity in the auditory network assessed using fMRI: the higher the functional connectivity between left and right auditory cortices during task performance, the higher the facilitatory effect (i.e. decreased RT) observed with rTMS. However those findings were mainly correlational, as fMRI was performed before rTMS. Here, fMRI was carried out before and immediately after TMS to provide direct measures of the functional organization of the auditory cortex, and more specifically of the plastic reorganization of the auditory neural network occurring after the neural intervention provided by TMS.
Combined fMRI and TMS applied over the auditory cortex should enable a better understanding of brain mechanisms of auditory processing, providing physiological information about functional effects of TMS. This knowledge could be useful for many cognitive neuroscience applications, as well as for optimizing therapeutic applications of TMS, particularly in auditory-related disorders.
Protocolo
El protocolo se divide en un período de dos días (no necesariamente consecutivos). El día primero consiste en un localizador fMRI compuesto con un anatómicas y funcionales a exploraciones por RM para definir para cada participante las áreas objetivo con TMS. El segundo día consiste en las sesiones de resonancia magnética funcional pre-y post-TMS TMS donde se aplica en el interior del escáner con una bobina especial MR TMS compatible (Magstim Ltd., País de Gales, Reino Unido) y un sistema de estereotaxia sin marco (Brainsight). Este último se utiliza para la posición en tiempo real de la bobina de EMT en áreas corticales relativos a los datos anatómicos y funcionales de cada participante.
1. Localizador Sesión
- Comience con la adquisición de una imagen anatómica de alta resolución de la participante.
- Entonces, adquirir imágenes funcionales utilizando un gradiente de eco EPI pulso y un paradigma de muestreo escaso en el fin de minimizar cualquier efecto de negrita o enmascaramiento auditivo debido al ruido de escaneo MRI 14,15. En nuestro caso, se lleva a cabo fMRI durante una tarea melodía en la que los participantes tienen que determinar si dos consecutivos Nota 5-melodías son iguales o diferentes 2,16. A la no discriminación auditiva tarea de control también se incluye, en el que los sujetos escuchar dos de igual longitud patrones de cinco notas, todos a la misma altura de C5 y pide que pulse el botón izquierdo tras el segundo estímulo. Los períodos de silencio también se insertan aleatoriamente entre los ensayos de tarea en cada carrera. En total, 72 ensayos se presentan en un orden aleatorio: 24 ensayos de discriminación melodía, 24 ensayos de control auditivo y 24 periodos de silencio, con una duración total de 12 min 16 seg.
- Definir el lugar de estimulación mediante anatómicas y / o funcionales de puntos de referencia. Uno tiene que ser consciente de que TMS está limitado en cuanto a la profundidad de la zona de estimulación debido a la atenuación de la intensidad de campo eléctrico en profundidad, y no se puede esperar a llegar a las zonas más profundas de 3 cm 6,17. Un paso fundamental es el uso de marcas similares para cada parteicipant, que podría ser difícil debido a las diferencias en la anatomía y función entre los participantes. Aquí, nos dirigimos circunvolución Heschl en cada participante, que se encuentra usando ambos puntos de referencia anatómicos y funcionales. Nosotros usamos máscaras de giro Heschl proporcionada por los atlas Harvard-Oxford estructurales ( http://www.fmrib.ox.ac.uk/fsl/data/atlas-descriptions.html ) y el objetivo de TMS se define individualmente por el pico de activación en la circunvolución del Heschl 2. Además, también definen la posición de vértice, que se utiliza como punto de control para controlar para efectos no específicos de TMS como artefactos acústicos y somatosensorial. El vértice se define anatómicamente como un punto a medio camino entre el inión y el puente de la nariz, y equidistante de las muescas intertragal derecho e izquierdo. El orden del lugar de estimulación (es decir giro Heschl o vértice) se compensa a través deindividuos.
2. Pre-y Post-TMS-fMRI experimento
Pre-TMS fMRI sesión
- Preparar al participante para ir directamente en el escáner. Esto incluye la remoción de metal y llenar el formulario de TMS y MR de selección.
- Inicie la adquisición de RM con una anatomía y una exploraciones funcionales (idéntica a la realizada en la sesión del localizador, véase la sección 1).
Estereotaxia sin marco y TMS en el entorno MRI
El sistema de estereotaxia sin marco se compone de una cámara de infrarrojos (Polaris Spectra), algunas herramientas y rastreadores (Brainsight) empleados para el procedimiento de registro y un ordenador. El ordenador se encuentra fuera de la sala del escáner, pero situada en la entrada de la sala del escáner y la puerta del escáner se mantiene abierto durante la aplicación de TMS. Las herramientas y los rastreadores son MR compatible, así como el trípode (hecho en casa) que soporta la cámara de infrarrojos y son therefore utilizado dentro de la sala del escáner. La cámara de infrarrojos no es compatible con MR, y por lo tanto se coloca dentro de la sala del escáner, cerca de la puerta del escáner en aproximadamente dos metros de la superficie del escáner (véase la discusión de procedimiento de seguridad). El sistema TMS estimulador se encuentra en una habitación contigua a la sala del escáner de resonancia magnética. Usamos una bobina de MRI TMS compatible ubicado dentro de la sala del escáner y conectado al sistema de TMS a través de un cable de 7 m por medio de un tubo de filtro de RF.
- Cargar imágenes anatómicas y funcionales de su participante y los objetivos de estimulación en el paquete de software estereotáctica (Brainsight por ejemplo). Aquí, vamos a tener como objetivo la circunvolución Heschl derecho.
- Después de la adquisición fMRI pre-TMS, retire el cabezal superior MR parte bobina de la bobina de la cabeza de 32 canales (si se utiliza el escáner 3T Siemens y la configuración de la bobina de 32 canales cabeza).
- A continuación, deslice hacia abajo el participante en la superficie del escáner.
- Fije la banda para la cabeza y un conjunto de seguimiento sobre la participcabeza de hormiga.
- Monte el brazo multi-articulado a la superficie del escáner y fijar la bobina TMS MR compatible en los brazos.
- Verificar que todos los rastreadores y la bobina están en el campo de visión de la cámara. Aquí, la cámara está ligeramente desplazada hacia el lado derecho del participante para permitir un seguimiento más fácil de los desplazamientos de la bobina cuando la orientación del hemisferio derecho.
- Calibrar la cabeza del sujeto con las herramientas de estereotaxia (es decir, instrumento de puntero). Esto se hace por coregistering varias marcas en la cabeza del participante (por ejemplo, en nuestro caso la punta de la nariz, el nasión y el trago de ambos oídos) con los mismos puntos de referencia sobre los datos anatómicos. En este procedimiento, se necesitan dos experimentadores, uno cerca de la cabeza del participante para posicionar la herramienta de puntero en la cabeza del participante, y el experimentador otra a la entrada de la sala del escáner para realizar el registro en el ordenador.
- Coloque la bobina MR compatible TMS tangencial a tél cuero cabelludo, y los rastreadores bobina dirigida hacia la cámara de infrarrojos. La bobina está orientado con el mango bobina apuntando hacia atrás y paralelamente a la línea 2. Fijar la posición de la bobina con los tornillos en el brazo multi-articulado.
- En la sala adyacente al escáner MRI, encienda el sistema TMS y comenzar la estimulación. TMS se aplica siguiendo un protocolo patrón, es decir, la estimulación continua explosión theta (CTBS) que consiste en 3 pulsos a 50 Hz, 5 Hz para repetirse a los 40 años. Usamos una intensidad de estimulación fijo (41%) definido por la salida del estimulador 18,19. Elegimos este protocolo, ya que se ha demostrado que modulan la plasticidad cortical para una duración de hasta 30 minutos después de cesar la estimulación en poblaciones sanas 20, (véase la sección de discusión de procedimiento de seguridad).
Post-TMS fMRI sesión
- Una vez que se haya completado la estimulación, es importante para obtener el tema de nuevo en el escáner, tan pronto como sea posible. Retire el TMS bobina de la sala del escáner y retire el brazo multi-articulado. Deslice hacia atrás la cabeza del participante en la bobina de la cabeza MR. Asegúrese de que el escáner está preparado y listo para funcionar. Nuestro consejo es mantener la plataforma corporal elevada durante toda la sesión de TMS, y reducir el número y duración de las exploraciones del localizador a un mínimo.
- Debido a que los efectos de la EMTr son transitorios, la sesión de exploración final debe comenzar con el análisis funcional. Una vez más, se realizó fMRI durante una ejecución de 12-min de la tarea melodía.
- Después de la exploración final se ha completado, termine con una exploración anatómica.
3. Los resultados representativos
Los análisis de los datos de la fMRI se llevan a cabo por separado tanto para la sesión de fMRI pre-y post-TMS. En cada sesión de fMRI (es decir, antes y después del TMS-), el contraste entre las melodías y la tarea de control muestra auditiva relacionada con las tareas en la actividad de la izquierda y la derecha Heschl giros, circunvoluciones temporal superior, inferior y frontal gyrus precentral circunvoluciones (Figura 1 A, B). Para evaluar las diferencias entre las sesiones de resonancia magnética funcional pre y post-TMS, llevamos a cabo un análisis de efectos aleatorios de Student para datos apareados t-test. La significación se determinó usando grupos identificados por az> 2 umbral y un umbral de clúster corregido de p = 0,05. Figura 1 C representa el contraste minus post-pre-CTBS para un único participante. Los datos sugieren que CTBS dirigidas a la derecha Heschl giro (círculo negro) induce un aumento de la respuesta fMRI en la corteza contralateral (izquierda) auditivos, incluyendo el giro a la izquierda Heschl. Los cambios en la respuesta fMRI también se encuentran en la circunvolución postcentral izquierda, de izquierda ínsula, y bilateralmente en la corteza occipital lateral. Sin embargo, ningún cambio significativo en la respuesta fMRI se ve bajo la bobina. Además, similar combinado TMS-fMRI protocolo se repite para estimular el vértice (sitio de control). Comparación de las sesiones previas y posteriores fMRI con CTBS aplicados sobre el vértice no mostró significant efecto (datos no mostrados).
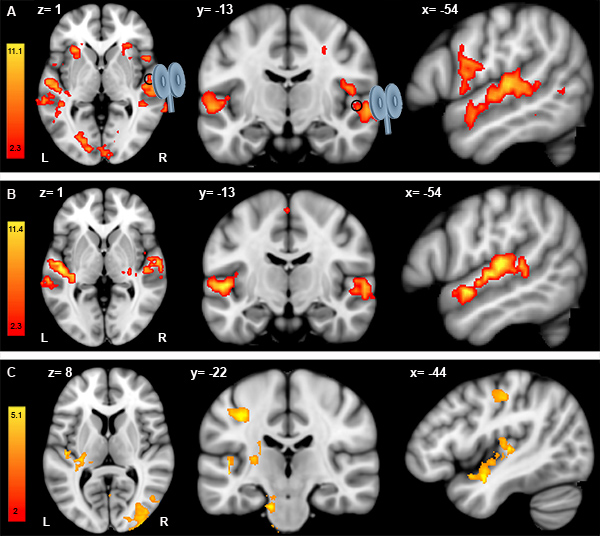
Figura 1. Análisis de las distintas pre-TMS datos de la fMRI (A), post-TMS fMRI datos (B) y post-menos pre-TMS datos fMRI (C). A. Resultados de la discriminación melodía contraste menos auditivas ensayos de control para un único participante en la sesión de fMRI pre-TMS (A) y en el período de post-TMS fMRI (B). De izquierda a derecha: vista axial, coronal y sagital. En ambos (A) y (B), la bobina TMS está apuntando a la derecha Heschl giro (círculo negro) situado en x = 54, y = -13, z = 1 (MNI152 espacio estándar). Para ambas sesiones fMRI pre-y post-TMS, se mostrarán las coordenadas en x = -54, y = -13, z = 1 (MNI152 espacio estándar) para mostrar los cambios en el hemisferio izquierdo en el lugar de estimulación (es decir, el giro a la derecha Heschl ). C. Resultados de la post-contraste minus pre-TMS sesiones utilizando fMRI de Student prueba de t pareada.
Discusión
Se describe un protocolo que combina TMS sin conexión y resonancia magnética funcional para estudiar la organización funcional de la corteza auditiva. En las secciones siguientes, vamos a discutir los aspectos metodológicos a tener en cuenta al llevar a cabo este enfoque.
Adquisición y calendario de post-TMS sesión de fMRI
Orden de adquisición exploraciones y contrapeso de las sesiones de resonancia magnética funcional antes y después de TMS-
<...Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
CIBC comunión (JA) y NSERC beca (RZ). Damos las gracias a M. Roch Comeau (Brainsight) por su ayuda con respecto a la cámara de infrarrojos, los seguidores de RM compatibles y soporte hardware. También damos las gracias a Brian Hynes (Hybex Innovations Inc.) que diseñó el brazo multi-articulado para que el titular de la bobina y proporcionó algunas de las cifras que aparecen en el video. Y un agradecimiento especial a todos los técnicos de RM y M. Ferreira del Cerebro Centro McConnell Imágenes del Instituto Neurológico de Montreal que nos ayudó a optimizar el diseño del experimento.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del Material | Tipo | Empresa | |
| La estimulación magnética transcraneal | Magstim súper Rapid2 estimulador, Rapid-2 Plus Módulo Uno | Magstim Ltd., País de Gales, Reino Unido | |
| Bobina para la estimulación magnética | MRI-compatible 70 mm figura-de-ocho-coil | Magstim Ltd., País de Gales, Reino Unido | |
| La resonancia magnética | 3-T escáner Siemens Trio, 32-canal Head Coil | Siemens, Inc., Alemania | |
| Estereotaxia sin marco | Brainsight | Rogue Research Inc., Montreal, Canadá | |
| Sistema de medición óptico | Polaris Spectra | Northern Digital Inc, Ontario, Canadá | |
| Multi-articulado brazo de sujeción de bobina | Estándar | Hybex innovaiones Inc., Anjou, Canadá | |
| MRI-Compatible con auriculares de inserción | Sensimetrics, Modelo S14 | Sensimetrics Corporation, MA, EE.UU. |
Referencias
- Winer, J. A., Schreiner, C. E. . The Auditory Cortex. , (2011).
- Andoh, J., Zatorre, R. J. Interhemispheric Connectivity Influences the Degree of Modulation of TMS-Induced Effects during Auditory Processing. Frontiers in psychology. 2, 161 (2011).
- Siebner, H. R., Hartwigsen, G., Kassuba, T., Rothwell, J. C. How does transcranial magnetic stimulation modify neuronal activity in the brain? Implications for studies of cognition. Cortex. 45, 1035-1042 (2009).
- Ruff, C. C., Driver, J., Bestmann, S. Combining TMS and fMRI: from 'virtual lesions' to functional-network accounts of cognition. Cortex; a journal devoted to the study of the nervous system and behavior. 45, 1043-1049 (2009).
- Bestmann, S. Mapping causal interregional influences with concurrent TMS-fMRI. Exp. Brain Res. 191, 383-402 (2008).
- Bohning, D. E. BOLD-fMRI response to single-pulse transcranial magnetic stimulation (TMS. Journal of magnetic resonance imaging : JMRI. 11, 569-574 (2000).
- de Vries, P. M. Changes in cerebral activations during movement execution and imagery after parietal cortex TMS interleaved with 3T MRI. Brain research. 1285, 58-68 (2009).
- Cardenas-Morales, L., Gron, G., Kammer, T. Exploring the after-effects of theta burst magnetic stimulation on the human motor cortex: a functional imaging study. Human brain mapping. 32, 1948-1960 (2011).
- Grefkes, C. Modulating cortical connectivity in stroke patients by rTMS assessed with fMRI and dynamic causal modeling. NeuroImage. 50, 233-242 (2010).
- O'shea, J., Johansen-Berg, H., Trief, D., Gobel, S., Rushworth, M. F. S. Functionally specific in human premotor reorganization cortex. Neuron. 54, 479-490 (2007).
- Pleger, B. Repetitive transcranial magnetic stimulation-induced changes in sensorimotor coupling parallel improvements of somatosensation in humans. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 1945-1952 (2006).
- Tegenthoff, M. Improvement of tactile discrimination performance and enlargement of cortical somatosensory maps after 5 Hz rTMS. Plos Biology. 3, 2031-2040 (2005).
- Andoh, J., Paus, T. Combining functional neuroimaging with off-line brain stimulation: modulation of task-related activity in language areas. Journal of cognitive neuroscience. 23, 349-361 (2011).
- Belin, P., Zatorre, R. J., Hoge, R., Evans, A. C., Pike, B. Event-related fMRI of the auditory cortex. Neuroimage. 10, 417-429 (1999).
- Hall, D. A. "Sparse" temporal sampling in auditory fMRI. Human Brain Mapping. 7, 213-223 (1999).
- Foster, N. E., Zatorre, R. J. A role for the intraparietal sulcus in transforming musical pitch information. Cereb Cortex. 20, 1350-1359 (2010).
- Bohning, D. E. Mapping transcranial magnetic stimulation (TMS) fields in vivo with MRI. Neuroreport. 8, 2535-2538 (1997).
- Corthout, E., Uttl, B., Walsh, V., Hallett, M., Cowey, A. Timing of activity in early visual cortex as revealed by transcranial magnetic stimulation. Neuroreport. 10, 2631-2634 (1999).
- Lewald, J., Foltys, H., Topper, R. Role of the posterior parietal cortex in spatial hearing. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, RC207 (2002).
- Huang, Y. Z., Edwards, M. J., Rounis, E., Bhatia, K. P., Rothwell, J. C. Theta burst stimulation of the human motor cortex. Neuron. 45, 201-206 (2005).
- Loubinoux, I. Within-session and between-session reproducibility of cerebral sensorimotor activation: a test--retest effect evidenced with functional magnetic resonance imaging. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism. 21, 592-607 (2001).
- Lisanby, S. H., Gutman, D., Luber, B., Schroeder, C., Sackeim, H. A. Sham TMS: intracerebral measurement of the induced electrical field and the induction of motor-evoked potentials. Biological psychiatry. 49, 460-463 (2001).
- Loo, C. K. Transcranial magnetic stimulation (TMS) in controlled treatment studies: are some "sham" forms active. Biological psychiatry. 47, 325-331 (2000).
- Robertson, E. M., Theoret, H., Pascual-Leone, A. Studies in cognition: the problems solved and created by transcranial magnetic stimulation. J. Cogn. Neurosci. 15, 948-960 (2003).
- Puschmann, S., Uppenkamp, S., Kollmeier, B., Thiel, C. M. Dichotic pitch activates pitch processing centre in Heschl's gyrus. NeuroImage. 49, 1641-1649 (2010).
- Johnsrude, I. S., Penhune, V. B., Zatorre, R. J. Functional specificity in the right human auditory cortex for perceiving pitch direction. Brain : a journal of neurology. 123, 155-163 (2000).
- Di Lazzaro, V. The physiological basis of the effects of intermittent theta burst stimulation of the human motor cortex. The Journal of physiology. 586, 3871-3879 (2008).
- Stagg, C. J. Neurochemical effects of theta burst stimulation as assessed by magnetic resonance spectroscopy. Journal of neurophysiology. 101, 2872-2877 (2009).
- Todd, G., Flavel, S. C., Ridding, M. C. Priming theta-burst repetitive transcranial magnetic stimulation with low- and high-frequency stimulation. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. 195, 307-315 (2009).
- Bestmann, S., Baudewig, J., Siebner, H. R., Rothwell, J. C., Frahm, J. Subthreshold high-frequency TMS of human primary motor cortex modulates interconnected frontal motor areas as detected by interleaved fMRI-TMS. Neuroimage. 20, 1685-1696 (2003).
- Bungert, A. TMS combined with fMRI. , (2010).
- Bestmann, S., Baudewig, J., Frahm, J. On the synchronization of transcranial magnetic stimulation and functional echo-planar imaging. Journal of magnetic resonance imaging : JMRI. 17, 309-316 (2003).
- Wassermann, E. M. Use and safety of a new repetitive transcranial magnetic stimulator. Electroencephalogr. Clin. Neurophysiol. 101, 412-417 (1996).
- Oberman, L. M., Pascual-Leone, A. Report of seizure induced by continuous theta burst stimulation. Brain stimulation. 2, 246-247 (2009).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clin. Neurophysiol. 120, 2008-2039 (2009).
- Wassermann, E. M. Risk and safety of repetitive transcranial magnetic stimulation: report and suggested guidelines from the International Workshop on the Safety of Repetitive Transcranial Magnetic Stimulation, June 5-7, 1996. Electroencephalography and clinical neurophysiology. , 1-16 (1998).
- Yamaguchi-Sekino, S., Sekino, M., Ueno, S. Biological effects of electromagnetic fields and recently updated safety guidelines for strong static magnetic fields. Magn. Reson. Med. Sci. 10, 1-10 (2011).
- Bestmann, S. Mapping causal interregional influences with concurrent TMS-fMRI. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. 191, 383-402 (2008).
- Oberman, L., Edwards, D., Eldaief, M., Pascual-Leone, A. Safety of theta burst transcranial magnetic stimulation: a systematic review of the literature. Journal of clinical neurophysiology: official publication of the American Electroencephalographic Society. 28, 67-74 (2011).
- Kangarlu, A. Cognitive, cardiac, and physiological safety studies in ultra high field magnetic resonance imaging. Magn. Reson. Imaging. 17, 1407-1416 (1999).
- Schenck, J. F. Safety of strong, static magnetic fields. Journal of magnetic resonance imaging : JMRI. 12, 2-19 (2000).
- Lee, V. S. . Cardiovascular MRI: physical principles to practical protocols. , 175 (2006).
- Paus, T. Transcranial magnetic stimulation during positron emission tomography: a new method for studying connectivity of the human cerebral cortex. The Journal of neuroscience: the official journal of the Society for Neuroscience. 17, 3178-3184 (1997).
- Sack, A. T., Linden, D. E. Combining transcranial magnetic stimulation and functional imaging in cognitive brain research: possibilities and limitations. Brain Res. Brain Res. Rev. 43, 41-56 (2003).
- Ilmoniemi, R. J. Neuronal responses to magnetic stimulation reveal cortical reactivity and connectivity. Neuroreport. 8, 3537-3540 (1997).
- Thiel, A. From the left to the right: How the brain compensates progressive loss of language function. Brain Lang. 98, 57-65 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados