Method Article
Generación de ratones derivados de células madre pluripotentes inducidas
En este artículo
Resumen
Generación de células madre pluripotentes inducidas (IPSC) Líneas produce líneas con diferente potencial de desarrollo aún cuando pasan las pruebas estándar de pluripotencia. Aquí se describe un protocolo para producir ratones totalmente derivadas de iPS, que define las líneas de IPSC como poseedor completo pluripotencia 1.
Resumen
La producción de células madre pluripotentes inducidas (iPS) a partir de células somáticas proporciona un medio para crear herramientas valiosas para la investigación básica y también puede producir una fuente de células encontrados en el paciente para terapias regenerativas. iPSCs se pueden generar usando múltiples protocolos y derivados de fuentes múltiples de la célula. Una vez generado, iPSCs se prueban utilizando una variedad de ensayos que incluyen la inmunotinción para marcadores de pluripotencia, generación de tres capas germinales en cuerpos embrioides y los teratomas, las comparaciones de la expresión génica con células madre embrionarias (CME) y la producción de ratones quiméricos con o sin línea germinal contribución 2 . Es importante destacar que las líneas de IPSC que pasan estas pruebas todavía varían en su capacidad para producir diferentes tipos de células diferenciadas 2. Esto ha hecho que sea difícil establecer qué protocolos IPSC derivación, fuentes de donantes de células o los métodos de selección son más útiles para diferentes aplicaciones.
La prueba más rigurosade si una línea de células madre tiene el suficiente potencial de desarrollo para generar todos los tejidos necesarios para la supervivencia de un organismo (denominado completo pluripotencia) es la complementación embrión tetraploide (TEC) 3-5. Técnicamente, TEC implica electrofusión de embriones de dos células para generar tetraploides (4n) de una célula de embriones que se pueden cultivar in vitro hasta la etapa de blastocisto 6. Diploide (2N), las células madre pluripotentes (por ejemplo, los CES o IPSCs) se inyectan en la cavidad blastocele del blastocisto tetraploide y se transfiere a una hembra receptora para la gestación (ver Figura 1). El componente tetraploide del embrión complementado contribuye casi exclusivamente a los tejidos extraembrionarios (placenta, saco vitelino), mientras que las células diploides constituye el propio embrión, lo que resulta en un feto deriva totalmente de la línea de células madre inyectados.
Recientemente, se informó de la derivación de líneas de IPSC que generan y reproducen los ratones adultospor TCE 1. Estas líneas IPSC dar lugar a crías viables con eficiencias del 5-13%, que es comparable a los CES 3,4,7 y mayor que el reportado para la mayoría de las otras líneas 8-12 IPSC. Estos informes muestran que la reprogramación directa puede producir iPSCs plenamente pluripotentes que coincidan con los CES en su potencial de desarrollo y la eficiencia de la generación de crías en las pruebas de TEC. En la actualidad, no está claro lo que distingue entre iPSCs plenamente pluripotentes y las líneas menos potentes 13-15. Tampoco está claro qué métodos de reprogramación se producen estas líneas con la máxima eficiencia. Aquí se describe un método que produce iPSCs plenamente pluripotentes y "all-IPSC ratones", que pueden ser útiles para los investigadores que deseen comparar la pluripotencia de las líneas de IPSC o establecer la equivalencia de los diferentes métodos de reprogramación.
Protocolo
Este método se utilizó en la investigación publicada en Boland et al. Nature. 461, 91-96 (2009). 1
1. Preparación de Lentivirus
Este protocolo emplea inducible por doxiciclina, vectores lanzadera lentiviral que codifican para Oct4, Sox2, Klf4, c-Myc y bajo el control de un elemento de respuesta a tetO. Los transgenes son activados por la tetraciclina inversa trans-activación de la proteína, rtTAM2.2 16, que induce la expresión de factor de reprogramación en presencia de doxiciclina. Este sistema permite estrechamente controlada, la alta expresión de factores de reprogramación. Los vectores lentivirales usados aquí son auto-inactivación y por lo tanto no puede replicar la integración genómica siguiente. Sin embargo, se requiere precaución al trabajar con los lentivirus y se debe realizar en los laboratorios cumplen con BSL2 (EE.UU.) y S2 normas (Europa).
- Descongelar las células HEK293T y el paso por lo menos una vez antes de transfection. Las células se debe mantener a una densidad subconfluente en un medio de HEK a 37 ° C, 5% de CO 2 en un ambiente humidificado. Rutinariamente células de paso cada 2 días con una relación de división de 1:06-1:10.
- Seed ~ 8 x 10 6 HEK293T cells/T150 con 25 ml de medio de HEK. Utilice uno T150 para cada preparación lentivirus.
- Los siguientes días transfectar células HEK293T por precipitación de fosfato de calcio. (Nota: en nuestras manos precipitación con fosfato cálcico de forma rutinaria como resultado una eficacia de transfección 80-90%, sin embargo, reactivos de transfección de lípidos catiónicos tales como Lipofectamine 2000 también se pueden utilizar). Preparar dos tubos cónicos de 15 ml para cada virus que se prepare. Etiquete los tubos "A" y "B". El tubo A, 10 g de cada una de: los factores de conexión lentiviral vector de codificación de reprogramación (o rtTAM2.2), los vectores de empaquetamiento vírico, y plásmido que codifica la proteína de la envoltura viral, VSVG. Añadir 186 l 2 M CaCl 2 a un tubo, y llevar el volumen a 1,5 ml de H 2 O estéril. Tubo B: 1,5 ml 2x HBS (pre-calentada a temperatura ambiente).
- Pipetear la mezcla en el tubo A hasta que sea una solución homogénea. Añadir la solución A a la solución B gota a gota y se deja reposar a temperatura ambiente durante 2-3 min.
- Aspirar el medio de cultivo de células HEK293T y reemplazar con 22 ml pre-calentado medio HEK sin penicilina y estreptomicina.
- Pipetear combinado soluciones AB (precipitado de fosfato de calcio) directamente a las células HEK293T y distribuir uniformemente suave balanceo.
- 24 h después de la transfección de células HEK-293T células con lentivirus, quitar el medio de crecimiento y reemplazarlo con 25 ml de fresco, precalentado medio HEK. Volver HEKS transfectadas a la incubadora.
- 48 h después de la transfección de células HEK-293T células con lentivirus, recoger los medios de crecimiento que contenían partículas lentivirales a partir de los HEKS transfectadas. Eliminar restos de partículas de la solución viral cosechadas por centrifugación a 3.000 xg durante 5 min a 4 ° C.
- Concentrar el virus por ultracentrifugación throuf un cojín de sacarosa al 20% (2 ml sucrose/25 ml de sobrenadante viral) durante 2 horas a 112.000 xg a 4 ° C. Suspender sedimento viral en 0,4 ml de medio MEF a 4 ° C durante 15-30 min con agitación suave. La tienda de partículas virales en alícuotas de un solo uso (es decir, 50 l) a -80 ° C.
2. Preparación de fibroblastos embrionarios de ratón (MEF) para la reprogramación
Nota: El protocolo descrito aquí se refiere a la derivación de iPSCs de fibroblastos de ratón E 13,5 embrionarias para uso en ensayos TEC. Aunque otros grupos han generado todo IPSC ratones de fuentes de donantes de células adultas, no hemos probado este método en otros tipos de células y no se puede estar seguro de que tipo de donante de células no es un factor.
- Configurar ratón apareamientos cronometradas. En el día embrionario 13.5 (E13.5), practicar la eutanasia a la hembra embarazada y diseccionar los embriones de los cuernos uterinos. Lugar y embriones tienda en 1x PBS (enfriado previamente a 4 ° C) en hielo.
- Quite los tejidos extraembryonic (es decir,corion, amnios y la placenta). Decapita el embrión y eliminar la cola (opcional - si es necesario para determinar el genotipo) y las extremidades. Saque los órganos internos, utilizando pinzas o una espátula en forma de pala y pica la canal que queda con la hoja de un bisturí o tijeras afiladas.
- Lavar la carcasa picada en 5 ml de PBS enfriado previamente 1x. Centrifugar a 200 xg durante 5 min.
- Aspirar el sobrenadante. Suspender el pellet en 5 ml de 0,25% de tripsina-EDTA y se incuba a 37 ° C con agitación vigorosa durante 20-30 min.
- Añadir 5 ml de medio MEF (precalentado a 37 ° C), mezclar y centrifugar a 200 xg durante 5 min.
- Aspirar el sobrenadante y resuspender el pellet en pre-calentado medio MEF.
- Placa disociado MEFs en 2-3 pocillos de una placa de 6-así pre-recubierto con gelatina 0,1%. Esto se considera el paso 1.
- Pasaje MEFs a una dilución de 1:04-1:05 cada 48 horas. MEFs en el paso 3 está listo para la transducción lentiviral.
3. Derivación de líneas de IPSC
- El día antes de la transducción lentiviral; semillas de ~ 3 x 10 5 primaria MEFs en un pocillo de una placa de 6-así pre-recubierto con gelatina 0,1%.
- Día 1: Primario MEFS debe ser 80-90% confluente para la transducción lentiviral. Añadir partículas lentivirales directamente al MEF medios de comunicación y se incuba durante la noche a 37 con MEFs ° C, 5% de CO 2 en un ambiente humidificado.
- El día siguiente (día 2) se aspira el medio y lavar dos veces con 3 ml de 1x PBS para eliminar las partículas virales.
- Añadir 0,5 ml pre-calentado 0,25% de tripsina-EDTA a las células y se incuba a 37 ° C durante 3-5 min con agitación ocasional.
- Se tritura para lograr una única suspensión de células. Observar las células por microscopía de luz para asegurar una suspensión de células individuales.
- Transferencia MEFs en un tubo cónico de 15 ml que contiene 5 ml de medio de MEF. Centrifugar a 200 xg durante 5 min. Aspirar el sobrenadante y volver a suspender las células suavemente en medio MEF.
- Dividido a partes iguales de la suspensión celular entre dos pozos de un bien p 6fines de pre-recubiertas con gelatina 0,1%.
- Oscilar la placa de un lado a otro, lado a lado, y una vez en un movimiento circular para conseguir una distribución uniforme de las células de todo el pozo. Incubar durante una noche a 37 ° C, 5% de CO 2 en un ambiente humidificado.
- Día 3: Repetir los pasos 4-9 excepto dividir las células uniformemente de un pozo a 3 pocillos de una placa de 6 así pre-recubierto con gelatina 0,1%. Esto dará lugar a 6 pozos de transduced fibroblastos primarios.
- Día 4: Añadir doxiciclina (dox) a una concentración de 10 mg / ml a 5/6 pocillos. Un pozo debe permanecer sin tratar para servir como control.
- Añadir VPA en 1,9 mM a 3 de los 5 pocillos tratados con dox. VPA reduce la tasa de proliferación de MEFs. Cultivos densos de MEFs tolerar la exposición prolongada a la VPA mientras que los cultivos subconfluentes tienden a envejecer dentro de 2-5 días. Por lo tanto, MEFS debe ser 100% de confluencia cuando se añade VPA. Nota: Usamos VPA en nuestros experimentos de reprogramación, ya que es un modificador de la epigenética conocido, y ha sido SHpropio para aumentar la eficiencia de la generación de IPSC 17 aunque los efectos y mecanismos de acción de VPA con respecto a la generación de líneas IPSC plenamente pluripotentes no son conocidos.
- Día 5: Aspirar el medio, lavar y Tripsinizar las células como antes. Passage las células tratadas con dox / VPA a un 15 cm 2 placa de cultivo de tejido recubierto previamente con gelatina 0,1% y cada una de las otras condiciones de pre-recubiertos con 10 cm 2 platos en medio de células ES fresco suplementado con dox y VPA.
- Rellene todos los días las células con medio fresco suplementado con ESC dox y VPA. ESC-como colonias deben empezar a aparecer después de menos de 7 días en el tratamiento dox / VPA y después de ~ 10 días en el tratamiento solo dox. No debe aparecer colonias en ausencia de tratamiento dox.
- Una vez que las colonias poseen una refracción brillante, borde bien definido y contienen 30-50 células, aislar manualmente las colonias con una punta de pipeta de carga de gel y la transferencia a un fondo en U de 96 pocillos que contiene 20 l de 0.25% De tripsina-EDTA. Tripsinizar a las células individuales y transferir a los alimentadores en un fondo plano de 96 pocillos en 150 l medio que contiene dox ESC / VPA o dox solo.
- Continuar la expansión clonal de las líneas aisladas IPSC en alimentadores en media ESC. Eliminar dox y VPA en día 19 después de su adición (después de la transducción día 23). Deseche las líneas de IPSC que no mantienen la auto-renovación o las tasas de proliferación similares a los controles DESC.
Puede ser útil para caracterizar las líneas de IPSC en relación con las CME antes de intentar realizar TEC. Hemos caracterizado nuestras líneas por 1) la expresión de marcadores de pluripotencia endógenos (SSEA-1, Oct4, Sox2, Nanog) mediante inmunocitoquímica, 2) el análisis del cariotipo mediante recuento por cromosoma y 3) formación de cuerpos embrioides. Uno puede también realizar lentiviral específico de RT-qPCR para confirmar que los transgenes proviral no se expresan en los iPSCs. Sin embargo, hemos identificado iPSCs plenamente pluripotentes utilizando sólo la morfología, la inmunotinción y karyotyping. En nuestros experimentos, la selección de líneas de IPSC basado en ESC-como la morfología y los resultados de las características de crecimiento en la mayoría de las líneas que expresan marcadores de pluripotencia mientras que típicamente identifican varias líneas con cariotipos anormales potencialmente.
4. Preparación de iPSCs para inyección de blastocistos
Número de paso de una línea PSC se ha demostrado que afectan a su pluripotencia 18 aunque esto puede ser dependiente de la línea 19. Hemos utilizado iPSCs de pasajes de 8.14 a producir todos los adultos IPSC ratones.
- IPSCs Descongelar y placa en los alimentadores en media ESC. El paso de las células al menos una vez en los alimentadores antes de su uso para la inyección.
- Un pocillo de una placa de 6 pocillos que contiene 70-80% confluentes iPSCs proporcionará más de un número suficiente de células para inyección. Aspirar el medio de cultivo y lavar las células con ~ 3 ml de PBS 1x (sin Ca 2 + / Mg 2 +).
- Añadir 0,5 ml de pre-calentado 0,05% de tripsina-EDTA alas células y se incuba a 37 ° C durante 10 min con agitación ocasional.
- Se tritura para lograr una única suspensión de células. Observar las células por microscopía de luz para asegurar una suspensión de células individuales. Los iPSCs necesitan estar en suspensión de células individuales en forma de colonias / agregados de células se obstruirá la pipeta de inyección.
- Una vez que una única suspensión de células ha alcanzado ben, añadir 1,0 ml ESC medios de comunicación para el bien y devolver la placa de la incubadora a 37 º C. Incubar durante ~ 15 min o hasta que la mayoría de los alimentadores han empezado a adherirse.
- Retire con cuidado el medio que contiene los iPSCs teniendo cuidado de no desalojar a los alimentadores débilmente adherentes.
- Coloque los iPSCs en un tubo cónico de 15 ml que contiene 5 ml de medio de ESC. Centrifugar a 200 xg durante 5 min. Aspirar el sobrenadante y eliminar el resto de medio de células ES con una micropipeta. Toque en el tubo para desprender el sedimento y las células se resuspenden suavemente en medio FHM 0.2-0.5 ml pre-enfriado. Almacene las celdas en el hielo hasta que, ya durante la inyección en tetraploide blastocysts.
5. Generación de blastocistos tetraploides
Los procedimientos realizados en esta sección se han descrito en detalle en otra parte 5,6,20. Aquí describimos nuestra técnica, optimizado para el Manipulador celular BTX Electro ECM 2001.
- Configure ratones embrionarios donantes por cebado 23-28 días de edad ratones hembra (C57BL/6J-Tyr c-2J / BALB / cByJ F1) con el síndrome premenstrual y HCG. Administrar 5 UI de PMS a las 2PM y 5 UI de HCG 47 horas más tarde. Después de la inyección de HCG, creado ratones hembra con C57BL/6J-Tyr c-2J / BALB / cByJ hombres prisioneros de F1. Marque el día siguiente de tapones vaginales.
- La eutanasia a los ratones hembra enchufado y recoger oviductos. Recoge una célula de embriones mediante la colocación de oviductos en FHM con hialuronidasa y rasgando suavemente la ampulae. Permita que las masas del cúmulo de sentarse en FHM / Hialuronidasa para 5-7 min.
- Recoge 1-células de embriones utilizando una pipeta de boca y lavarse a través de las gotas de los medios de comunicación FHM antes de colocarlos en KSOMCultura-AA. Cultura a 37 ° C, 5% de CO 2 bajo aceite mineral durante la noche y seleccionar 2-células de embriones el día de electrofusión, descartar todos los otros embriones.
- Coloque un portaobjetos BTX en una placa de Petri de 10 cm. Vierta suficiente espacio de medios de electrofusión de temperatura para sumergir el portaobjetos en la solución, pero no tanto que los polos del electrodo estén completamente sumergidos.
- Encienda el ECM 2001 y BTX Enhancer 400. Conectar los cables de la ECM para el electrodo de portaobjetos y fijar los cables en el lado de la placa de Petri para evitar el movimiento no intencionado de la diapositiva.
- Ejecute un pulso manual para obtener una lectura sobre el potenciador de BTX y anote el voltaje de las corrientes AC / DC se aplican. AC actual controlar la velocidad a la que los embriones se alinearán entre los electrodos, la corriente DC se fusionan los blastómeros, y tiempo de pulso se establece la longitud del pulso de corriente continua. Un buen punto de partida es AC 3 V, 100 V DC, y el tiempo ms 0,05. El DC óptima varía en el intervalo de 90-150 voltios.
- Utilizando una pipeta de boca, toma cerca de 30-40 dos células de embriones de KSOM-AA cultura y lavarlos a través de varias gotas de medio de electrofusión. Dibuje medio fresco electrofusión del plato portaobjetos en pipetear con la boca y tomar embriones del lavado. Colocarlos en la separación de 1 mm entre los electrodos sobre el portaobjetos. Tener cuidado de que estén alineados por la mitad de la distancia y que no están en contacto unos con otros.
- Aplicar AC actual pulsando el botón pulsador manual. Los embriones se giran en el campo de corriente alterna, hasta que el plano de contacto de blastómeros es paralelo a los electrodos. Si los embriones no están alineados en unos pocos segundos, aumentar el ajuste de AC.
- Después de embriones han alineado, presione el botón de pulso manual de nuevo para aplicar el pulso DC.
- En medio de electrofusión en la pipeta, recoger los embriones del portaobjetos. Lavar los embriones a través de varias gotas de KSOM-AA y colocarlos en KSOM-AA cultivo a 37 ° C, 5% de CO 2. La fusión blastómeras shoULD se completó en menos de 30 min en cultivo.
- Repita los pasos 7-11 para permanecer dos células de embriones. Después de sucesivos grupos de fusión, controlar y seleccionar embriones con blastómeras fusionados. Fusionadas con éxito embriones se parecen estar en fase 1-célula. Deseche embriones lisadas y 2 células después de 30 minutos en la cultura. Si la tasa de fusión es inferior a 80%, aumenta la tensión y / o de tiempo en incrementos de 5 V y 0,01 mseg. Si la lisis es superior a 20%, disminuir el voltaje de CC y / o el tiempo en consecuencia. Los ajustes óptimos en nuestros experimentos eran 4V CA 146v DC, y ms 0,07. Estos ajustes consistentemente produjo 90% o mayores tasas de fusión con poca o ninguna lisis.
- Continuar con la cultura embriones fusionados en microgotas de KSOM-AA bajo aceite mineral a 37 ° C, 5% de CO 2. Podrá esperar 85-95% de los embriones fusionados para formar tetraploides (4n) blastocistos después de 48 horas de incubación.
6. La microinyección de iPSCs en blastocistos tetraploides
Utilizamos una Nikon TE-2000Umicroscopio invertido equipado con óptica DIC y micromanipuladores Narishige para la inyección de blastocistos. Cada blastocisto tetraploide se inyecta con 10-12 iPSCs utilizando un protocolo estándar para la inyección en blastocistos de ratón ESC que se ha demostrado en una publicación anterior JoVE 5,20,21
- Coloque una caída de 20 l de FHM en el centro de un portaobjetos de microscopio cóncava y se cubre con 150 l de aceite mineral.
- Baje la pipeta de sujeción y la aguja de microinyección en la gota FHM. Permitir 2-3 min para las dos agujas para llenar parcialmente con FHM.
- Lavar 20-30 blastocistos tetraploides a través de gotas de FHM y la transferencia a la caída de FHM en el portaobjetos de microscopio.
- Boca pipeta CMPi mezcla en la gota. Puede ser necesario diluir la mezcla de células en una gota de FHM de antemano si las células son muy concentrados o agregados.
- Recoge 100-200 células con la aguja de inyección.
- Mantenga el blastocisto con la masa celular interna en el punto 9 postulanion. Inyectar células en blastocele mediante la penetración de la zona pelúcida y el trofoblasto en la posición de las 3 en punto. Inyectar 16-18 células por blastocisto.
- Volver IPSC blastocistos complementan a KSOM-AA cultura.
7. La transferencia de blastocistos tetraploides Complementado en los cuernos uterinos de los ratones receptores
Complementado blastocistos tetraploides son quirúrgicamente transferido a los cuernos uterinos de los ratones receptores femeninos de acuerdo con las directrices del instituto del investigador, utilizando la técnica estándar de 20, que deberá resumir brevemente. Seleccione una hembra CD-ratones en la fase de pro-estro y ponerlos para el apareamiento con machos vasectomizados. Compruebe que los tapones vaginales de la mañana siguiente. Las hembras están listos para la transferencia de embriones uterino dos días después de la clavija se detectó (2,5 dpc).
Un día antes de hembras receptoras se aparean con machos vasectomizados, creada adicionales 1 CD-hembras con machos vasectomizados nopara ser utilizado como madres adoptivas para todos-IPSC ratones recuperados por cesárea.
8. Cesárea y Fomento de la IPSC derivados Pups
La transferencia de embriones TC típicamente resulta en múltiples reabsorciones después de la implantación, aunque la IPSC o línea ESC tiene un alto potencial de desarrollo. Como resultado, se puede esperar no más de 4 crías viables (generalmente 1-2) por receptor. Estas pequeñas camadas suelen pasarse por alto por los destinatarios. Para aumentar el nivel de la atención neonatal y la tasa de supervivencia, se realiza una cesárea y el fomento de acuerdo con el estándar de protocolos 20. Para realizar la cesárea, la eutanasia a los ratones receptores 16 días después de la transferencia de embriones en 7-8PM (destinatario 18,5 DPC) y diseccionar las crías de los cuernos uterinos. Fomentar crías viables para CD-1 camadas madres que entregan el mismo día.
Resultados
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
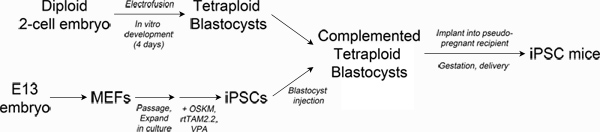
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
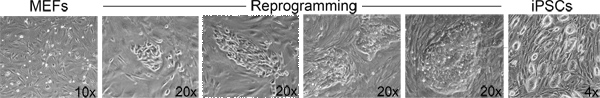
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
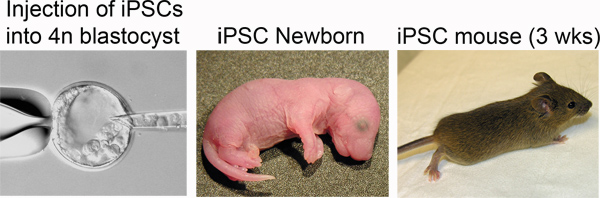
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Discusión
Generación de ratones a partir de líneas de IPSC usando ensayos TEC ofrece una rigurosa prueba funcional de la pluripotencia de una línea de IPSC. Esta prueba puede ser útil para evaluar la eficacia relativa de los diferentes métodos de reprogramación o para identificar líneas de IPSC que pueden ser más útiles para generar ciertos tipos de células in vitro. Los ratones generados a partir de iPSCs puede ser utilizado para probar rigurosamente la estabilidad a largo plazo y la tumorigenicidad de IPSC derivados de tejidos. Este protocolo será de utilidad para los investigadores que deseen generar líneas IPSC plenamente pluripotentes o ratones IPSC o para comparar la utilidad relativa de los diferentes métodos de reprogramación.
Los mecanismos que controlan la generación e identificación de iPSCs plenamente pluripotentes tampoco se conoce bien y es posible que algunas líneas de IPSC producido utilizando este método no pasará la prueba TEC. Hay muchos factores que pueden variar entre los experimentos genéticos, incluidos los fondos de titulación lentiviral, los patrones de lentiviral insertion, los parámetros del ciclo celular de la población de donantes, entre laboratorios diferencias en diversas etapas del procedimiento de TEC y propensiones variables de iPSCs para albergar aberraciones genéticas o epigenéticas. Para garantizar el mejor éxito, nos ocupamos de establecer los niveles apropiados de expresión génica lentiviral en experimentos de derivación IPSC probando diluciones virales en MEFs de control para asegurar que cada virus está suficientemente concentrada como para producir la expresión del gen detectable al menos 80% y, preferiblemente, 100% de la MEFs. Esto nos permite identificar líneas con múltiples copias de los lentivirus diferentes, mientras que la toxicidad limitante de la MEFs y producir colonias sin hacinamiento de los pozos. Cabe señalar que varios otros protocolos han demostrado producir iPSCs con potencial de desarrollo completo, utilizando múltiples métodos y fuentes de donantes de células que sugieren que múltiples rutas hacia completo pluripotencia pueden existir 1,8-13,15. En la actualidad, sin embargo, ningún biomarcador definitivo de completamente pluripotentes CMPiSe ha identificado y por lo tanto el ensayo de TEC sigue siendo la prueba patrón oro de si una línea de IPSC puede generar todos los linajes de células en un organismo.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Apoyo a KKB, MJB, JLH y KLN fue proporcionada por el Instituto de Medicina Regenerativa de California, el Programa Pew Charitable Trusts Biomédica Scholars, el Esther B. O'Keeffe Family Foundation y la Fundación de la Familia Shapiro. KKB es un Donald E. y Delia B. Baxter Fundación Facultad Scholar.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
Referencias
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. . Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -. Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -. y., et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados