Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La imagen no invasiva de la candidiasis diseminada en larvas de pez cebra
En este artículo
Resumen
El rápido desarrollo de tamaño pequeño y la transparencia del pez cebra son grandes ventajas para el estudio del control inmunitario innato de la infección 1-4. Aquí nos demuestran técnicas para infectar larvas de pez cebra con el hongo patógeno Candida albicans Por microinyección, la metodología usada recientemente para implicar a la actividad de los fagocitos de la NADPH oxidasa en el control del dimorfismo de hongos 5.
Resumen
La candidiasis diseminada causada por el patógeno Candida albicans es un problema clínicamente importante en individuos hospitalizados y se asocia con una mortalidad de 30 a 40% atribuible 6. La candidiasis sistémica es normalmente controlada por la inmunidad innata, y las personas con defectos genéticos en los componentes de células inmunes innatas como la NADPH oxidasa fagocítica son más susceptibles a la candidemia 7-9. Muy poco se sabe sobre la dinámica de la C. la interacción albicans con las células inmunes in vivo. extensa en estudios in vitro han demostrado que fuera del huésped C. albicans, germina en el interior de los macrófagos, y es rápidamente destruido por los neutrófilos 10-14. Los estudios in vitro, aunque útil, no se puede resumir el complejo en un entorno vivo, que incluye el tiempo que dependen de la dinámica de los niveles de citoquinas, archivos adjuntos de la matriz extracelular, y los contactos intercelulares 10, 15-18 La larva de pez cebra ofrece un hospedador vertebrado único y versátil para el estudio de la infección. Durante los primeros 30 días de desarrollo de larvas de pez cebra sólo tienen defensas inmunológicas innatas 2, 19-21, lo que simplifica el estudio de enfermedades como la candidiasis diseminada que son altamente dependientes de la inmunidad innata. El pequeño tamaño y la transparencia de las larvas de pez cebra permitirá imagen de la dinámica de la infección a nivel celular, tanto para hospedante y el patógeno. Larvas transgénico con fluorescencia células inmunes puede utilizarse para identificar los tipos de células específicos implicados en la infección 22-24. Modificados oligonucleótidos antisentido (Morpholinos) se puede utilizar para derribar varios componentes inmunes como la NADPH oxidasa fagocítica y estudiar los cambios en respuesta a fungal infección 5. Además de las ventajas prácticas y éticas de la utilización de un pequeño vertebrado inferior, las larvas de pez cebra ofrece la posibilidad única de la imagen de la batalla campal entre patógeno y huésped tanto intravitally y en color.
El pez cebra se ha utilizado para la infección de modelo para una serie de bacterias patógenas humanas, y ha sido instrumental en importantes avances en nuestra comprensión de la infección por micobacterias 3, 25. Sin embargo, sólo recientemente han patógenos mucho más grandes tales como hongos han utilizado para infectar larva 5, 23, 26, y hasta la fecha no ha habido una descripción visual detallada de la metodología de la infección. Aquí les presentamos nuestras técnicas de microinyección cerebro posterior del ventrículo de Prim 25 el pez cebra, incluyendo nuestras modificaciones de los protocolos anteriores. Nuestros resultados con el modelo de larvas de pez cebra para la infección por hongos difieren de los estudios in vitro y refuerzan la necesidad de examinar la intera huésped-patógenocción en el complejo entorno de la máquina en lugar del sistema simplificado de la placa de Petri 5.
Protocolo
Todos los protocolos de atención de pez cebra y los experimentos se realizaron bajo Cuidado de Animales institucional y el empleo (IACUC) de protocolo A2009-11-01.
1. Morfolino y platos de larvas de inyección
Experimental Duración: * (10-15 minutos)
Grado de dificultad: *
- Para inyecciones de huevo, preparar una solución al 2% de agarosa en agua estéril y microondas. Cuando la solución se haya enfriado vierta un poco de ella en un plato extra profunda Petri (Fisher Scientific) hasta que esté medio lleno. Enfriar en hielo y hacer que la placa esté nivelada.
- Una vez que el plato se ha enfriado, se vierte una capa de 15 ml superior de agarosa al 2%. Rocíe una inyección de huevo molde de plástico acanalado (Adaptive herramientas de la ciencia) con agua estéril con una botella de spray. Coloque con cuidado el lado de la ranura hacia abajo en el molde caliente de agarosa. Cuando la agarosa se haya enfriado, utilizar una espátula de metal plana (VWR Scientific) para disociar el molde de la AGAse levantó. Poco a poco quitar la rejilla de la agarosa. Envuelva los platos de inyección de embriones en Parafilm (VWR Scientific) y la tienda invertida a 4 ° C.
- Para las inyecciones de larvas de peces, preparar una solución al 2% de agarosa como se ha descrito. Vierta la solución en un tamaño estándar de placa de Petri (VWR Scientific) y dejar de lado hasta que solidifique. Envuelva los platos de las larvas de inyección de Parafilm y la tienda invertida a 4 ° C.
2. Preparación de cultivo de hongos
Experimental duración: ** (30 minutos)
Grado de dificultad: **
- Preparar extracto de levadura-peptona-dextrosa (YPD) placas de agar: 10 g / litro de extracto de levadura, 20 g / litro de peptona, 20 dextrosa g / litro, y 20 g / litro de agar en y autoclave. Para líquido YPD preparar 10 g / litro de extracto de levadura, peptona 20 g / litro, 20 dextrosa g / litro y 20-30 minutos autoclave a 121 ° C.
- Dos días antes de las infecciones de preparar un plato de pescado de la racha de congeladosexistencias de Candida albicans culturas en agar YPD para obtener colonias aisladas.
- Incubar a 37 ° C durante la noche.
- Poner 5 ml de caldo de YPD a 16 x 150 mm tubos de cultivo (VWR Scientific).
- El día antes de las infecciones de pescado tomar una pequeña colonia en el agar YPD con una clavija de madera (VWR Scientific). Poner el palo en el tubo de la cultura y la forma de remolino en torno a una nueva suspensión de colonias en el líquido YPD.
- Crecer durante la noche a 37 ° C en un tambor de rodillo Cultura TC-7 tejido equipado con una rueda de prueba de 14 pulgadas tubo (New Brunswick Scientific).
- Al día siguiente, la desaceleración de 1 ml de la cultura en g 14000x durante 1 minuto en un tubo de 1,7 mL (Axygen). Eliminar el sobrenadante y resuspender el precipitado en el líquido residual con el vórtex (VWR Scientific).
- Añadir 1 ml 1x Tampón fosfato salino (VWR Scientific) y girar como se describió anteriormente.
- Repetir el lavado con PBS 3 veces.
- Diluir dilución 1:100 en PBS 1x (10 l de lavado C. albicans en 990 l P 1xBS).
- Cuente con un hemocitómetro (VWR Scientific).
- Diluir a 10 7 células / ml.
3. Infecciones de pez cebra
Experimental Duración: **** (1-3 horas)
Grado de dificultad: ****
- Recoge los embriones de acuerdo a la sección 5 y la tienda en la yema de agua, 60 mg / L de sales de mar instantáneos (Fisher Scientific) en agua desionizada estéril.
- Utilizando un microscopio de disección, tales como la SZ61 Olympus (Olympus), embriones dechorionate en día infección. Use unas pinzas Dumont Dumoxel (VWR Scientific) para sacar el corion 27 pedazos como la apertura de una bolsa de papas fritas, o suavemente la pinza en la posición cerrada en el corion y luego poco a poco a abrir. El pescado debe estallar a la derecha del corion.
- Agitar el plato Petri adicional de profundidad con la tapa en mover el pescado en el centro del plato. Transferir los peces a la tapa de la cápsula. Quitar huevo-agua y sereemplazar con medio fresco. Añada el pescado a los medios.
- Caliente los platos de inyección de larvas en una incubadora a 28 ° C. Preparar tricaína metano sulfonato (Occidental Chemical Inc.) la dilución a 200 mg / ml para anestesiar a los peces.
- Contar el número deseado de las larvas de la infección (20-50 pescado). Coloque el pescado en una solución tricaína metano sulfonato y esperar 1-2 minutos hasta que deja de moverse.
- Encienda la unidad MPPI-3 de la inyección (Applied Scientific Instruments). Asegúrese de que el interruptor de presión es el "pulso" y la "duración de impulso" se ajusta a 9 con 3 PSI para la unidad de contrapresión. Abrir la válvula al tanque de nitrógeno hasta que la presión en la unidad de inyección lee 30 PSI.
- Cargar una tira micropipeta 28 con 5 l de vórtex Candida albicans a una concentración de 1x10 7 células / ml. Colocar la micropipeta en el titular de la micropipeta (Applied Scientific Instruments). Llenar un vacío plato extra de Petri con agua profunda. Mueva la micropipeta hasta que la punta is dentro de vista simplemente tocando la superficie del agua a través de microscopio de disección y el uso Dumont Dumoxel pinzas (VWR Scientific) para recortar la aguja aproximadamente 3 mm desde la punta de la pipeta sacó.
- Pulse el interruptor de pie (Applied Scientific Instruments) para verificar que la aguja ha sido recortada. Usted debe ver el líquido se dispersan si tuvieron éxito. El diámetro del bolo líquido no debe ser más grande que el diámetro de la pupila de la larva de pez cebra prim 25 (0,21 mm, dando una esfera de 4,9 nL en volumen). Ajustar la presión de acuerdo a si el bolo de líquido es demasiado grande o demasiado pequeño.
- Se anestesia a los peces en metano sulfonato tricaína (200 ug / ml). Una vez que los peces han dejado de moverse, girar el plato con la tapa puesta hasta que el pescado se encuentran en el centro. Recoge el 50 peces utilizando una pipeta de transferencia (Fisher Scientific). Toque en el lado de la pipeta para liquidar a los peces hacia la punta. Suavemente pipetear pescado en el plato de larvas de agarosa utilizando como líquido poco como sea posible.
- Cubra el pescado con una varilla de vidrio liso (tenga cuidado de no aplastarlos!). Aspirar el líquido que sea posible, fuera del plato. Use un KIMWIPE que absorbe y expulsa a la basura cualquier humedad.
- Coloque el plato de larvas de peces de agarosa bajo el microscopio hasta que obtener una buena vista de los peces y la aguja, al mismo tiempo. Mueva la aguja de cristal hacia el pez. Zoom sobre los peces y la aguja a medida que la posición de la aguja hacia el pez. Cuidadosamente mueva la aguja de vidrio en la vesícula ótica 27, 29 (del oído) de los primeros peces. Usted sabrá una vez que haya movido la aguja en el pescado, porque cuando se presiona el interruptor de pie (Applied Scientific Instruments), el ventrículo cerebro posterior se levante un poco.
- Pulse el interruptor de pie (Applied Scientific Instruments) y ver que el líquido se dispersan en el interior posterior del cerebro de los peces del ventrículo 27. Retirar la aguja de los peces y los peces se mueven a la siguiente. Repita el procedimiento hasta que se ha inyectado todo el pescado en el plato. Retire cualquier dead peces e inyectar reemplazos para mantener el número correcto (50 peces). Para cada grupo de 50 peces inyecta una aguja de microinyección nueva debe estar preparado, o C, el albicans se asienta en la parte inferior de la aguja y obstruye, o lanza de la concentración inyectada.
- Lave el pescado fuera del plato se coloca la fuente y rociar agua sobre los huevos de los peces en un recipiente limpio plato extra profunda de Petri que contiene 60 ml de huevo y agua. Es importante no dejar el pescado en la agarosa durante más de 15-20 minutos o se sequen y mueran.
- Repita todo el proceso de inyección hasta que termine. No te olvides de PBS y no patógenas controles inyectados.
- Cuando haya terminado, mantener el pescado a 28 ° C.
- Cierre la válvula del tanque de nitrógeno. Mueva el interruptor de la unidad de inyección de "pulso" a la "continua" para aliviar la presión en el conducto del tanque, la presión debe caer a cero en este punto. Cambiar la unidad de inyección de nuevo a "pulso". Apague la unidad de inyección y limpiar el área de trabajo.
4. Preparación del pescado de la Imagen
Experimental duración: ** (30 minutos)
Grado de dificultad: **
- Preparar metano sulfonato tricaína solución como antes (200 mg / mL). ¡Fuera los peces infectados, y transferirlos a tricaína.
- Preparar 47,9 ml 0,4% de agarosa de bajo punto de fusión (VWR Scientific) en el huevo y agua. Calentar la solución en el microondas. Enfriar a 37 ° C y añadir metano sulfonato tricaína (200 mg / mL) a la mezcla de
- Una vez que los peces se inmovilizan en metano sulfonato tricaína, pescado pipeta individual en una placa de Petri (VWR Scientific) que contenía 0,4% de agarosa de baja fusión (VWR Scientific).
- A continuación, desplace el pescado de agarosa de bajo masa fundida en pocillos individuales de una placa de fondo de cristal (MatTek Corporation) para la imagen. El uso tan poco agarosa de bajo fundido como sea posible para los peces descansa plana sobre la parte inferior de la cápsula. Sólo utilizar suficiente de la tricaína-agarosa para llenar el enner los círculos del plato con fondo de cristal.
5. Modificaciones relacionadas con Júpiter Protocolos
Micropipetas para la microinyección
Experimental Duración: * (10-15 minutos)
Grado de dificultad: *
- Tire de las barras huecas de vidrio BF120-69-10 (Sutter Instruments) con un extractor de Flaming Brown Micropipeta Modelo P-97 (Sutter Instruments) de acuerdo con Yuan et al. 30. Elija el programa # 7 con el calor las condiciones siguientes = 470, Velocidad = 120, Tiempo = 200. La aguja resultante es de 8 mm de bisel a la punta y, una vez cortado a 3 mm por encima de la punta tiene un diámetro de aproximadamente 10 micras.
- Cargar una micropipeta de vidrio en los soportes. Seleccione "Pull". El filamento de calentamiento se calienta la aguja de acuerdo con los parámetros del programa y la varilla de vidrio se separan en dos micropipetas tirados. Micropipetas guardarla en una caja de almacenamiento de la pipeta (Sutter instrumentos).
Recogida de embriones, inyección Morpholino y mantenimiento
Experimental Duración: *** (1-2 horas)
Grado de dificultad: ***
- Recoger embriones de acuerdo con los métodos de Rosen et al. 31. Use un colador de plástico (Mercancías de Knutsford) para recoger huevos de el tanque de desove (hábitats acuáticos). Sostenga el tamiz boca abajo sobre una placa de Petri de profundidad extra y enjuague con agua el tanque para recoger los huevos.
- Para la preparación de morfolino, añadir 300 l de agua estéril a 300 nanomoles de morfolino (GeneTools, LLC). Esto da un stock de trabajo de 1,0 mM.
- Comprobar la concentración de la morfolino mediante un Nanodrop (Thermo Scientific). Seleccione "ácido nucleico y cambiar el tipo de muestra a" otros "y longitud de onda a 265. Introducir la constante multiplicando el peso molecular del morfolino por 1000 dividido por el absorptivitcoeficiente y que figuran en la hoja de propiedades morpholino oligo.
- En blanco el NanoDrop con 2 l de HCl 0,1 N. Diluir 5 l de la solución morfolino en 95 l de HCl 0,1 N (20x dilución). Coloque 2 l de la dilución en el pedestal y la medida nanodrop clic. Multiplicar la concentración por el factor de dilución (20). Esto da una concentración de trabajo de morfolino. Para calcular la concentración milimolar dividir la concentración obtenida por el peso molecular del morfolino.
- Preparar un stock de trabajo de morfolino en Danieau tampón (58 mM de NaCl, 0,7 mM de KCl, 0,4 mM de MgSO 4, 0,6 mM de Ca (NO 3) 2, 5,0 mM de HEPES, pH 7,6) y 0,01% de rojo fenol (VWR Scientific).
- Para el trabajo de inyección morfolino seguir el protocolo de acuerdo con Rosen et al. 31 y Yuan y col. 30. Enjuague los platos con huevo morpholino de inyección de agua y caliente a 28 ° C durante 15 minutos. Elimine el agua de los platos de inyección y un line-up-cembriones ell etapa en las ranuras del plato de inyección (preparado a partir de la sección 1) con una pipeta de transferencia. Cada placa tiene capacidad para aproximadamente 250 huevos. Inyectar 1-2 embriones en estado de celulares con morfolino. Los huevos se mantendrán en la etapa uno de células durante 15 minutos 27.
- Lavar los huevos inyectados con huevo de agua cuando haya terminado (de agua desionizada estéril con 60 mg / L de sales de Instant Ocean) y colocarlo en 60 ml de huevos de agua en los platos de Petri de profundidad. Platos Morpholino de inyección pueden ser reutilizados. Enjuague con agua de huevo cuando haya terminado y almacenar invertido a 4 ° C.
- Para el almacenamiento de embriones Añadir 60 ml de agua de huevos al plato. Contar en 110 embriones con una pipeta de transferencia en una cápsula de Petri adicionales de profundidad con 60 ml de huevo y agua. Añadir 0,00003% de azul de metileno para prevenir el crecimiento microbiano y los embriones se incuban a 28 ° C.
- Para acelerar el desarrollo de los embriones de mantener los platos de embriones a los 33 ° C durante 24 horas y la etapa de acuerdo a Kimmel et al. 27, que permite el desarrollo de los embriones a un punto críticotronco ángulo de 75 ° (25 Prim etapa 27).
- Para el trabajo de la infección por larvas de mantener a los embriones a 28 ° C después de la inyección con C. albicans.
- Cada día reemplazar a los platos de embriones con 60 ml de agua fresca de huevo.
Imágenes
Experimental Duración: ***** (1-5 horas)
Grado de dificultad: ***
- Preparar los peces en agarosa de bajo derretimiento (de acuerdo con la sección 4.2) con tricaína en platos de cristal de imagen de fondo (MatTek Corporation) como se describió anteriormente. Coloque el plato en una Olympus IX-81 (Olympus) platina del microscopio invertido. Traiga a los peces en el foco bajo magnificación de 4x con contraste de interferencia diferencial (DIC) de luz. Las imágenes pueden capturarse a 20x 4x, y 40x en la DIC, TRITC (isotiocianato de tetrametil rodamina) y FITC (isotiocianato de fluoresceína) la configuración del filtro.
- Utilice una Olympus IX-81 microscopio invertido con un FV-1000 barrido láser confocal de sistema de acuerdo con Ariga et al. 32. Llevar a cabo cursos de tiempo con un aumento de 40x mediante el establecimiento de Z-series con rodajas de 1-1,5 micras cada hora de la infección.
- Para imágenes de larga evolución en el tiempo de 2 horas o más, coloque una capa de agarosa de baja fusión en la parte superior del pescado en el plato de imagen cada 2-3 horas. Esto evita que la agarosa de la desecación y trituración de los peces mientras se va a examinar. Para los cursos de tiempo prolongados con un pequeño número de peces, utilice una etapa calentada (Bioptechs Inc.) para mantener 28 ° C durante las infecciones.
6. Los resultados representativos
Un ejemplo de un éxito rombencéfalo ventrículo C. albicans en una larva de pez cebra en 5 horas después de la infección-(HPI) y HPI 24 se muestra en (Figura 1). Como los macrófagos-células con envolvió C. albicans se ven en el ventrículo posterior del cerebro a las 5 hpi. Al 24 hpi, C. albicans se encuentra dentro de los macrófagos-célulass en el tejido dorsal de la cola indicativo de candidiasis diseminada. Este resultado infección es altamente dependiente de una inyección precisa de 10-15 levadura forma C. albicans en el ventrículo posterior del cerebro. Proyección de los peces infectados inmediatamente después de la inyección puede asegurar esto.
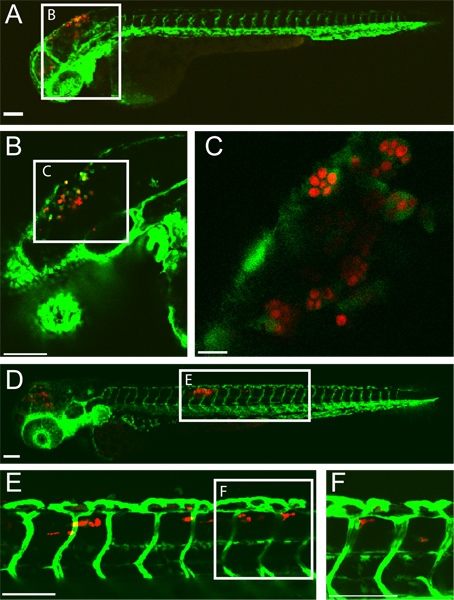
Figura 1 FLI1 transgénico:. EGFP 22, 33 larvas infectadas con CaF2-yCherry Candida albicans y la imagen intravitally por microscopía confocal. (CA) 5 horas después de la infección-(A) larva infectada con EGFP-expresión de los macrófagos-células en el sitio de la infección (rombencéfalo ventrículo) Barra de escala = 100 micras. (B y C) Las imágenes de mayor ampliación de los mismos peces, mostrando C. albicans, dentro de los fagocitos. Barra de escala = 100 m para B y 10 micras de C. (DF) 24 horas después de la infección (D) larva infectada con candidiasis diseminada con CaF2-yCherry C. albicans en el interior EGFP macrophage-como las células en el tejido dorsal de la cola. Barras de escala = 100 micras. (E y F) Las imágenes de mayor ampliación de los mismos peces, mostrando C. albicans en el tejido de la cola. Barras de escala = 100 micras.
Discusión
El método de la microinyección de pez cebra que aquí se presenta se diferencia de Gutzman et al. 34 en que aquí se demuestra la inyección a través de la vesícula ótica en el ventrículo posterior del cerebro de 36 a 48 larvas de HPF. El método que permite describir para inyección consistente de 10-15 levadura en el ventrículo rombencéfalo con daño tisular reducida. Este protocolo produce una infección local que inicialmente se extiende por todo el cuerpo en un 24 hpi (Figura 1)<...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer al laboratorio de la Dra. Carol Kim para la formación de microinyección, Clarissa Henry para el asesoramiento relativo a la aceleración el desarrollo del embrión y el uso de los equipos, y Nathan Lawson para contribuir FLI1: peces EGFP. Damos las gracias a los miembros del laboratorio Wheeler y Shawn Paredes para la lectura crítica del manuscrito. También nos gustaría agradecer a Mark Nilan para el cuidado de los peces y el asesoramiento, y Ryan Phennicie y Gabor Cristina de asesoramiento técnico sobre este proyecto. Este trabajo fue financiado por una ayudantía de investigación MAFES a los hermanos K., MAFES Hatch subvención E08913-08, y un premio de los NIH CNRR P20RR016463 a R. Wheeler.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Los tanques de desove | Los hábitats acuáticos | 2L | |
| 1,7 ml tubos | Axygen | MCT-175-C | |
| Instant Ocean | Fisher Scientific | S17957C | |
| Adicionales de profundidad placas de Petri | Fisher Scientific | 08 a 757-11Z | |
| Standard placas de Petri | VWR Scientific | 25384-302 | |
| Pipetas de transferencia | Fisher Scientific | 13-711-7M | |
| Extracto de levadura | VWR ScientiFIC | 90000-726 | |
| Peptona | VWR Scientific | 90000-264 | |
| Dextrosa | Fisher Scientific | D16-1 | |
| Agar | VWR Scientific | 90000-760 | |
| Hemocitómetro desechable | VWR Scientific | 82030-468 | |
| Tampón fosfato salino | VWR Scientific | 12001-986 | |
| Dumont Dumoxel Pinzas | VWR Scientific | 100501-806 | |
| Clavijas de madera | VWR Scientific | 10805-018 | |
| Kimwipes | VWR Scientific | 300053-964 | |
| Bajo DerretirAgarosa | VWR Scientific | 12001-722 | |
| Agarosa para los platos de inyección | VWR Scientific | 12002-102 | |
| Flaming Brown Micropipeta Extractor | Sutter Instruments | P-97 | |
| Varillas de vidrio huecas | Sutter Instruments | BF120-69-10 | Para varillas de vidrio de cristal liso por calentamiento sobre mechero de Bunsen |
| Caja de almacenaje con una pipeta | Sutter Instruments | BX10 | |
| MPPI-3 Sistema de inyección | Instrumentación Científica Aplicada | MPPI-3 | |
| Unidad de presión de retorno | Instrumentación Científica Aplicada | BPU | |
| Micropipeta kit de soporte para | Aplicacionesed Instrumentación Científica | MPIP | |
| Interruptor de pie | Instrumentación Científica Aplicada | FSW | |
| Micromanipulador | Instrumentación Científica Aplicada | MM33 | |
| Base magnética | Instrumentación Científica Aplicada | Base magnética | |
| Tricaína metano sulfonato | Occidental Chemical Inc. | MS-222 | |
| La disección de Alcance | Olimpo | SZ61 arriba SZX-ILLB2-100 de base | |
| Microscopio Confocal | Olimpo | IX-81 con FV-1000 Sistema láser confocal de barrido | |
| TC-7 Cultivo de Tejidos de rodillos de tambor de la rueda con 14 pulgadas de tubo de ensayo | New Brunswick Scientific | TC-7 | |
| Platos de imagen | MatTek Corporación | P24G-1.0-10-F | |
| Puntas de pipeta para la carga de agujas | Eppendorf | 930001007 | |
| Placa de vertido redes | De adaptación de la ciencia Herramientas | TU-1 | |
| Etapa climatizada | Bioptechs Inc. | Delta T-5 | |
| Espátula plana | VWR Scientific | 82027-486 | |
| Los tamices de plástico | Mercancías de Knutsford en línea | 12 cm | |
| Parafilm | VWR Scientific | 52858-000 | |
| Vortex Genie | VWR Scientific | 14216-184 | |
| 16 x 150 mm tubos de Cultura | VWR Scientific | 60825-435 | |
| Nanodrop | Thermo Scientific | ND 2000 | |
| Rojo fenol | VWR Scientific | 97062-478 | |
| De HCl | VWR Scientific | 87003-216 | |
| NaCl | VWR Scientific | BDH4534-500GP | |
| KCl | VWR Scientific | BDH4532-500GP | |
| MgSO 4 | VWR Scientific | BDH0246-500GP | |
| Ca (NO 3) 2 | VWR Scientific | BDH0226-500GP | |
| HEPES | VWR Scientific | BDH4520-500GP | |
| Morpholinos | GeneTools, LLC |
Referencias
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados