Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Procedimiento para la fabricación de nanofibras Biofuncionales
En este artículo
Resumen
Un enfoque eficaz para la preparación de nanofibras decoradas con grupos funcionales capaces de interactuar específicamente con proteínas se describe. El primer enfoque requiere la preparación de un polímero funcionalizado con el grupo funcional apropiado. El polímero funcional se fabrica en nanofibras por electrohilado. La eficacia de la unión de las nanofibras con una proteína se estudió por microscopía confocal.
Resumen
Electrospinning es un método de tratamiento eficaz para la preparación de nanofibras decoradas con grupos funcionales. Nanofibras decoradas con grupos funcionales pueden ser utilizados para estudiar las interacciones de biomarcadores material-es decir, actúan como biosensores con potencial como detectores de una sola molécula. Hemos desarrollado un método eficaz para preparar polímeros funcionales donde la funcionalidad tiene la capacidad de unirse específicamente con una proteína modelo. En nuestro sistema de modelo, el grupo funcional es 2,4-dinitrofenilo (DNP) y la proteína es anti-DNP IgE (inmunoglobulina E). El polímero funcional, α, ω-bi [2,4-dinitrofenilo caproico] [poli (óxido de etileno)-b-poli (2-metoxiestireno)-b-poli (óxido de etileno)] (CDNP-PEO-P2MS-PEO- CDNP), se prepara por polimerización aniónica viviente. El iniciador difuncional utilizado en la polimerización se preparó por reacción de transferencia de electrones de α-metilestireno y metal de potasio (espejo). El monómero 2-metoxiestireno se añadióprimero al iniciador, seguido de la adición del segundo monómero, óxido de etileno, y finalmente el polímero vivo se terminó por metanol. La α, ω-dihidroxilo polímero [HO-PEO-P2MS-PEO-OH] se hizo reaccionar con ácido caproico N-2 ,4-DNP-∈-amino, por acoplamiento de DCC, resultando en la formación de α, ω-bi [ 2,4-dinitrophenylcaproic] [poli (óxido de etileno)-b-poli (2-metoxiestireno)-b-poli (óxido de etileno)] (CDNP-PEO-P2MS-PEO-CDNP). Los polímeros se caracterizaron por FT-IR, 1 H RMN y cromatografía de permeación en gel (GPC). Las distribuciones de pesos moleculares de los polímeros eran estrechas (01.01 a 01.02) y los polímeros con pesos moleculares mayores que 50.000 se utilizó en este estudio. Los polímeros fueron polvo de color amarillo y soluble en tetrahidrofurano. A soluble en agua CDNP-PEO-P2MS-PEO-CDNP / DMEG (glicol dimetoxietileno) complejo se une y alcanza el estado de equilibrio de unión con una solución de IgE en unos pocos segundos. Mayor peso molecular (es decir, insoluble en agua, alrededor de 50.000) CDNP-PEO-P2MS-PEO-CDNP polímeros, que contienen 1% nanotubos de carbono de pared única (SWCNT) se procesaron en nanofibras electroactivos (100 nm a 500 nm de diámetro) sobre el sustrato de silicio. Espectroscopia de fluorescencia muestra que el anti-DNP IgE interactúa con las nanofibras mediante la unión con los grupos funcionales DNP decoración de las fibras. Estas observaciones sugieren que las nanofibras adecuadamente funcionalizados mantienen la promesa para el desarrollo de dispositivo de detección de biomarcadores.
Protocolo
1. Síntesis de α, ω-dihidroxilo Polímero [HO-PEO-P2MS-PEO-OH]
- Montar reactor de polimerización, como se muestra en la figura 1. El reactor de este experimento son una parte inferior 100 ml redondo de 2 bocas que tiene un conjunto estándar de conicidad exterior (ChemGlass), dos adaptadores de control de flujo con llaves de paso (ChemGlass), y una varilla de agitación de teflón. Adaptador A (Figura 1) se utiliza para mantener de ultra alta pureza (UHP) de nitrógeno que fluye a través del sistema con el fin de evitar que el aire y la humedad entren en el sistema inerte. Adaptador B (Figura 1) se utiliza para inyectar el monómero de disolvente, y el iniciador en el matraz de reacción.
- Secar 200 ml de tetrahidrofurano (THF) sobre el metal Na, usando benzofenona como indicador, durante un mínimo de 6 h bajo gas nitrógeno seco.
- Secar 10 ml de 2-metoxiestireno sobre hidruro de calcio durante 24 horas.
- Preparar un baño de temperatura fría mantenida a -78 ° C utilizando una suspensión de isopropanol unand nitrógeno líquido.
- Añadir 25 ml de THF en el matraz de reacción de polimerización (véase la Figura 1) en gas nitrógeno y mantener reactor bajo gas nitrógeno durante toda la polimerización.
- Colocar 100 ml matraz de fondo redondo en suspensión.
- Añadir 2 ml (0,27 mmol / ml) de la solución de iniciador en el matraz de reacción.
- Inyectar el primer monómero, 2-metoxiestireno (4 ml) al matraz de reacción.
- La reacción se deja proceder durante 40 min.
- Añadir 1 ml del segundo monómero, óxido de etileno.
- Permitir la polimerización para continuar a temperatura ambiente durante dos días.
- Terminar el polímero con HCl (6 M) / metanol (1/20, vol / vol).
- Se purifica el polímero por precipitación en hexanos y el polímero seco en un horno de vacío.
- Caracterizar el polímero mediante RMN.
2. La funcionalización de α, ω-dihidroxilo polímero con ácido caproico N-2 ,4-DNP-Ε-amino para obtener el Polym Functionaler, CDNP-PEO-P2MS-PEO-CDNP
- En un matraz de tres bocas, colocar el α, ω-dihidroxilo polímero (0,05 mmol), el ácido caproico N-2 ,4-DNP-E-amino (0,25 mmol), DCC (0,15 mmol) y DMAP (0,005 mmol) y secar en línea de vacío durante 4 horas.
- Destilar diclorometano seco (10 ml) en el matraz.
- Liberar el vacío en atmósfera de nitrógeno y se agita la reacción durante 12 horas a temperatura ambiente.
- Filtrar mezcla de reacción y recuperar polímero por precipitación dos veces en hexanos y metanol.
- Dry precipitó polímero en un horno de vacío a 40 ° C.
- Determinar la estructura del polímero y la funcionalidad por FT-IR y 1 H RMN.
3. Preparación de la solución para CDNP-PEO-P2MS-PEO-CDNP/SWCNT Electrospinning
- Disolver 20% w de CDNP-PEO-P2MS-PEO-CDNP en clorobenceno.
- Disolver 20% y el 40% w w de poliestireno (MW 800.000) en clorobenceno para preparar dos soluciones. El poliestireno molecular más alto se utiliza para cada veze polímero de cadena de cadena de enredado y obtener la viscosidad óptima requerida para electrospinning.
- Mezclar las soluciones poliméricas preparadas en 3,1 y 3,2 para formar 1:1 y 1:2 proporciones de los polímeros y añadir 1% en peso nanotubos de carbono (SWCNT) a la mezcla y se agita durante la noche para la distribución uniforme de los CNT.
4. Electrospinning de Polymer-CNT compuesto
- Montar el electrospinning configura como se muestra en la Figura 2. En el lado derecho de la figura es la fuente de alto voltaje Glassman. Junto a él es un soporte de retorta en la que se adjunta la oblea de silicio. A la izquierda hay otro soporte vertical sobre el que se monta la jeringa y detrás de ella es la lámpara para visualizar el procedimiento de medida que avanza.
- Usando una jeringa hipodérmica, retirar una pequeña cantidad de la mezcla CDNP-PEO-P2MS-PEO-CDNP/polystyrene/SWCNT (aproximadamente 1 ml) y montar la jeringa hipodérmica en el soporte de retorta.
- Una oblea de silicio es el monteed a través de la jeringa de forma segura a una distancia de 10 cm, y el clip de tierra de la fuente de alta tensión está unida a él.
- Coloque el clip teniendo la alta tensión que se aplica a la aguja en la jeringa, el émbolo un poco (para suspender una gota en la punta de la aguja) y en este punto, electrospinning está listo.
- Alimentación de la fuente de alta tensión y ajustar la tensión de metro a 10 kV. Dependiendo de la naturaleza de los polímeros en el material compuesto, voltajes más altos puede ser necesario, especialmente si nanofibras de menos de cien nanómetros de diámetro se desea.
- Oblea de silicio Desmontar y colocar en un desecador durante la noche se seque por completo.
5. Caracterización de nanofibras
- La imagen inicial de nanofibras se realiza con microscopio óptico para observar la perspectiva global de las fibras.
- Utilizar microscopio electrónico de barrido para observar detalles finos, como morfología, diámetro, tamaño de poro medio, etc
- Llevarcabo de imágenes aún más con un Microscopio de Fuerza Atómica para observar 3-D topografía de fibras, etc
6. Especificidad de unión de nanofibras con anti-IgE DNP Protein
- Preparar una solución de 4 ug / l marcada con fluorescencia, FITC-IgE (fluoresceína Isothio-cianato-Inmunoglobulina E) en PBS-BSA (tampón fosfato salino-Albúmina de Suero Bovino) solución.
- Colocar un pequeño trozo de oblea de silicio sobre los que hay nanofibras sobre un cubreobjetos de MatTek bien. Incubar las nanofibras en esta solución durante una hora. La incubación es efectuada pipeteando suavemente hacia fuera, 10 ul solución IgE sobre la oblea de silicio.
- Después de la incubación, retirar IgE no unido mediante lavado de la muestra tres veces con la solución tampón PBS-BSA. La solución de PBS se dispensa suavemente en la pared de la cápsula MatTek, a fin de evitar el tampón de chorros directamente sobre las nanofibras. Agitar la placa suavemente con la mano, para distribuir la solución tampón en nanofibras. Retire cuidadosamente tampón con una pipeta y reTurba esto dos veces más.
- Para el control, se incuba nanofibras en marcado con fluorescencia IgG (no específico para DNP) en las mismas condiciones.
- Visualizar las fibras unidas con un microscopio confocal para observar la unión con la IgE. Para nuestro estudio, el microscopio confocal Leica utilizado fue TCS SP2 con 63x lente.
7. Corriente-tensión Comportamiento de nanofibras
- Conecte dos posicionadores micro a una fuente de corriente muy baja, como el Keithley 6430 SourceMeter sensible. El establecido para la determinación del comportamiento de la tensión actual se muestra en la Figura 3. Esta figura muestra la estación de la sonda utilizada para determinar las características iniciales IV de las nanofibras. Se compone de la Bausch and Lomb Microscopio MicroZoom, una etapa de vacío Chuck, y cuatro Micropositioners utilizados en el sondeo. En la parte superior derecha está el Agilent 34405A Multímetro digital utilizado en la medición de la tensión y por debajo es que la Keithley 6430 Sub-Femtoamp Meter Fuente remoto utilizado para la fuente de las bajas corrientes de entrada que eran en las fibras.
- Montar los brazos de la sonda de los posicionadores micro sobre la estera de fibra en lados opuestos con las puntas que tocan las fibras.
- Conecte otros dos posicionadores micro a un multímetro digital, montar los brazos de la sonda en el medio de los otros dos y aterrizar los consejos sobre la estera de fibra. Asegúrese de que las cuatro extremidades son colineales como posible.
- Entrada de cantidades variables de corriente a partir de la Keithley (típicamente en el intervalo nanoamps).
- Medir la caída de voltaje a través de las puntas exteriores, para cada magnitud de corriente suministrada.
- Trazado de estos valores indican el tipo de dispositivo de la estera de fibra actúa como.
8. Los resultados representativos
Polímero con funcionalidad
"> El método para la síntesis de α, ω-bi [2,4-dinitrofenilo caproico] [poli (óxido de etileno)-b-poli (2-metoxiestireno)-b-poli (óxido de etileno)] (CDNP-PEO- P2MS-PEO-CDNP) se muestra en la Figura 4. 1 La estructura del polímero funcional fue confirmada por FT-IR (Figura 5) y 500 MHz 1 H espectroscopía de RMN (Figura 6). El FT-IR muestra la desaparición completa de los el-OH de absorción ancha que alrededor de 3.500 cm -1 indicando funcionalización cuantitativa con el grupo CDNP. Esto también se confirma por el espectro de RMN muestra en la Figura 6. Uso de la integración de los picos en el espectro de RMN, se determinó que la CDNP-PEO polímeros-P2MS-PEO-CDNP están cuantitativamente funcionalizado.Nanofibras
En la Figura 7, una estera de nanofibras conductoras obtenidas por electrohilado CDNP-PEO-P2MS-PEO-CDNP / poliestireno / SWCNT de clorobenceno es shpropia. Confocal de imágenes obtenidos mostraron que la proteína IgE se une con el DNP en la superficie de la fibra. 3 Esta es una indicación de la especificidad de la unión de electrohiladas DNP-polímeros hacia anticuerpo IgE. La intensidad de la luz es un indicador de la presencia de IgE en las nanofibras como la proteína está marcado con fluorescencia.
La Figura 8a es un AFM (microscopio de fuerza atómica) imagen de una de las nanofibras obtenidas por este proceso y la Figura 8b muestra la dimensión de este nanofibras particular, es de alrededor de 150 nm de diámetro. Mediante este proceso las fibras entre 100-700 nm se obtienen. En esta época actual es un reto para preparar fibras con una dimensión específica. Esto es consistente con lo observado por otros grupos. 4 La Figura 9 muestra imágenes de SEM de CDNP-PEO-P2MS-PEO-CDNP / poliestireno / SWCNT nanofibras y el diámetro de las nanofibras eran entre 200 nm a 300 nm. Hay tres SEM imágenes de nanofibers muestra a diferentes aumentos. Estudio de las tres imágenes muestra la morfología de las fibras son lineales y en perlas. El objetivo general es preparar fibras que son en su mayoría lineal. Figura 10 muestra el gráfico IV de esteras de nanofibras preparados a partir de CDNP-PEO-P2MS-PEO-CDNP / poliestireno / SWCNT. La gráfica muestra el comportamiento de una resistencia (óhmica). Cuando el antígeno se une a las nanofibras, se espera ver un cambio en el comportamiento IV de la estera de fibra que este cambio de resistencia es una característica que sugiere que las fibras funcionales tienen aplicación potencial como el componente activo en sensores para detección de moléculas individuales .
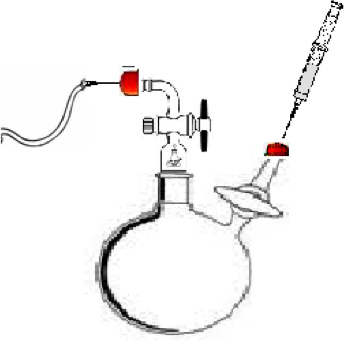
Figura 1. Reactor de polimerización para la síntesis de la α, ω-dihidroxilo polímero. A) El punto de inyección para el flujo de gas nitrógeno UHP. B.) del punto de inyección para el disolvente, el monómero y el iniciador. C) El recipiente de reacción.

Figura 2. Configuración utilizada para electrospinning usando una fuente de alta tensión Glassman.

Figura 3. Configuración utilizada para medir parcelas IV utilizando una Sub-femtoamp remoto SourceMeter (Keithley).
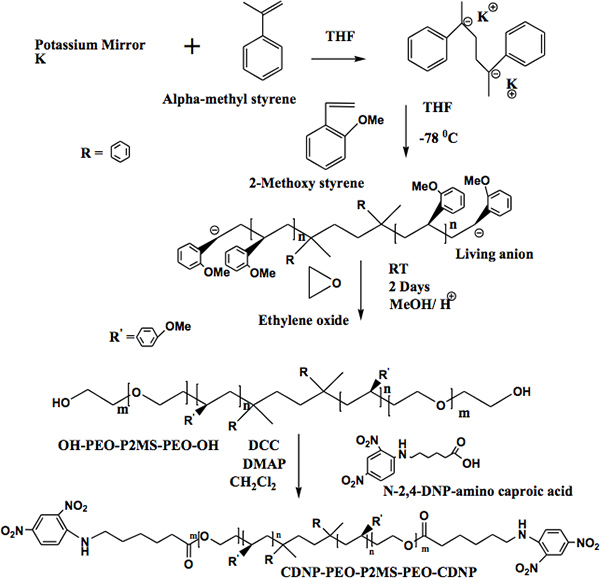
Figura 4. Un enfoque). Sintético para la preparación de los OH-PEO-P2MS-PEO-OH polímeros. B) La funcionalización de α, ω-dihidroxi [poli (óxido de etileno)-b-poli (2-metoxiestireno)-b-poli (óxido de etileno)].
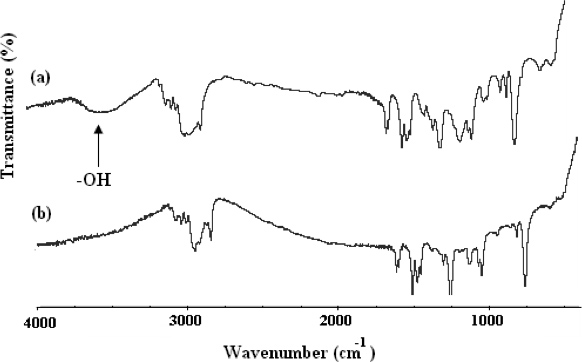
Figura 5. Espectros FT-IR de (A) OH-PEO-P2MS-PEO-OH, precursor de CDNP-PEO-P2MS-PEO-CDNP y (B) CDNP-PEO-P2MS-PEO-CDNP.

Figura 6. 500 MHz RMN de protón de CDNP-PEO-P2MS-PEO-CDNP.
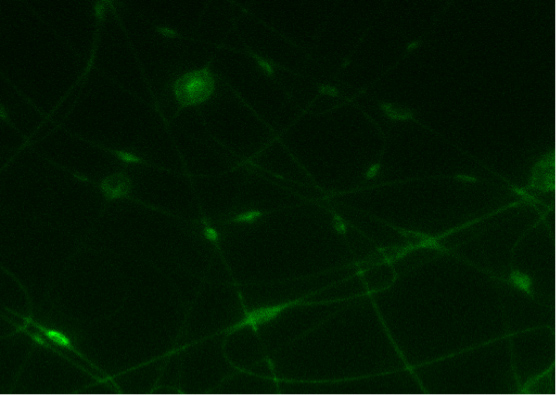
Figura 7. Una imagen) La unión de FITC-IgE con CDNP-PEO-P2MS-PEO-CDNP fibras electrospun de clorobenceno. B) Imagen de microscopia confocal del control (nanofibras con IgG).

Figura 8. A) Imagen AFM de CDNP-PEO-P2MS-PEO-CDNP fibras electrohiladas de clorobenceno y B) AFM perfil dimensión es decir, de una fibra se muestra en la Figura 5a.

Figura 9. Imágenes de SEM de CDNP-PEO-P2MS-PEO-CDNP / poliestireno / SWCNT nanofibras.
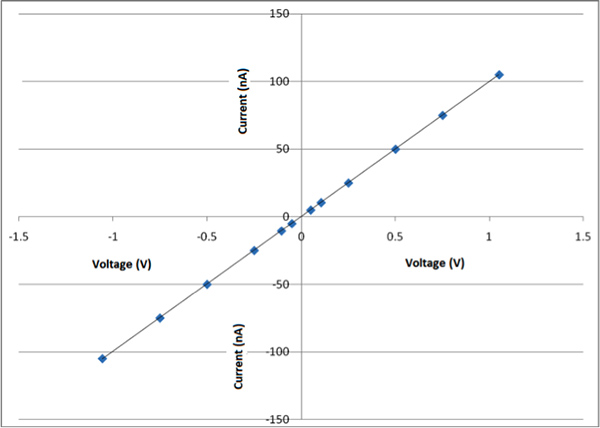
Figura 10. Complot IV de esteras de nanofibras preparados a partir de CDNP-PEO-P2MS-PEO-CDNP / poliestireno / SWCNT.
Discusión
En este informe, hemos presentado un enfoque poderoso para la preparación de nanofibras biofuncionales. Las nanofibras están decoradas con un grupo funcional que es específico de una proteína modelo. El procedimiento y el enfoque reportada en esta comunicación es de naturaleza general y puede ser utilizado para preparar nanofibras decoradas con cualquier grupo funcional deseado. La polimerización aniónica viviente es poderoso método para sintetizar estructuras poliméricas controladas covalentemente conectados a...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por NSF HRD-0630456, un programa de CREST NSF y NSF es DMR-0934142.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| Sodio metálico | Sigma-Aldrich | 282065 | |
| Benzofenona | Sigma-Aldrich | 239852 | |
| 2-metoxiestireno | Sigma-Aldrich | 563064 | |
| Tetrahidrofurano | Sigma-Aldrich | 178810 | |
| El clorobenceno | Sigma-Aldrich | 319996 | |
| Single CNT paredes | Sigma-Aldrich | 704113 | |
| Poliestireno | Sigma-Aldrich | 81416 | |
| Obleas de silicio | Silicio Misión Internacional | 720200 | |
| Zeiss FESEM | Carl Zeiss Inc. | Ultra 60 | |
| Probestation con Bausch & Lomb MicroZoom II Microscopio de Alto Rendimiento | Bausch y Lomb | ||
| De exploración confocal Leica System | Leica Microsystems | TCS SP2 | |
| Sub-femtoamp SourceMeter remoto | Keithley Instruments | 6430 | |
| Multímetro digital de rango automático | Keithley Instruments | 175A | |
| Syringe Pump | Chemyx Inc. | Fusion 200 | |
| Zeiss Microscopio Óptico | Carl Zeiss Inc. | Zeiss / Axiotech |
Referencias
- Sannigrahi, B., Sil, D. Synthesis and Characterization of α,ω-bi[2,4-dinitrophenyl (DNP)] poly(2-methoxystyrene) Functional Polymers. Preliminary Evaluation of the Interaction of the Functional Polymers with RBL Mast Cells. Journal of Macromolecular Science, Part A. 45, 664-671 (2008).
- Gordon, K., Sannigrahi, B. Synthesis of Optically Active Helical Poly(2-methoxystyrene). Enhancement of HeLa and Osteoblast Cell Growth on Optically Active Helical Poly(2-methoxystyrene) Surfaces. Journal of Biomaterials Science. 2, 2055-2072 (2009).
- Baird, E. J., Holowka, D. Highly Effective Poly(Ethylene Glycol) Architectures for Specific Inhibition of Immune Receptor Activation. Biochemistry. 2, 12739-12748 (2003).
- Ramakrisna, S., Fugihara, K., Lim, W. -. E., Ma, Z. . Introductions to Electrospinning and Nanofibers. , (2005).
- Kameoka, J., Craighead, H. G. Fabrication of Oriented Polymeric Nanofibers on Planar Surfaces by Electrospinning. Applied Physics Letters. 83, 371-3773 (2003).
- Ramakrishna, S., Lala, N. L. Polymer Nanofibers for Biosensor Applications. Topics in Applied Physics. 109, 377-392 (2007).
- Reuven, D., Sil, D. Archetypical Conductive Polymer Structure for Specific Interaction with Proteins. Journal of Macromolecular Science Part A: Pure and Applied Chemistry. , (2012).
- Ogunro, O., Karunwi, K. Chiral Asymmetry of Helical Polymer Nanowire. The Journal of Physical Chemistry Letters. 1, 704-707 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados