Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La reparación de un modelo de defecto crítico del tamaño de calota Uso adiposo derivados de las células del estroma cosechadas desde lipoaspirado
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe el aislamiento de tejido adiposo derivado de células estromales de lipoaspirado y la creación de un 4 mm de tamaño crítico defecto craneal para evaluar la regeneración esquelética.
Resumen
Reparación y regeneración del esqueleto craneofacial ofrece la promesa de la formación de tejido de novo a través de un enfoque basado en células utilizando células madre. Derivadas de tejido adiposo células del estroma (ASCs) han demostrado ser una fuente abundante de células madre multipotentes capaces de experimentar diferenciación osteogénica, condrogénicos, adipogénicos, y miogénica. Muchos estudios han explorado el potencial osteogénico de estas células in vivo con el uso de biomateriales andamios diferentes para la entrega celular. Se ha demostrado que mediante la utilización de un osteoconductivos, con recubrimiento de hidroxiapatita poli (láctico-co-glicólico) (PLGA-HA) andamio se sembró con ASC, un defecto de la bóveda craneal de tamaño crítico, un defecto que se define por su incapacidad de someterse espontánea cicatrización durante la vida del animal, se puede mostrar efectivamente la regeneración ósea robusta. Este modelo in vivo demuestra la base de enfoques translacional destinada a regenerar el tejido óseo - el celularcomponente y la matriz biológica. Este método sirve como un modelo para la aplicación clínica final de una célula progenitora hacia la reparación de un defecto específico de tejido.
Protocolo
1. Celda de aislamiento y Expansión
- Todo el consentimiento del paciente y de los protocolos experimentales fueron revisados y aprobados por la Universidad de Stanford Institutional Review Board (Protocolo # 2188 y # 9999).
- Obtención de tejido adiposo subcutáneo humano de los procedimientos electivos bajo lipoaspiración local / anestesia general.
- Habrá dos capas en el lipoaspirado (Figura 1A). El sobrenadante contiene la gran mayoría del material celular procesada. La capa inferior se inyecta solución salina en su mayoría. Adiposo derivado de células estromales se pueden cosechar a partir de cualquiera de las capas, pero el rendimiento es mucho mayor a partir del sobrenadante.
- Para aislar la fracción del estroma vascular (SVF), lavar el lipoaspirado extensamente con volúmenes iguales de 1X tampón fosfato salino (PBS) que contenía 2,5% betadine (x2), seguido por un volumen igual de PBS 1X (x1) sin betadine. Permitir que el lavado a precipitar.
- Tenga cuidado de mantener estéril technique durante todo el proceso ya que la contaminación con el tejido humano procesada puede suceder.
- Aspirar la capa inferior y desechar después de cada lavado.
- Alícuota de 15 ml de tejido adiposo en 50 ml tubos cónicos BD Falcon.
- Se digiere el tejido adiposo con un volumen igual (15 ml) de filtrado 0,075% de colagenasa tipo II en solución salina equilibrada de Hank (HBSS) a 37 ° C en un baño de agua durante 60 min con agitación constante (aprox. 180 sacudidas / min) - ventilar cada tubo cada 15 min.
- Neutralizar la actividad de la enzima con 15 ml de PBS que contenía 10% (suero bovino fetal) FBS, y se centrifuga a 1.000 rpm durante 5 min a 4 ° C para obtener una alta densidad SVF pellet. El sedimento será una mezcla de adiposas derivadas de las células del estroma y eritrocitos.
- Descartar el sobrenadante sin perturbar el sedimento.
- Resuspender el precipitado en 10 ml de medio de crecimiento tradicionales (Eagle modificado de Dulbecco Medium [DMEM] / 10% FBS / 1% de penicilina-estreptomicina solución).
- Filtro de suspensión sión a través de un filtro de células de nylon 100 micras para eliminar los restos celulares.
- Combina 3 tubos a uno limpio cónico de 50 ml. Centrifugar a 1.000 rpm durante 5 min a 4 ° C.
- Descartar el sobrenadante sin perturbar el sedimento.
- Resuspender el sedimento en 5 ml de medio de crecimiento tradicionales
- Combina dos cónicas 50 ml por placa de 10 cm o cinco cónicas 50 ml para una placa de 15 cm.
- Establecer cultivos primarios durante la noche a 37 ° C/21% de O 2, 5% de CO 2.
- Después de la incubación durante la noche, se lavan las placas exhaustivamente con PBS para retirar los residuos de las células no adherentes de sangre rojas. Las poblaciones celulares resultantes son adiposas derivadas de las células del estroma.
- Mantener las células a niveles sub-confluentes para prevenir la diferenciación espontánea a 37 ° C/21% de O 2, 5% de CO 2 en un medio de crecimiento. Las células generalmente se deben dividir cada tres a cuatro días en medios de crecimiento regulares cuando se siembran al 50% de confluencia.
- Los andamios fueron realizadas por el Dr. Min Lee en la Universidad de California, Los Angeles - Escuela de Odontología.
- Andamios de PLGA fueron fabricados de 85/15 poli (láctico-co-glicólico) (viscosidad inherente = 0,61 dl / g, Birmingham Polymers) por moldeo con disolvente y un proceso de lavado de partículas.
- PLGA / cloroformo soluciones se mezclaron con sacarosa 200-300 m de diámetro para obtener 92% de porosidad (fracción de volumen), y se comprimen para formar láminas delgadas en un molde de teflón.
- Después de la liofilización durante la noche, andamios se sumergieron en tres cambios de doble destilada (dd) H 2 O para disolver la sacarosa, y suavemente retiró de la placa de teflón con una espátula de punta fina.
- Después de lavado de partículas, todos los andamios se desinfectaron por inmersión en 50%, 60% y 70% de etanol durante 30 min cada uno, seguido de tres lavados de ddH 2 O.
- Todos los andamios se secaron bajo una campana de flujo laminar.
- Después de Fabricación de la estructura, scaffolds fueron recubiertos con apatita.
- SBF (fluido corporal simulado) Se preparó una solución con concentraciones de iones que eran 5 veces la del plasma sanguíneo humano. Todas las soluciones son estériles filtró a través de una membrana de 0,22 micras PES (Nalgene). Inmediatamente antes de que el proceso de recubrimiento, se secó andamios de PLGA se someten a descarga de resplandor, argón-plasma de grabado (Harrick Scientific) para mejorar la humectación y la uniformidad del recubrimiento.
- Etched andamios de PLGA se incubaron entonces en SBF a 37 ° C dentro de una incubadora con camisa de agua durante 12 horas, seguido de Mg 2 + y HCO 3 - SBF libre 2 por otro hr 12 a 37 ° C bajo agitación suave.
- Andamios recubiertos de PLGA se enjuaga suavemente con estéril ddH 2 O para lavar el exceso de solución de cloruro de sodio, se secó en una campana de flujo laminar y desinfectado con 70% de etanol.
- Integridad del recubrimiento de apatita se analizó con un microscopio electrónico de barrido (SEM). Recubiertos con apatita scaffolds fueron montados en los talones de SEM (Ted Pella) y recubiertos con carbono para mejorar la conductividad. El modo de electrones secundario se aplicó durante SEM (FEI / Phillips XL-30) observación. Dispersión de energía de rayos X del espectro se obtuvo a confirmar la composición elemental de las estructuras de apatito.
3. Siembra Celular
- Al llegar a los niveles de sub-confluencia, se lavan las células con PBS (x2) y Tripsinizar.
- Contar las células para cuantificar para la siembra
- Semilla en precortadas andamios de diámetro 4,0 mm con 1,5 x 10 5 células.
- Lugar individual andamio en un pocillo de una placa de 96 pocillos
- Volver a suspender las células en medio de cultivo regulares con una concentración de aproximadamente 1,5 x 10 5 células por 20 l de medios de comunicación
- Pipetear 20 l directamente sobre el andamio y el lugar en el cultivo celular incubadora durante 30 min.
- Después de 30 min, añadir 200 l de medios de comunicación y permitir que las células se incubanen el andamio durante la noche antes de la cirugía
- No es necesario para asegurar la adhesión de las células en el andamiaje como la siembra de un número suficiente de células se asegurará de que la mayoría se adhieren al andamio. Esto se ha validado en nuestro laboratorio con bioluminiscencia in vivo y análisis histológico.
4. Creación de defectos de calota y la implantación in vivo
- Anesthetize adultos (60 días de edad) CD-1 de ratones desnudos con cóctel anestésico. (Ketamina / xilazina / acepromazina) a 50% de concentración (1:1 dilución con 0,9% de NaCl) o por régimen recomendado anestésico por protocolos de la institución. Estos ratones son atímicos para los hASCs no provocará una reacción inmune.
- Dosificación: El clorhidrato de ketamina (80 mg / kg), xilazina (2,5 mg / kg) acepromazina (2,5 mg / kg)
- Duración de acción: aproximadamente 30 min
- Quirúrgicamente cubrir el animal y esterilizar el quirúrgicositio con Betadine y alcohol (x3) y cubrir los ojos de ratón con pomada antes de hacer una incisión sagital en la línea media del cuero cabelludo del animal para exponer el hueso parietal derecho. Retire el pericráneo del hueso parietal derecho con raspado romo (fig. 1B).
- Crear una unilateral de 4 mm de espesor completo defecto en el derecho no sutura del hueso parietal asociada mediante una estéril con recubrimiento de diamante broca trépano. Debe tener mucho cuidado de no alterar la duramadre subyacente (Figura 1B) como el espesor del ratón calota es <0,3 mm.
- Antes de la implantación, andamios enjuague con PBS estéril para evitar la transferencia de factores de crecimiento derivados de medio.
- Coloque el andamio en el defecto.
- Por último, suturar la piel se cerró y vigilar el animal por los protocolos establecidos postoperatorias.
- Utilice analgesia establecido según las indicaciones de los protocolos de cuidado de los animales, según sea necesario después de la operación-por ejemplo. buprenorfina 0,1 mg / kg.
5. La cuantificación de la formación de osteoide
- Después de MicroCT se realizó en el ratón, la imagen tridimensional fue reconstruido utilizando software MicroView como se ha descrito anteriormente 1.
- Uso de Adobe Photoshop, las imágenes eran de tamaño a una altura normal.
- Con la función Magic Wand, los píxeles se mide el defecto craneal.
- Porcentaje de curación del defecto se determinó mediante posteriores TC medir el área del defecto craneal y determinar el número de píxeles y dividiéndolo por el número de píxeles del defecto original
- Por consiguiente, si el MicroCT no está disponible, una alternativa es usar Adobe Photoshop y cosecha de la bóveda craneal en puntos de tiempo determinados para histología.
- Utilizando tinciones histológicas tales como azul de anilina y Pentacromo que denotan la formación de osteoide, múltiples secciones a lo largo de la duración del defecto debería ser manchado
- Uso de Adobe Photoshop, afloran todas las áreas que no sonen el defecto craneal
- Utilice la función varita mágica y determinar el número de píxeles de la formación de hueso de novo en la zona del defecto y comparar con los controles u otras variables.
6. Los resultados representativos
El tejido adiposo tiene el potencial de servir un papel vital en la generación de células progenitoras para su aplicación clínica. El tejido adiposo tiene una ventaja única en que existe un suministro fácilmente disponible que puede ser recolectada en un procedimiento relativamente simple que implica un mínimo de morbilidad y mortalidad. Una vez que el tejido se recogieron y se recogió, nuestro protocolo se describe en la Figura 2. Adiposas derivadas de las células estromales se aíslan mediante una serie de pasos de lavado, digestión con colagenasa, y la centrifugación. Una vez que las células se sembraron en placas de cultivo, que se puede ampliar, se colocaron en diferentes protocolos de diferenciación in vitro, o se coloca directamente in vivo.
El creación de la 4 mm de tamaño crítico defecto craneal proporciona un fácil acceso y reproducible en modelo in vivo para probar la capacidad de diferenciación osteogénica de nuestros derivadas de tejido adiposo células estromales. Mediante el uso de MicroCT, que son capaces de seguir la formación de tejido esquelético in vivo y el seguimiento del progreso de nuestras intervenciones (Figura 3). El defecto fundamental del calvario de tamaño no se cura dentro de la vida del animal y vemos aproximadamente el 90% de los defectos siguen siendo patente en torno a 8 semanas. El propio andamio (véase la discusión) tiene osteogénicas propiedades inductivas y ha demostrado la capacidad de inducir algunos de regeneración ósea. Los resultados típicos de colocación de andamio sin células muestra que alrededor de un tercio del defecto tendrá de novo la formación de hueso a las 8 semanas. Con el aumento de adiposas derivadas de las células del estroma, completamente dos tercios o más del defecto se muestran en la regeneración ósea alrededor de 8 semanas, aunque hay variability entre cada animal, y la cirugía. La formación de tejido esquelético se puede cuantificar mediante histología y los resultados típicos muestran una mayor formación de osteoide en las muestras con las ASC a través de la tinción de azul de anilina y Pentacromo (Figura 3C). Además, mostramos que las células implantadas humanos contribuyen a la formación de novo subyacente óseo a través del uso de hASCs GFP-etiquetados que muestran tinción in vivo a las 2 semanas cerca de la zona de formación de hueso de novo en el defecto craneal (Figura 3D) . Además, usamos inmunohistoquímica con un anticuerpo específico humano para mostrar la supervivencia de células humanas y contribución en la zona del defecto (Figura 3E).
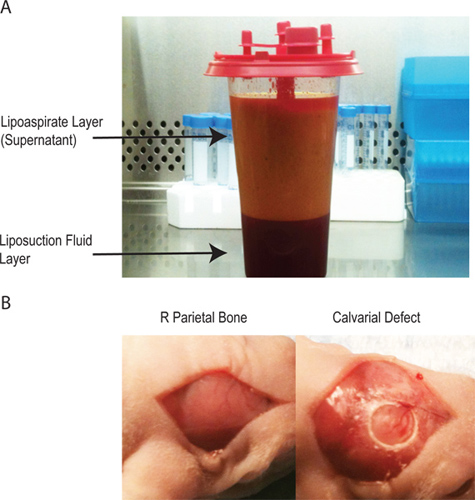
Figura 1 A -. El lipoaspirado tiene dos capas. La capa superior contiene los adipocitos y la mayoría de la processes material celular, mientras que la capa inferior contiene la solución salina utilizada durante el procedimiento lipoaspiración. B - la creación del defecto craneal a través de una incisión de línea media sobre el pericráneo para aislar el hueso parietal derecho, posterior creación de un 4 mm de tamaño crítico defecto craneal sin interrupción de la duramadre subyacente.
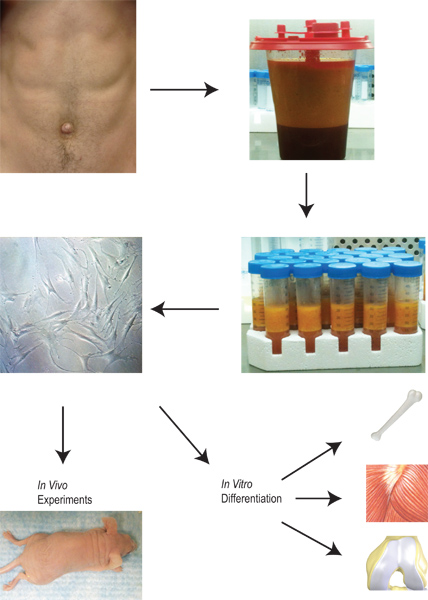
Figura 2. Visión general de la cosecha y la aplicación de lipoaspirado del aislamiento de adiposas derivadas de las células del estroma a su expansión, diferenciación y uso in vitro e in vivo.
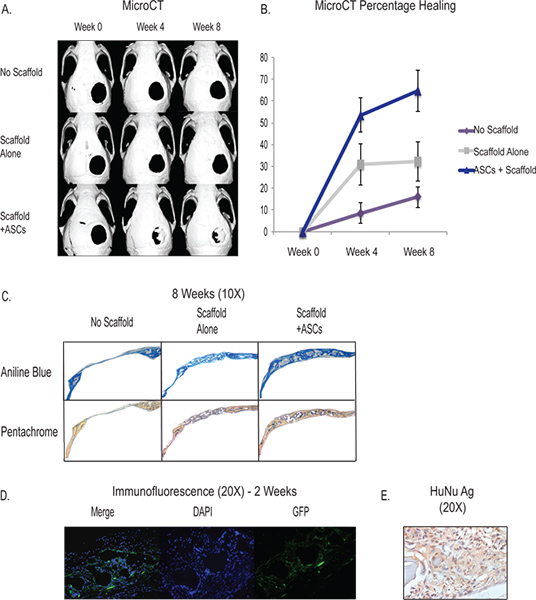
Figura 3. Un MicroCT-muestra en la curación in vivo del defecto de tamaño crítico de calota con la aplicación de las ASC a través de un hydroxyapatitie andamio (fila inferior). Los controles incluyen ningún andamio y el defecto (fila superior) y el defecto con la colocación del andamio sin células (fila del medio) B - Cuantificación de la curación ósea a partir de la MicroCT mostrando curación significativamente mayor en el grupo de ASC. C - Histología mostrando una mayor formación de osteoide del grupo ASC (fila inferior) a través de la tinción de azul de anilina y Pentacromo. Para Anilina Azul, las manchas de color azul oscuro y osteoide por Pentacromo, las manchas osteoide amarillo. D - hASCS marcadas con GFP se sembraron en un andamio y se coloca en un defecto de la bóveda craneal y se sacrificaron a las 2 semanas. La tinción se realizó con una GFP anticuerpo marcado para mostrar las células humanas que contribuyen a la regeneración en la zona del defecto. E -. Inmunohistoquímica Humanos antígeno nuclear que muestra la prevalencia de las células humanas en el área del defecto a las 2 semanas Haga clic aquí para ampliar la cifra .
Access restricted. Please log in or start a trial to view this content.
Discusión
Desde el aislamiento de tejido adiposo derivado de células estromales 2 de lipoaspirado, estas células se han diferenciado en una amplia variedad de linajes celulares. El tejido adiposo es de origen mesodérmico y por lo tanto, multipotentes derivadas de tejido adiposo células estromales será probablemente más eficaz con aplicación hacia un linaje mesodérmico. La capacidad de generar tejido óseo es especialmente importante dada la escasez de zonas donantes para un autoinjerto y las limitaciones inhere...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría dar las gracias al Dr. Commons George y el Dr. Dean Vistnes por su apoyo y colaboración de nuestra investigación. Este trabajo es apoyado por el Instituto Nacional de las subvenciones Investigación Dental y Craneofacial 1 DE019274 R21-01, R01EB009689 y DE020771 RC2-02, la Fundación Oak y Laboratorio de Medicina Pediátrica Hagey Regenerativa con MTL Dr. Hyun es apoyado por el Saint Joseph Mercy Hospital GME .
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo: | Empresa | Número de catálogo | Comentarios (opcional) |
| Lipoaspirado Harvest | |||
| PBS | Gibco | 10010-023 | |
| Solución salina equilibrada de Hank | Cellgro | 21-023 CV- | |
| La colagenasa | Sigma | C6885-500MG | |
| Filtro de células 100 micras | BD Falcon | 352360 | |
| Steri-top 500 ml 0,22 micras filtro | Millipore | SCGPT05RE | |
| Defecto del calvario | |||
| Z500 Brushless MicromotorsUM50C | NSK | NSKZ500 | |
| Circular Knife 4,0 mm | Xemax quirúrgica | CK40 |
Referencias
- Levi, B., James, A. W., Nelson, E. R. Human adipose-derived stromal cells heal critical size mouse calvarial defect. PLoS One. 5, (2010).
- Zuk, P. A., Zhu, M., Ashjia, P. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. 13, 4279-4295 (2002).
- Keefe, M. S., Keefe, M. A. An evaluation of the effectiveness of different techniques for intraoperative antibiotics into alloplastic implants for use in facial reconstruction. Arch Facial Plastic Surg. 11, 246-251 (2009).
- Mitchell, J. B., McIntosh, K., Zvonic, S. Immunophenotype of human adipose-derived cells: Temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24, 376-385 (2006).
- Dominici, M., Blanc, K. L. e, Mueller, I. Minimal criteria for defining multipotent mesenchymal stroma cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Cowan, C. M., Shi, Y. Y., Aalami, O. O. Adipose-derived adult stromal cells heal critical-size calvarial defects. Nat Biotechnol. 22, 560-567 (2004).
- Levi, B., Nelson, E. R., Li, S. Dura mater stimulates human adipose-derived stromal cells to undergo bone formation in mouse calvarial defects. Stem Cells. 29, 1241-1255 (2011).
- Phipps, M. C., Clem, W. C., Catledge, S. A. Mesenchymal stem cells responses to bone-mimetic electrospun matrices composed of polycaprolactone, collagen I and nanoparticulate hydroxyapatite. PLoS One. 6, (2011).
- Yuan, H., Zang, Z., Li, Y. Osteoinduction by calcium phosphate biomaterials. J. Mater. Sci. Mater. Med. 9, 723-726 (1998).
- Wei, G., Jun, Q., Giannobile, W. V. The enchancement of osteogenesis by nano-fibrous scaffolds incorporating rhBMP-7 nanospheres. Biomaterials. 28, 2087-2096 (2007).
- Li, C., Verpari, C., Jin, H. J. Electrospun silk-BMP-2 scaffolds for bone tissue engineering. Biomaterials. 27, 3115-3124 (2006).
- Zhang, Y., Fan, W., Nothdurft, L. In vitro and in vivo evaluation of adenovirus combined silk fibroin scaffolds for bone morphogenetic protein-7 gene delivery. Tissue Eng Part C Methods. 17, 789-797 (2011).
- Levi, B., Hyun, J. S., Nelson, E. R. Non-integrating knockdown and customized scaffold design enhances human-adipose-derived stem cells in skeletal repair. Stem Cells. 29, 21028-21029 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados