Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La enumeración de las principales poblaciones de leucocitos de sangre periférica en ensayos clínicos multicéntricos utilizando un ensayo de sangre entera Fenotipado
En este artículo
Resumen
En este informe, demuestran los pasos de tinción y análisis de un ensayo de fenotipo realiza en la sangre entera fresca para enumerar las principales poblaciones de leucocitos innatos y adaptativos. Hacemos hincapié en las consideraciones para llevar a cabo estos procedimientos en el contexto de un ensayo clínico multicéntrico.
Resumen
Crioconservación de leucocitos de sangre periférica se utiliza ampliamente para conservar las células para las evaluaciones de la respuesta inmune en los ensayos clínicos y ofrece muchas ventajas para la facilidad y la normalización de las evaluaciones inmunológicas, pero los efectos perjudiciales de este proceso se han observado en algunos subconjuntos de células, tales como los granulocitos, células B , y las células dendríticas 1-3. Ensayo de leucocitos frescas da una imagen más precisa del estado in vivo de las células, pero a menudo es difícil de realizar en el contexto de ensayos clínicos grandes. Los ensayos de células frescas dependen de compromisos voluntarios y los plazos, y si consume tiempo, su aplicación puede ser poco práctico debido a las horas de trabajo necesarias del personal de laboratorio. Además, cuando los ensayos se llevan a cabo en varios centros, laboratorios con los recursos y la capacitación necesarios para llevar a cabo los ensayos no pueden estar situados en la proximidad suficiente a los sitios clínicos. Para abordar estas cuestiones, tenemos que desarrorrollado un panel de anticuerpos 11-tinción de color que se puede utilizar con tubos de Trucount (Becton Dickinson, San Jose, CA) a fenotipo y enumerar las principales poblaciones de leucocitos en la sangre periférica, con un rendimiento más robusto de células de tipo información específica de ensayos tales como un Recuento sanguíneo completo (CSC) o ensayos comercialmente disponibles con paneles diseñados para tubos Trucount que manchan por sólo unos pocos tipos de células. El procedimiento de tinción es simple, requiere sólo 100 l de sangre entera fresca, y tarda aproximadamente 45 minutos, por lo que es factible para el estándar de procesamiento de la sangre para llevar a cabo los laboratorios. Es una adaptación de la hoja BD Trucount tubo técnica de datos ( versión 8/2010 ). El cóctel de anticuerpos de tinción puede ser preparado de antemano a granel en un laboratorio central de ensayo y se envían a los laboratorios de transformación en el lugar. Tubos manchados puede ser fijadoy se congelan para su envío al laboratorio de ensayo central para el análisis multicolor citometría de flujo. Los datos generados a partir de este panel de tinción se puede utilizar para rastrear los cambios en las concentraciones de leucocitos en el tiempo en relación con la intervención y fácilmente podrían ser desarrolladas para evaluar los estados de activación de tipos de células específicas de interés. En este informe, demuestran el procedimiento utilizado por los técnicos de laboratorio de procesamiento de sangre para realizar la tinción de sangre entera fresca y los pasos para analizar estas muestras teñidas en un laboratorio de ensayo de soporte central un ensayo clínico multicéntrico. Los detalles del video del procedimiento, ya que se realiza en el contexto de un proyecto de ensayo clínico de la sangre en la Red de Ensayos de Vacunas contra el VIH (HVTN).
Protocolo
Nota: Para proteger los anticuerpos conjugados con fluorocromo de la luz, realice todos los pasos en un gabinete de bioseguridad con la luz apagada.
1. Tinción de anticuerpos Panel Preparación
- El panel de tinción de anticuerpos se pueden encontrar en la Tabla 1. La concentración de anticuerpo debe ser definido por titulación con sangre entera y usando el equipo de citometría de flujo mismo y los procedimientos que se utilizarán para adquirir las muestras teñidas fenotipificación.
- Una vez los títulos de tinción apropiados se determinan, se combinan todos los anticuerpos en una única mezcla en un tubo de bloqueo de la tapa. Añadir tampón de flujo de lavado (PBS de Dulbecco con 2% inactivado por calor suero fetal bovino) para llevar el volumen total a 100 l. Escala de la mezcla para el número de muestras que se están teñidas. Esta mezcla se puede almacenar a 4 ° C durante hasta ocho semanas.
2. La tinción
- Si la sangre recogida es para ser utilizado para otros fines en anunciocondición para este ensayo, establecer una alícuota a un lado mientras más sensibles al tiempo los procedimientos se realizan en la sangre restante. La alícuota se pueden almacenar a temperatura ambiente durante hasta 4 horas después de la punción venosa, sin pérdida significativa de células.
- Compruebe que hay un intacta pellet talón en la parte inferior del tubo Trucount y etiqueta el tubo para identificar la muestra que se tiñeron. En los ensayos clínicos HVTN, el Laboratorio de Sistema de Gestión de Datos (Frontier Science y Technology Research Foundation; Amherst, NY) se utiliza para etiquetar y rastrear muestras de colores.
- Anote los números de lote y fechas de caducidad de todos los reactivos. Anote el número de cuenta tubo Trucount talón proporcionado por el fabricante de la bolsa de tubos, asegúrese de que el número de lote en la bolsa coincide con el número de lote del tubo.
- Utilizar Invertir pipeteado para pipetear exactamente 100 l de sangre total en el tubo Trucount, justo encima del retenedor metálico. Evitar manchas de sangre por el lado del tubo.
- Uso normal (hacia adelante) técnica de pipeteo, pipeta 100 l del panel de anticuerpos tinción mixta (Ver Tabla 1) en el tubo Trucount. Tapar el tubo y agitar a baja velocidad durante aproximadamente 15 segundos para mezclar. Inspeccione visualmente el tubo para asegurar que el gránulo cordón esté completamente disuelto.
- Incubar el tubo Trucount durante 15 minutos a temperatura ambiente (15-30 ° C) en la oscuridad.
- Si es necesario, se diluye una alícuota de 10 × solución de lisis FACS a 1X utilizando DIH 2 O. Añadir 900 l 1 x solución de lisis FACS para el tubo.
- Tapar el tubo y agitar cuidadosamente a baja velocidad durante aproximadamente 15 segundos para mezclar. Empuje la tapa hacia abajo firmemente en la posición de bloqueo en el tubo y la junta con película de laboratorio.
- Almacenar el tubo a -65 ° C a -95 ° C hasta que la muestra está lista para su envío al laboratorio central de análisis o para el análisis en casa. Las muestras son estables en esta etapa durante al menos cuatro semanas. Si va a enviar o ensayar inmediatatamente, este paso puede ser omitido.
3. Envío
Nota: Las siguientes instrucciones utilizan un sistema de envío aislados de Saf-T-Pak, Inc. diseñado específicamente para envío categoría B biológicos sustancias exentas de acuerdo con International Air y Transport Association (IATA). Si el análisis de las muestras en la misma ubicación que la tinción ocurrió, vaya a la sección 4.
- Las muestras pueden ser enviado inmediatamente después de la tinción o una vez que se congelan a -65 ° C a -95 ° C. Envuelva cada tubo completamente en papel de aluminio y coloque en el cuadro de muestra de colores. Coloque la caja espécimen manchado el interior de una bolsa de polietileno a prueba de fugas con materiales absorbentes.
- Coloque la prueba de filtración bolsa de polietileno y el contenido en una bolsa de Tyvek y sello con tan poco aire como sea posible en la bolsa.
- Coloque el paquete espécimen (muestra dentro de un embalaje secundario) dentro de la caja marrón interior.
- B Coloque el interior marrónbuey en el interior del pecho de espuma de poliestireno, fijándola en la muesca para evitar que se desplacen.
- Llene el pecho de espuma de poliestireno con hielo seco (aproximadamente 8 kg) y coloque la tapa firmemente en el pecho.
- Asegure con cinta adhesiva la caja de envío y de la nave como de Sustancias biológicas, Categoría B (UN3373) con el hielo seco adecuado (UN1845) del producto, siga IATA PI-650 instrucciones.
- Tras la recepción, las muestras se almacenaron a -65 ° C a -95 ° C hasta que se analizaron.
4. Descongelación y análisis de citometría de flujo
- Retirar la muestra teñida del congelador se descongele a temperatura ambiente en la oscuridad antes de recoger en el citómetro de flujo. Si la recopilación de datos en más de una muestra, estandarizar el proceso para todos los tubos mediante el escalonamiento descongelación manera que los tubos no están sentados a temperatura ambiente durante más de 1 hora cada uno.
- Las muestras deben ser obtenidas usando un citómetro de flujo láser cuatro equipado con filtros adecuados, tales como el BD LSRII. Utilice la calibración citómetro estándar y métodos de fluorescencia de compensación para la recolección de datos 4.
Nota: No establezca umbrales de dispersión hacia adelante o al lado de dispersión durante la recogida 5. Perlas Trucount puede caer por debajo del valor de umbral más bajo posible para estos parámetros causantes de un subconjunto de perlas no tenerse en cuenta durante el análisis. Si es requerido por el instrumento, para establecer un umbral más bajo posible establecer el umbral Am Cian canal. Debido a que los leucocitos CD45 + teñidas con el panel estará Am Cian positivo, y los granos también Trucount fluorescencia en el canal Am Cian, esto debería permitir a todos los datos relevantes para ser debidamente recogidos.
- Vortex el tubo de muestra durante 5 segundos antes de cargar en el citómetro de flujo. Cuentas Trucount fluorescente altamente en muchos canales. Puerta de las cuentas durante la recolección mediante la búsqueda de la población que es muy positivo para la doble-PE Cy5 y APC (la colo dosrs que distinguen más fácilmente las perlas de las células puede variar dependiendo de la instrumentación). Seleccione la puerta de perla como la puerta de detener y registrar datos hasta por lo menos 20.000 cuentas se adquieren.
- Analizar los datos con el software adecuado, como FlowJo (Treestar; Ashland, OR). Figura 1 se muestra el esquema de puerta utilizado para el análisis de las diferentes poblaciones de leucocitos de un empate de sangre del control representativo.
5. Cálculos Trucount
- Cada tubo contiene Trucount una pastilla liofilizada de perlas fluorescentes. Después de la adición de líquido al tubo y la agitación en vórtex, las perlas deben ser distribuidas por igual en toda la muestra. El número de los granos en la pastilla varía ligeramente según el número de lote y se puede encontrar en la bolsa de almacenamiento para los tubos.
- Puerta de las cuentas Trucount y poblaciones de células, como se muestra en la Figura 1 para determinar el recuento de eventos para cada población. Comparando el número de eventos in de la puerta de vidrio hasta el número total de bolas originalmente en el tubo le permitirá determinar la proporción de la muestra recogidos, que entonces se puede utilizar para determinar la concentración absoluta (es decir, las células / l) para cada población. La siguiente ecuación se puede usar para este propósito: la concentración de la célula (# células / sangre entera l) = [# de población acontecimientos (eventos / # / # grano granos totales en pellet)] / 100 mu l.
6. Los resultados representativos
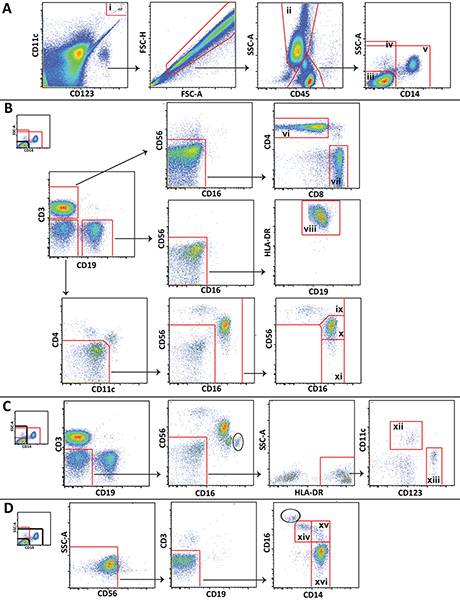
Figura 1. Gating esquema utilizado para el análisis de grandes poblaciones de leucocitos que muestran datos representativos de un voluntario sano. A) perlas Trucount (i) están cerradas y excluido de las células. Granulocitos (ii) se delinean y lympohcytes y monocitos se dividen en 3 popluations: CD14linfocitos negativos (iii), todas las células CD14 negativas (iv) y que no son linfocitos (v). B) CD14 linfocitos negativos son gated para distinguir células T CD4 + (vi), células CD8 + T (vii), células B (viii), células CD56 brillantes NK (ix), CD56 dim células NK (x), y CD56 células NK negativos (xi). C) Todas las células CD14 negativas están cerradas para distinguir mieloide (xii) y (xiii plasmacitoides) células dendríticas. D) No lympocytes están cerradas para distinguir no clásicos (xiv), intermedio (XV) y clásico (xvi) los monocitos. Haga clic aquí para ampliar la cifra .
Subconjuntos de células más específicas que no se muestran en la Figura 1 (por ejemplo, las células NKT o neutrófilos) también se pueden distinguir mediante el panel se presentan, y el esquema de puerta puede ser ampliado o modificado para satisfacer las necesidades específicas de estudio. Algunos pasos de activación periódica mostrados son únicas a este método. Cabe destacar que una puerta de la inclusión y lapuerta de exclusión se dibujan alrededor de las perlas Trucount y se coloca en la parte superior de uno al otro, uno a la puerta de las perlas para el recuento, y la otra para excluir las perlas del análisis celular (Figura 1A). Además, debido a los linfocitos, monocitos y granulocitos no son como se distingue fácilmente en la sangre entera como lo son en las células mononucleares de sangre periférica por dispersión frontal y dispersión lateral, gating estas células utilizando expresión CD45 y la dispersión lateral es a menudo necesario (Figura 1A). Granulocitos contaminantes (círculo) que no pudieron ser separados de linfocitos y monocitos utilizando CD45 y dispersión lateral son distinguibles en algunas parcelas por su alta expresión de CD16 (Figura 1C y Figura 1D). El número de granulocitos contaminantes es generalmente pequeño, y que no interfieran con gating celular de monocitos y NK.
Discusión
En este informe se presenta un método basado en perlas para enumerar las poblaciones de leucocitos en sangre entera fresca por citometría de flujo y cubrir los parámetros necesarios para su uso en un ensayo clínico multicéntrico con el análisis de muestras centralizado. Este método se basa en el protocolo y optimiza BD Trucount y permite su uso confiable en un entorno ensayo clínico multicéntrico. El ensayo de tinción es simple y toma aproximadamente 45 minutos para llevar a cabo, por lo que es factible para l...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a Jessica Jones, Clark Erica, Ducar Constanza, Donna Smith, Lewis Roy, Apedaile Lily, Wiesner Joanne, Adams Devin, McBain Corey y Voght Stephen por su ayuda en el desarrollo de este método, manuscrito y video.
Este trabajo fue financiado por la Fundación Bill y Melinda Gates CAVD subvención 38.645 (MJM) y los Institutos Nacionales de Salud subvenciones UM1 AI068618 y AI069481 U01 (MJM). EA-N. es apoyado por el NIH subvención T32 AI007140. Damos las gracias a la James B. Pendleton Charitable Trust por su donación generosa equipo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| Trucount absolutos Tubos de conteo | BD Biosciences | 340334 | |
| FACS 10X Solución de lisis | BD Biosciences | 349202 | |
| Categoría B & Sistema de Envío Quito, con aislamiento | Saf-T-Pak | STP-320 | |
| CD45 AmCyan anticuerpo monoclonal | BD Biosciences | 339192 | |
| CD3 FITC anticuerpo monoclonal | BD Biosciences | 349201 | |
| CD8-PerCP Cy 5,5 anticuerpo monoclonal | BD Biosciences | 341051 | |
| CD4 Alexa Fluor 700 Antibo monoclonaldy | BD Biosciences | 557922 | |
| HLA-DR ECD anticuerpo monoclonal | Beckman Coulter | IM3636 | |
| V450 CD14 anticuerpo monoclonal | BD Biosciences | 560349 | |
| CD19 PE anticuerpo monoclonal | BD Biosciences | 555413 | |
| CD16 APC-H7 anticuerpo monoclonal | BD Biosciences | 560195 | |
| CD56 PE-Cy7 anticuerpo monoclonal | BD Biosciences | 335791 | |
| CD11c APC anticuerpo monoclonal | BD Biosciences | 559877 | |
| CD123 PE-Cy5 anticuerpo monoclonal | BD Biosciences | 551065 |
Referencias
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M., Herzenberg, L., Blackwell, C., Weir, D. . The handbook of Experimental Immunology. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6 (2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados