Method Article
Entrega intraventricular directa de medicamentos al roedor Sistema Nervioso Central
En este artículo
Resumen
Se describe un método para dirigir fármacos al sistema nervioso central ya sea por la implantación de un catéter o la realización de una inyección en bolo en el ventrículo lateral derecho en ratones. Nos centramos específicamente en la entrega de los oligonucleótidos antisentido. Esta técnica es fácilmente adaptable a otras drogas y para ratas.
Resumen
Debido a la imposibilidad de atravesar la barrera hematoencefálica, algunos medicamentos deben ser entregados directamente en el sistema nervioso central (SNC). Nuestro laboratorio se centra específicamente en oligonucleótidos antisentido (ASO), aunque las técnicas que se muestran en el vídeo aquí también se pueden usar para suministrar una gran cantidad de otros fármacos para el SNC. Los oligonucleótidos antisentido (ASO) tienen la capacidad de objetivos específicos de secuencia desmontables 1, así como los ratios isoforma cambio de genes específicos 2. Para lograr generalizada caída gen o empalme en el SNC de ratones, los OSS pueden ser entregados en el cerebro utilizando dos rutas distintas de la administración, los cuales se manifiestan en el video.
Los primeros usos bombas osmóticas Alzet, conectados a un catéter que se implanta quirúrgicamente en el ventrículo lateral. Esto permite que los ASO a ser infundido continuamente en el SNC para un período de tiempo designado. El segundo implica una sola inyección en bolo de una high concentración de ASO en el ventrículo lateral derecho. Ambos métodos usan el sistema ventricular cerebral del ratón para entregar el ASO a todo el cerebro y la médula espinal, aunque dependiendo de las necesidades del estudio, un método puede preferirse sobre el otro.
Introducción
Algunos medicamentos no son capaces de cruzar la barrera hematoencefálica (BBB), lo que requiere directa del sistema nervioso central (SNC) de entrega. Para eludir la acreditación, los medicamentos pueden ser entregados directamente en el cerebro usando los métodos descritos. Aunque nuestro laboratorio y el documento se centran en este documento detallado sobre oligonucleótidos antisentido (ASO), a otros medicamentos, como pequeñas moléculas, anticuerpos, vectores de terapia génica, etc., También pueden ser entregados a través del mismo método exacto.
Ciertas proteínas desempeñan un papel fundamental en la patogénesis de las enfermedades neurodegenerativas. Estas proteínas forman a menudo especies tóxicas y se acumulan en agregados, dando lugar a la eventual muerte neuronal y la enfermedad neurológica posterior 3-4. En un esfuerzo para reducir la velocidad o incluso detener la progresión de estas enfermedades, una opción terapéutica puede ser para apuntar directamente y disminuir la proteína causante. Sin embargo, estas proteínas se encuentran a menudo ubicua a través del SNC, lo que hace difícil e ffectively dirigirlos en una escala global.
Con el fin de orientar los genes en todo el SNC, administramos OSS ratón en líquido cefalorraquídeo (LCR) a través del ventrículo lateral a pasar por alto la acreditación. Este método específico se aprovecha del sistema ventricular del ratón que baña todo el cerebro y la médula espinal, lo que permite una amplia distribución de los OSS. Utilizamos OSS que son 18-20 mer moléculas de ARN-como que se unen directamente a la secuencia de ARNm diana y, en función de las modificaciones químicas ASO, ya sea A) recluta RNasa H para degradar el ARNm que conduce a la caída o B) cambiar de corte y empalme alternativo 1 , 2,16,17. Debe tenerse en cuenta que existen múltiples moléculas para derribar una proteína específica in vivo, incluyendo shRNA. Dado que estas moléculas no son el foco de este artículo, nos dirigimos al lector a revisar los artículos que mejores mecanismos desmontables detalle de la acción y las ventajas / desventajas de cada uno de 5-6.
jove_content "> En el trabajo anterior, hemos utilizado OSS para apuntar la proteína superóxido dismutasa 1 (SOD1) en un modelo de rata transgénica de la esclerosis lateral amiotrófica (ELA) 7 (Figura 4). Las mutaciones en SOD1 producirse en aproximadamente el 2% de todos los ALS 8 casos, a pesar de que ha sido recientemente la hipótesis de que la SOD1 puede desempeñar un papel importante en la ELA esporádica, así 9-10. Mediante la disminución de los niveles totales de SOD1 en la rata transgénica ALS, la supervivencia después de la aparición, fue significativamente superior 7. Estos datos importantes fueron la primera para mostrar que un tratamiento de ASO en el SNC podría tener un profundo impacto positivo en un modelo de enfermedad neurológica. Desde entonces, OSS específicas para SOD1 humanos han entrado y completado con éxito un ensayo clínico de fase I humana con efectos secundarios mínimos (Clnicaltrails.gov NCT01041222) , tal como se presenta en la 64 ª Academia 2012 Annual Americana de Neurología. Planes para mover los OSS avance a la fase II de los ensayos están en curso. Mientras dirige SOD1 fue la primera demostración de la utilización de OSS para el tratamiento de una enfermedad neurológica, varios otros estudios ya se han realizado buscando en diferentes enfermedades y sus respectivos objetivos de proteínas. En 2010 y 2011, ASO ese cambio empalme de la supervivencia de proteína de las neuronas motoras 2 (SMN2) fueron utilizados en modelos de ratones transgénicos de la atrofia muscular espinal (SMA) y dio lugar a una mejora significativa en los fenotipos de la enfermedad 11,12. Estos OSS empalme se encuentran ahora en la fase I de ensayos clínicos en niños con AME (Clinicaltrails.gov NCT01494701). Además, se ha demostrado recientemente que la administración transitoria de OSS dirigidos contra el gen de la huntingtina fueron capaces de rescatar drásticamente el modelo de ratón de Huntington, incluso después de que los niveles de proteína huntingtina volvieron a la línea base 13.En todos estos estudios, OSS fueron entregados al ventrículo lateral para disminuir los niveles totales de genes o alterar empalme de genes a travéstodo el SNC. Ambas bombas osmóticas y una sola inyección de bolo se puede utilizar para entregar OSS a la peste porcina clásica. Bombas permiten una lenta, la entrega continua, mientras que el bolo intracerebroventricular (ICV) es un, inyección rápida de una sola vez. Hemos utilizado ambos métodos con éxito, aunque no han informado de la comparación directa entre la bomba y el bolo en una sola línea transgénica.
Usando OSS en el SNC es una poderosa manera de disminuir los niveles totales de proteínas y / o cambio de empalme de varias proteínas. Mientras que utilizamos ASOs exclusivamente como un tratamiento para los trastornos neurológicos, reconocemos que otros campos también pueden beneficiarse de esta técnica. Mientras que la proteína de interés se expresa en el sistema nervioso central y el objetivo final es lograr cambios a nivel del SNC en la expresión génica, utilizando OSS en las técnicas demostradas puede ser muy útil.
Protocolo
El protocolo a continuación ha sido aprobado por el Cuidado de Animales institucional y Comités uso en la Universidad de Washington en St. Louis y está de acuerdo con los Institutos Nacionales de Salud directrices para el uso de animales de experimentación. Si esta es la primera vez que la realización de cirugías, le recomendamos que consulte el artículo de Jove en cirugías de roedores como introducción antes de comenzar la 14.
OSS se pueden entregar en el SNC a través del ratón tanto para la infusión de la bomba osmótica y una sola inyección en bolo ICV. Debido a esto, el procedimiento detallado a continuación se divide en dos segmentos. Pros y contras de cada método se abordaron en la sección de Discusión. Las coordenadas que se utiliza en los protocolos son para adultos y C57BL6 ratones B6C3. Coordenadas de rata correspondientes se pueden encontrar en la Tabla 1.
Bomba osmótica ALZET
1. Preparación de bombas osmóticas Alzet
- Establecer un drap estérilcorreo y colocar cuidadosamente los siguientes elementos en ella, teniendo cuidado de no tocar nada directamente con el fin de mantener la esterilidad: bomba osmótica (s), modulador de flujo (s), 1 ml jeringa estéril (s), hoja de bisturí, y las secciones de tubería (1 pedazo de tubería = 5 bombas). Para los ratones, hay tres opciones para bombas: 14 días, 28 días y 42 días (Figura 2A).
- Destapar y llenar tubos cónicos estériles de 50 ml con 15 a 20 ml de solución salina. Hasta 6 bombas montadas se pueden añadir por tubo cónico.
- Llene un plato de Petri p60 con etanol al 100%. Añadir número apropiado de catéteres para el etanol. Para los ratones, longitud del catéter es de 2,5 mm.
- Filtrar cada ASO en tantos tubos Eppendorf de 1,5 ml, según sea necesario. Incluye un tubo de Eppendorf lleno con 0,9% de solución salina estéril para llenar el tubo con.
- Una vez que todo está preparado, se puso los guantes estériles. Asegúrese de no tocar nada que no sea estéril. Cámbiese los guantes si es necesario.
- Para cada ASO a ser utilizado, llenar una jeringa de 1 mly loadpumps mediante la colocación de la aguja en el orificio superior y llenar lentamente hasta que el exceso de fugas a cabo. Continúe hasta que todas las bombas están llenas.
- Destape el Flow-moduladores y se insertan en las bombas. Empuje el flujo de-modulador casi la totalidad de la forma en, dejando un espacio de 3-5 mm.
- Uso de la hoja de bisturí, corte cada pedazo de tubo en 5 segmentos iguales. Tome una pieza de tubo, llenar con solución salina estéril usando una jeringa de 1 ml, y insertar la parte superior del modulador de flujo en un extremo de la tubería. Luego tomar una cánula desde el etanol y conectarlo al otro extremo de la tubería. Ahora la bomba está completamente montado.
- Coloque la bomba completamente montada en el tubo cónico estéril de 50 ml con solución salina para el cebado. El cebado permite para las bombas para absorber fluido para iniciar la administración de fármacos, así como llegado a la temperatura adecuada. El tiempo de cebado: 14 bombas días: 06.04 h, 28 bombas de día: 40 hr, bombas de 42 días: 60 h. Cuando haya terminado el montaje de las bombas, tapar los tubos cónicos y colocar en un lugar limpio37 ° C baño de agua hasta la cirugía.
2. Procedimiento Pre-quirúrgica
- Limpie todo abajo con etanol al 70% para esterilizar la zona y establecer paños estériles sobre la mesa y stereotax para crear un campo estéril. Es importante tener en cuenta el campo estéril durante toda la cirugía completa. Active la siguiente: esterilizador de cuentas, cojín de calefacción, luz, lectura digital y de oxígeno / Sistema de isoflurano (Figura 1).
- Los siguientes elementos serán necesarios si hacerlo o bien una sola cirugía o un lote de cirugías, ya que habitualmente hacemos: 1 par de pinzas, 1 pinza hemostática curva, 1 par de tijeras pequeñas, 1 par de pequeñas tijeras romas curvas, 1 rata de corte del hueso , 1 pinza hemostática recta, 5-0 suturas de nylon, 1 tubos cónicos con etanol al 70%, 1 tubo cónico con etanol al 95%, 1 tubo cónico con yodo, 1 tubo cónico con peróxido de hidrógeno, el paquete de hisopos de algodón estériles, 1 botella de súper pegamento, 1 tubo de pomada antibiótica, 1 tubo de ojolubricante, y 1 máquina de afeitar eléctrica.
- Coloque la punta de los dos pares de tijeras, pinzas hemostáticas y curvado en el esterilizador de cuentas durante 15 s. Retirar y colocar en etanol al 70%. Cuando se realiza más de una cirugía, vuelva a esterilizar las puntas de los instrumentos en entre los animales.
- Girar el isoflurano al 4% y O 2 0,4 l / min y el flujo de gas directamente a la cámara. Contamos con nuestro sistema / oxígeno isoflurano calibrado al menos una vez al año para asegurarse de que estamos entregando la cantidad adecuada de anestesia. Coloque el ratón en la cámara y espere hasta que la respiración se ralentiza considerablemente. Retire el ratón y realice una pizca dedo del pie para asegurarse de que el ratón es completamente inconsciente.
- Afeitar el pelo de la parte superior del hombro hasta en medio de los ojos. Si el ratón comienza a despertar, coloque el puntero del ratón hacia la cámara hasta que el ratón es completamente inconsciente de nuevo, confirmando con una pizca dedo del pie. Coloque el ratón anestesiado en el stereotax y empuje el cono de la nariz sobre la nariz.Sea amable como los dientes y los huesos son frágiles.
- Dirigir el flujo de gas al stereotax mantener el ratón anestesiado. Es importante comprobar de vez en cuando para asegurarse de que el ratón es completamente inconsciente con una pizca dedo del pie durante toda la cirugía. Asegure la cabeza con los barrotes del oído. Nosotros preferimos nivelación bares del oído, aunque para apuntar el ventrículo lateral, un cráneo perfectamente nivel no es necesario debido al gran tamaño del ventrículo.
- Baje el nivel de isoflurano al 2,0% para el mantenimiento. Frote pomada en cada ojo. Como se ve en el video, había un campo estéril sobre el ratón de modo que sólo la base del cuello y la cabeza están expuestos. A continuación, la desinfección de la zona quirúrgica limpiando la parte superior de la cabeza y el cuello en un movimiento circular comenzando en el centro de la zona de afeitado y en movimiento hacia el exterior primero con un hisopo de algodón humedecido en etanol al 95%, seguido de un bastoncillo de algodón humedecido en yodo.
- Se recomienda utilizar una temperatura del sistema de calefacción de sonda rectal retroalimentación controlada que garantizala temperatura del ratón se mantiene en un establo 37 ° C. Si la temperatura del ratón disminuye durante la cirugía, la recuperación después de la cirugía puede llevar más tiempo y la hipotermia resultante puede conducir a la actividad aberrante de proteínas, incluyendo la hiperfosforilación de la proteína Tau asociada a microtúbulos 15. Después de configurar el sistema de calefacción, que ahora está listo para comenzar la cirugía.
3. Implantación de la bomba osmótica Alzet
- Antes de comenzar la cirugía, se puso un nuevo par de guantes estériles. Luego, utilizando fórceps y un pequeño par de tijeras, hacer una incisión en la piel de la base del cuello por encima de cráneo del animal a un máximo en entre los ojos
- Tome las tijeras romas con la curva hacia arriba y deslice por debajo de la piel en la base de la parte posterior del cuello hacia la extremidad posterior izquierda. No debería haber ninguna resistencia. Si existe, retire las tijeras y vuelva a intentarlo. Esto forma el bolsillo subcutáneo de la bomba osmótica.
- Wipe el cráneo limpio con hisopos de algodón estériles, seguido de un bastoncillo de algodón humedecido en peróxido de hidrógeno para mejorar la bregma.
- Limpiar abajo de los tubos cónicos de 50 ml que contienen bombas para mantener la esterilidad de las bombas. Con cuidado, una bomba desde el tubo cónico utilizando la pinza hemostática curva, teniendo cuidado de que la bomba no toca los lados del tubo cónico. Mantenga la base de la bomba con unas pinzas y empuje el modulador de flujo en el resto de la forma con la pinza hemostática curva.
- Mantenga la bomba donde el modulador de flujo y el tubo se reúnen con la pinza hemostática curva. Inserte la bomba bajo la piel en la base del cuello y empujarlo hacia la extremidad posterior izquierda hasta el tope sin resistencia. Tenga cuidado de no dejar que la sonda toque nada.
- Con la pinza hemostática curva, tomar la cánula en la ranura de la parte superior, donde se encuentra con el pedestal. Mueva el controlador de la cánula en su posición y asegure en su lugar.
- Coloca una gota de pegamento en la base de la cánula. Push la parte superior de la cánula en el conductor y la posición de modo que el tubo se apunta directamente hacia atrás.
- Toque la punta del catéter a bregma y poner a cero las coordenadas en la pantalla digital. Elevar el catéter y mover 1,1 mm lateralmente a la derecha y 0,5 mm posterior (Figura 2B). Mantenga la piel de la manera con la pinza hemostática curva.
- Conducir el catéter de metal delgado a través del cráneo hasta que la base cánula de plástico quede presionado firmemente contra la parte superior del cráneo. El catéter de metal se puede conducir directamente a través del cráneo en ratones debido al cráneo delgada relativa. Si el uso de ratas, perforar un agujero en el cráneo antes de bajar el catéter.
- Tire cualquier piel que tiene pegamento en la basura del cráneo. Con el controlador cánula que sostiene la cánula / sonda en su lugar, esperar 1-2 minutos para que el pegamento se seque completamente.
- Durante la práctica, para evaluar la colocación del catéter, se inyectan 20-40 l de 2,5% FastGreen colorante a través del tubo (Figura 2C). Espere 2-3 minutos, perfuse el ratón con 1X PBS 0,03% heparina, y retire el cerebro. Corte coronal en el sitio del catéter. Si el catéter se coloca en el ventrículo, el colorante se perfunde en todo el sistema ventricular del ratón (Figura 2D).
- Sostenga el catéter en su lugar con la pinza hemostática curva mientras que aumentaba el conductor. Suelte lentamente la pinza para asegurarse de que la cánula está bien fijado al cráneo.
- Con un hisopo de algodón, presione hacia abajo la parte superior de la cánula. Coloque a los Clippers ósea de rata en el bosque entre la parte superior y la base de la cánula. Clip de la parte superior de la cánula mientras sigue presionando hacia abajo con el bastoncillo de algodón. Trata de mantener el nivel de las podadoras para no separar la cánula del cráneo. Si la cánula no vengas arrastrado, de forma rápida re-pegamento y aplique presión con un hisopo de algodón durante 2 min.
- Usando el hilo de sutura 5-0, hemostática regular, y las pinzas, suturas a lo largo de la apertura total, prestando una atención especial a la derecha sobre la cánula. Utilizamos un running sutura de colchonero horizontal (véase la figura 5) debido a la incisión más grande sobre el cráneo.
- Aplique una pequeña cantidad de pomada antibiótica en la cabeza y el cuello. Afloje el oído bares y aflojar el cono de la nariz. Retire el ratón del stereotax y colóquelo en una almohadilla térmica para la recuperación. Monitorear los ratones estrechamente para la duración de la recuperación, típicamente van desde 10-30 minutos. Compruebe cada 2-3 minutos hasta que el ratón comienza a caminar alrededor y que se prepara.
4. Cuidados después de la operación
- Controle los ratones al día después de la cirugía para la primera semana.
- Si un ratón parece estar en el dolor o la angustia, le recomendamos que proporciona el ratón con un mg / kg por inyección subcutánea de 5 Carprofen una vez cada 24 horas durante un máximo de 5 días, a fin de aliviar el dolor.
- Si parece que hay una infección, aplicar generosamente pomada antibiótica a la zona a diario y consultar con un veterinario a cargo para asegurar que la herida se cura adecuadamente.
- ReMove la sutura de nylon 5-0 7-10 días después de la cirugía para prevenir la irritación del hilo de sutura.
5. Cambio o eliminación de la bomba osmótica Alzet
Después de la bomba se realiza la infusión activamente ASO, se puede ya sea cambiado o eliminado por completo.
- Siga el mismo procedimiento antes de la cirugía mencionado, con las siguientes modificaciones: 1) no se necesitan las tijeras curvas, hemostática curva, cortadores ósea de rata, ni la pantalla digital, y 2) en lugar de preparar la cabeza del ratón, afeitarse y desinfectar la parte posterior del ratón en el cruce de la bomba y la tubería.
- Hacer una incisión de 1,5 cm en la parte posterior del ratón, perpendicular a la unión de la bomba / tubo, utilizando fórceps y tijeras. Saque con cuidado la bomba fuera de la incisión sin tirar / empujar la tubería ya que podría sacudir el catéter de manera significativa.
- Para quitar la bomba, cortar el tubo aproximadamente 0,5 cm por encima del modulador de flujo y toque el pegamento al tubo to sellarlo. Espere 1-2 minutos para que el pegamento se seque. Colocar el tubo nuevamente dentro de la incisión y sutura cerrada. Frote ungüento antibiótico sobre la piel suturada y el lugar del ratón sobre una almohadilla de recuperación climatizada.
- Para cambiar la bomba, recién han hecho bombas listo junto con un plato de 10 cm llena con etanol al 95%. Los catéteres no son necesarios con las nuevas bombas.
- Agarra una nueva bomba con las pinzas. Sumerja sus dedos en el etanol, echa mano de la bomba, y desechar el flujo modulador. Luego, con cuidado y lentamente salga de la bomba vieja del modulador de flujo conectado al tubo y la cánula. Tan pronto como está apagado, deslice lentamente la nueva bomba en, asegurando que el modulador de flujo nunca toca la parte exterior del ratón.
- Vuelva a introducir la nueva bomba a través de la incisión de nuevo en el paquete subcutánea y la sutura de la piel. Frote ungüento antibiótico sobre la herida y el lugar del ratón en la pista de la recuperación.
- Al igual que con la implantación de la bomba, supervisar los ratones todos los días después de la cirugía para comprobar si pain / malestar e infecciones. Tratar con Carprofen y los antibióticos cuando se considere necesario.
ICV BOLO
6. Procedimiento Pre-quirúrgica
- Siga el mismo procedimiento antes de la cirugía como en la sección 2 anterior con los siguientes cambios: 1) no se necesitan tijeras curvas, hemostática curva, o cuchillas de hueso de rata, 2) limpiar una jeringa Hamilton 10 l y la aguja con agua esterilizada y se carga con ASO, y 3) conectar la jeringa y la aguja en el aparato estereotáxico donde se encuentra el controlador cánula.
7. Inyección en bolo de ASO
- Con unas pinzas y un pequeño par de tijeras, hacer una incisión en la base del cuello hasta en medio de los ojos.
- Limpiar el cráneo limpio con hisopos de algodón estériles, seguido de un bastoncillo de algodón humedecido en peróxido de hidrógeno para mejorar la bregma.
- Mueva la jeringa / aguja en su lugar y fijarla. Asegúrese de que la parte biselada de la aguja se enfrenta posterior. Bajela aguja hasta que toque bregma. Poner a cero todas las coordenadas. Mover la aguja lateralmente hacia la derecha 1,0 mm anterior y 0,3 mm (Figura 3A).
- Maneje lentamente la aguja a través del cráneo justo hasta que el agujero de la aguja quede al ras con la parte superior del cráneo. Una vez más, esto se puede hacer debido a la delgadez del cráneo del ratón. El cero de la coordenada z y bajar la aguja a -3,0 mm a una velocidad de 1 mm / seg (Figura 3B). Espere 2-3 minutos para el cerebro para sellar alrededor de la aguja.
- Entregar el 10 l lleno de ASO a una velocidad de 1 l por seg. Espere 2-3 minutos. Utilizamos una tasa de infusión de l 1 de OSS en el ventrículo, aunque esta tasa puede variar entre los diferentes fármacos. Durante la práctica, comprobar la correcta colocación de la aguja mediante la entrega de 10 a 20 l de 2,5% FastGreen Dye. Perfundir el ratón con 1X PBS 0,03% de heparina pronto después de la infusión del tinte y hacer que las secciones coronales del cerebro para verificar que el tinte se encuentra en el sistema ventricular (Figura 3C).
- Mantenga una torunda de algodón contra el cráneo en la base de la aguja. Levante la aguja a una velocidad de 1 mm por seg. Tan pronto como la aguja está fuera del cráneo, rodar el hisopo de algodón sobre el agujero de la aguja y mantener durante 1 min para evitar la ASO se escape.
- Suturar la piel se cerró, aplique ungüento antibiótico, y el lugar del ratón en la pista de la recuperación climatizada. Dependiendo de la concentración de ASO, puede tardar 20 minutos para un par de horas para recuperarse por completo.
- Al igual que con la implantación de la bomba, supervisar los ratones todos los días después de la cirugía para revisar para el dolor / incomodidad y las infecciones. Tratar con Carprofen y los antibióticos cuando se considere necesario.
Resultados
Después de la infusión de la bomba o de un tiempo designado después de la inyección ICV en bolo (usamos rutinariamente cuatro semanas), es importante para poner a prueba la eficacia de los OSS. Le recomendamos que tome varias regiones del cerebro y la médula espinal para medir los niveles / isoformas del gen objetivo, tanto a nivel de ARNm utilizando PCR cuantitativa en tiempo real, así como el nivel de proteínas utilizando Western Blot o ELISA (Figura 4 para un ejemplo publicado ). Esto ayudará a determinar la eficacia ASO en las diferentes regiones del sistema nervioso central. Si la vida media de la proteína específica es largo, se aconseja esperar más tiempo después de la infusión de ASO con el fin de evaluar la caída máxima de proteína o empalme.
También es importante para poner a prueba la distribución de oligo. Infusiones bomba resultado en la distribución a través de los hemisferios ipsilateral y contralateral, aunque una concentración de ASO superior se ve a menudo en las áreas más cercanas al sistema ventricular 16. ICV inyecciones en bolo dió un más unifodistribución rm del oligo por el SNC 16, aunque los efectos pueden no durar tanto tiempo. Dirigimos al lector a Southwell et al. Para ver una comparación directa de la bomba versus en bolo de distribución oligo 16.
También te recomendamos probar varias dosis, así como la duración de la acción de los ASO ASO ya que cada uno se comporta ligeramente diferente en vivo. OSS suelen tener una duración relativamente larga de la acción, con la caída de destino o empalme que dura varios meses después de la entrega de ASO. Además, algunos OSS funcionarán mejor que otros y algunos genes objetivos serán más fáciles de caída que otros. Debido a esto, cuando la detección Asos para determinar el candidato líder, le recomendamos probar al menos 3-5 Asos en vivo con un n = 4-6 ratones adultos por ASO, como primer paso.
Si está usando un medicamento que no sea OSS, también será importante para poner a prueba la concentración ideal de drogas, la duración de la acción de drogas, y las drogas CNSdistribución para ese compuesto específico.
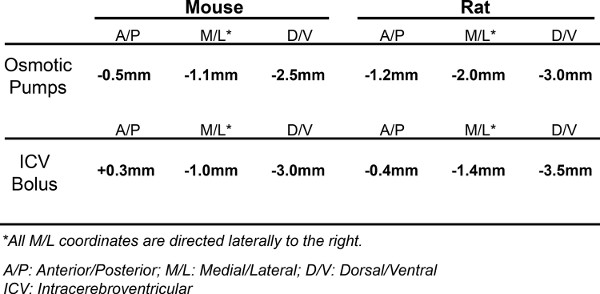
Tabla 1. Cirugía Coordenadas. Las coordenadas utilizado para golpear el ventrículo lateral derecho tanto en ratones y ratas, cuando la implantación de bombas osmóticas, así como la realización de un intracerebroventricular (ICV) en bolo. Ambas coordenadas, para bombas y bolo ICV, orientar el ventrículo lateral derecho. Utilizamos dos tipos diferentes debido a que estos son los que tenemos más experiencia y sabemos proporcionan una excelente distribución de la ASO.

Figura 1. Configuración estereotáxica. (A) El equipo estereotáxico necesaria para la bomba Alzet y cirugías inyección en bolo. I) abalorios Esterilizarr. ii) Lectura Digital. iii) Base estereotáxica con los brazos en movimiento. iv) Temperatura Controlada Placa Térmica. v) El isoflurano / sistema de oxígeno. vi) Cámara isoflurano. (B) Cerca de la ojiva y bares del oído. (C) Dos accesorios necesarios. Izquierda: Jeringa / soporte de la aguja de ICV inyecciones en bolo. Derecha: Conductor Cánula de implantación de la bomba osmótica.
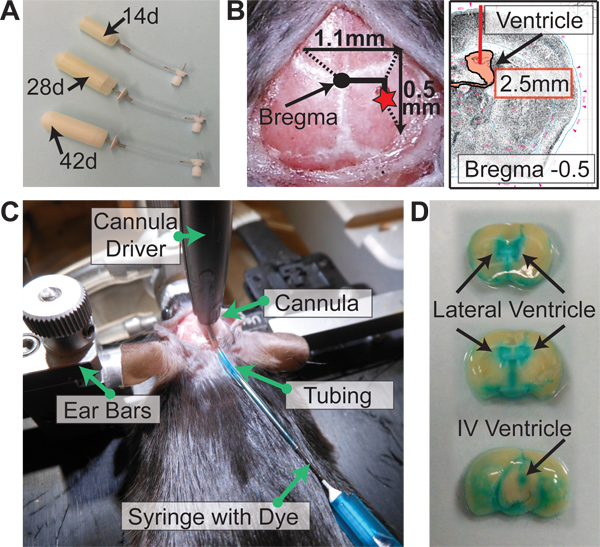
Figura 2. Alzet implantación de la bomba osmótica. (A) de la bomba osmótica Alzet opciones para los ratones. . 14 bombas días (0,25 l / h), 28 bombas días (0,25 l / h), 42 bombas días (0,15 l / h) (B) Coordenadas para la implantación de la bomba de bregma: -0,5 mm Posterior, -1,1 mm Lateral ( Derecha), y -2,5 mm ventral (longitud del catéter). (C) Después de conducir el catéter a través de lacráneo y encolado de la cánula, colorante se vacía a través del catéter para evaluar la colocación apropiada del catéter en el ventrículo lateral. (D) del cerebro perfundido inmediatamente después de tinte se administra como en (C). Si catéter se colocó con éxito en el ventrículo, el medio de contraste se distribuye por todo el sistema ventricular del ratón.

Figura 3. Inyección en bolo intracerebroventricular. (A) Coordenadas para la inyección en bolo desde el bregma: 0,3 mm anterior, -1,0 mm lateral (derecha), y -3,0 mm ventrales (B) Después de conducir la aguja a través del cráneo -3,0 mm ventral, tinte es empujado a través de la jeringa. para evaluar la colocación correcta de la aguja en el ventrículo más tarde. (C) cerebro perfundido poco después de tinte se administra como en (B). Si la aguja se colocó con éxito en el ventrículo, latinte se distribuye por todo el sistema ventricular del ratón.
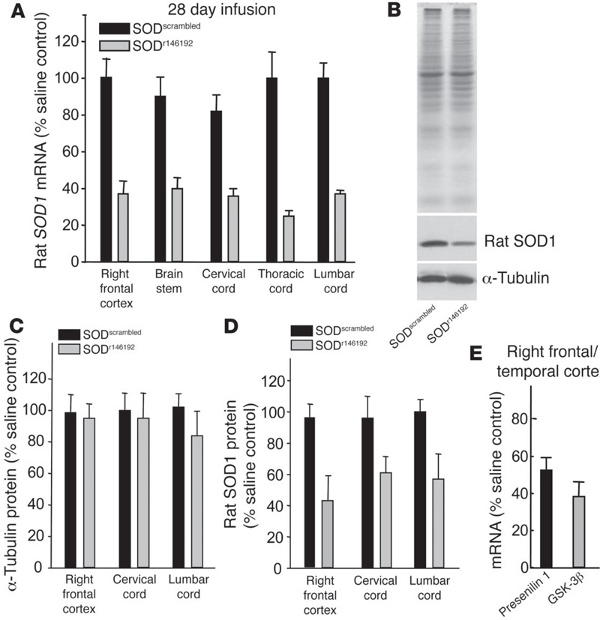
La Figura 4. Los oligonucleótidos antisentido reducir SOD1 rata in vivo (figura tomada directamente de Smith et al. 7). (AD) oligonucleótidos antisentido SOD1 SOD r146192 SOD o revueltos, se infundieron durante 28 días en el ventrículo lateral derecho de ratas normales a 100 mg / día. (A) endógenos SOD1 los niveles de ARNm de cerebro y la médula espinal tal como se mide mediante qRT-PCR. ( B) SOD1 y a-tubulina los niveles de proteína después de la infusión de ASO. (C y D) Los niveles de proteína para la tubulina y la SOD1 cuantificado para diferentes regiones del cerebro después de la infusión. (E) OSS contra la presenilina 1 o GSK-3 y beta; Se infundieron durante 2 semanas en el ventrículo lateral derecho de ratones no transgénicos y los niveles de mRNA evaluadas en la corteza frontal / temporal derecho. Reproducido con permiso de la Sociedad Americana para la Investigación Clínica. Haz clic aquí para ver más grande la figura .
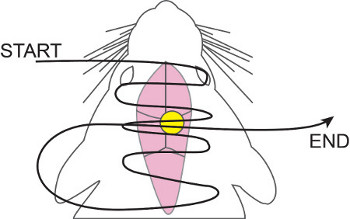
Figura 5. Ejecución de sutura de colchonero horizontal. 5-0 hilo de sutura de nylon se teje dentro y fuera de la piel, a partir de trabajo anterior y posterior, concentrándose más sobre la cánula. Una vez que han alcanzado el punto más posterior, el hilo de sutura se lleva entonces una copia de seguridad y se pasa a través de la cánula una vez más. Esto asegura el cierre correcto de la herida e impide que la cánula / tubo de trabajo a través de la piel.
Discusión
La capacidad de entregar drogas a nivel mundial en el SNC como se muestra en el video es una técnica extremadamente poderosa que es fácil de aprender y utilizar. Con la práctica, una sola implantación de la bomba o un ICV bolo se puede completar en 10 minutos, lo que permite grandes cohortes de ratones para ser tratados al mismo tiempo. Esto es especialmente útil para los estudios con una lectura de comportamiento, como números más grandes para el comportamiento del ratón son críticos para ayudar a ver diferencias significativas.
En base a nuestras experiencias a través de la entrega de OSS bombas y las inyecciones de bolo, hemos observado algunas ventajas y desventajas de cada método. Debe tenerse en cuenta que estas son las opiniones en nuestro laboratorio y pueden no ser cierto para todos los modelos de ratón y de rata.
Encontramos una ventaja de la utilización de las bombas es su capacidad para ofrecer una alta cantidad de ASO desde la ASO se distribuye durante un período de tiempo mucho más largo. Esto por lo general equivale a la caída ya sostenida o después de empalme activaASO infusión, aunque esto puede no ser siempre el caso. Las bombas también permiten un marco de tiempo precisa de la entrega ASO (14 días, 28 días, o 42 días) y las bombas pueden ser cambiados una vez para permitir la infusión de ASO incluso más tiempo activo. Sin embargo, nos hemos dado cuenta de que el cambio de las bombas de más de una vez aumenta la variabilidad debida a la formación de bolsillos fibrosos alrededor de la bomba que impiden que la bomba de absorción de fluido correctamente. Una desventaja de las bombas es que algunos ratones no toleran la bomba, así como otros. Si la línea transgénica que está trabajando es más frágil, una bomba puede ser demasiado engorroso. Las bombas también tienen que ser eliminados después de la infusión final, sometiendo a los ratones a otra cirugía y la anestesia añadido. Si haciendo el trabajo comportamiento, es especialmente importante para eliminar la bomba y permitir que por lo menos 1-2 semanas de recuperación ya que la presencia de la bomba afectará a algunos comportamientos en los ratones.
Con ICV inyecciones en bolo, una de las ventajas es el costo. Hay unainversión inicial para la compra de las jeringas y agujas, pero con el tiempo, las inyecciones de bolo son más rentables, ya que no hay bombas / tuberías / catéteres para comprar. En general, hay menos hasta-mantener las inyecciones de bolo ICV, debido a la falta de cánulas y bombas. También encontramos que bolo ICV se pueden utilizar para entregar OSS a los ratones más jóvenes frágiles y / o más. Una desventaja de la ICV bolo es que se trata de una sola inyección. No tanto ASO general se puede entregar a través de esta ruta, y si la duración de la acción de la ASO se utiliza es corto, los efectos desmontables / empalme también será de corta duración.
Tanto las bombas osmóticas, así como los bolo ICV tienen la capacidad de entregar OSS que puede proteínas desmontables o alterar empalme de genes en todo el SNC de roedores, una técnica que tiene amplias aplicaciones en múltiples campos de la neurociencia relacionados. Sugerimos pilotando ambos métodos de entrega si no está seguro de que la vía de administración es el más adecuado para su sestudio ESPECÍFICOS.
Divulgaciones
Los autores reciben sus oligonucleótidos antisentido de Isis Pharmaceuticals.
Agradecimientos
Nos gustaría dar las gracias a Curt Mazer de Isis Pharmaceuticals para la prestación de asesoramiento relacionados con la cirugía de ICV bolo, así como Isis Pharmaceuticals en su conjunto para el suministro de nuestro laboratorio con OSS. Además, nos gustaría dar las gracias a Carey Shaner por revisar este artículo. TMM y SLD son apoyados por NIH subvenciones P50AG005681, K08NS074194 y R01NS078398.
Materiales
| Name | Company | Catalog Number | Comments |
| PREPARING ALZET OSMOTIC PUMPS | |||
| Alzet Osmotic Pump 14 days | DURECT | Model 1002 | |
| Alzet Osmotic Pump 28 days | DURECT | Model 2004 | |
| Alzet Osmotic Pump 42 days | DURECT | Model 2006 | |
| 2.5 mm Catheters | PlasticsOne | 3280PM/SPC | Custom ordered to 2.5 mm Catheter Length |
| Vinyl Catheter Tubing | DURECT | 7760 | ID: 0.027", OD: 0.045" |
| 0.9% Sodium Chloride, Irrigation, USP | Baxter | 2F7124 | NOT to be used in pumps or tubing |
| 0.9% Sodium Chloride, Injection, USP | Hospira | NDC 0409-4888-10 | |
| p60 Petri Dish (Sterilized) | TRP | 93060 | |
| Surgical Blades (Sterile) | Butler Schein | #007319 | |
| Latex Surgical Gloves (Sterile) | Micro-Touch | CatNo will depend on size of the gloves needed | |
| Sterile Towel Drape | Dynarex | 4410 | |
| .2um Syringe Filters | PALL | 4192 | |
| 1 ml Syringe (Sterile) | BD | 309625 | |
| 50 ml Conical Tubes | |||
| 100% Ethanol | |||
| PUMP & BOLUS SURGERY PROTOCOLS | |||
| Curved Forceps | Fine Science Tools | 11001-12 | |
| Curved Hemostat | Fine Science Tools | 13009-12 | |
| Fine Sharp Scissors | Fine Science Tools | 14060-09 | |
| Curved Blunt Scissors | Fine Science Tools | 14029-10 | |
| Bone Cutter | Fine Science Tools | 16104-14 | |
| Straight Hemostat | Fine Science Tools | 12002-12 | |
| Syringe | Hamilton | 7653-01 | 10 μl gas-tight with removable needles |
| Needles | Hamilton | 7758-04 | 26 gauge, Point Style: 2 |
| 5-0 Nylon Suture Thread | Covidient | SN-871 | |
| Alcohol Pads | Select | #521 | |
| Cotton Swabs (sterile) | Puritan | REF 806-WC | |
| Super Glue | Loctite | Longneck Bottles | |
| CAUTION: FastGreen Dye | Sigma | F7252-5G | Wear Eyeshields and Gloves when handling this product |
| Antibiotic Cream | |||
| Eye Ointment | |||
| Electric Shaver | |||
| 70% Ethanol | |||
| 10% Provadone Iodine | |||
| 3% Hydogen Peroxide | |||
| Warming Pad | |||
| Bead Sterilizer | SouthPointe Surgical | GRM5-1450 | |
| Small Animal Stereotaxic | Kopf | Model 940 | |
| Nose Cone | Kopf | Model 923-B | |
| Ear Bars | Kopf | Model 921 | This model is optional |
| Cannula Driver | Kopf | Model 1966 | |
| Syringe Holder | Kopf | Model 1972 | |
| Temperature Control System | Kopf | Model TCAT-2LV | Optional |
| Oxygen/Isoflurane System | |||
Referencias
- Crooke, S. T., Bennett, C. F. Progress in antisense oligonucleotide therapeutics. Annual Review of Pharmacology and Toxicology. 36, 107-129 (1996).
- Sazani, P., Kole, R. Therapeutic potential of antisense oligonucleotides as modulators of alternative splicing. The Journal of Clinical Investigation. 112 (4), 481-486 (2003).
- Taylor, J. P., Hardy, J., Fischbeck, K. H. Toxic Proteins in Neurodegenerative Disease. Science. 296 (5575), 1991-1995 (2002).
- Ross, C. A., Poirier, M. A. Protein aggregation and neurodegenerative disease. Nature Medicine. 10, S10-S17 (2004).
- Miller, T. M., Smith, R. A., Kordasiewicz, H., Kaspar, B. K. Gene-Targeted Therapies for the Central Nervous System. Archives of Neurology. 65 (4), 447-451 (2008).
- Vickers, T. A., Koo, S., Bennett, C. F., Crooke, S. T., Dean, N. M., Baker, B. F. Efficient Reduction of Target RNAs by Small Interfering RNA and RNase H-dependent Antisense Agents. The Journal of Biological Chemistry. 278, 7108-7118 (1074).
- Smith, R. A., Miller, T. M., et al. Antisense Oligonucleotide therapy for neurodegenerative disease. The Journal of Clinical Investigation. 116 (8), 2290-2296 (2006).
- Rosen, D. R., Siddique, T., et al. Mutations in Cu/Zn superoxide disumutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 6415-62 (1993).
- Haidet-Phillips, A. M., Hester, M. E., et al. Astrocytes from familial and sporadic ALS patients are toxic to motor neurons. Nature Biotechnology. 29, 824-828 (2011).
- Furukawa, Y. Pathological roles of wild-type Cu,Zn-superoxide dismutase in Amyotrophic Lateral Sclerosis. Neurology Research International. 2012, 1-6 (2012).
- Hua, Y., Sahashi, K., et al. Antisense correction of SMN2 splicing in the CNS rescues necrosis in a type III SMA mouse model. Genes and Development. 24, 1634-1644 (2010).
- Passini, M. A., Bu, J., et al. Antisense Oligonucleotide Delivered to the Mouse CNS Ameliorate Symptoms of Severe Spinal Muscular Atrophy. Science Translational Medicine. 3 (72), (2011).
- Kordasiewicz, H. B., Stanek, L. M., et al. Sustained Therapeutic Reversal of Huntington's Disease by Transient Repression of Huntingtin Synthesis. Neuron. 74 (6), 1031-1044 (2012).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586 (2011).
- Planel, E., Richter, K. E. G., et al. Anesthesia Leads to Tau Hyperphosphorylation through Inhibition of Phosphatase Activity by Hypothermia. The Journal of Neuroscience. 27 (12), 3090-3097 (2007).
- Southwell, A. L., Skotte, N. H., Bennett, C. F., et al. Antisense oligonucleotide therapeutics for inherited neurodegenerative diseases. Trends in Molecular Medicine. , (2012).
- Kole, R., Krainer, A. R., Altman, S. RNA therapeutics: beyond RNA interference and antisense oligonucleotides. Nature Reviews Drug Discovery. 11, 125-140 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados