Method Article
El uso de escáneres planos para recopilar de alta resolución de duración transcurrido Imágenes de la gravitrópica Respuesta Arabidopsis Root
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un proceso para la toma rápida de imágenes de plantas de semillero de Arabidopsis en respuesta a un estímulo de gravedad, utilizando escáneres planos disponibles en el mercado. El método permite barato, la captura de grandes volúmenes de imágenes de alta resolución susceptibles de algoritmos de análisis de aguas abajo.
Resumen
Los esfuerzos de investigación en biología exigen cada vez más el uso de metodologías que permitan la recolección de grandes volúmenes de datos de alta resolución. Un reto laboratorios pueden enfrentar es el desarrollo y el logro de estos métodos. Observación de los fenotipos en un proceso de interés es un objetivo típico de los laboratorios de investigación que estudian la función del gen y esto se logra a menudo a través de captura de imagen. Un proceso particular que se presta a la observación utilizando enfoques de imagen es el crecimiento correctivo de una raíz de plántulas que se ha desplazado de la alineación con el vector de gravedad. Plataformas de imágenes que se utilizan para medir la respuesta gravitrópica raíz puede ser costoso, relativamente baja en el rendimiento y / o mano de obra. Estas cuestiones se han abordado mediante el desarrollo de un método de captura de imagen de alto rendimiento utilizando todavía en alta resolución, escáneres de bajo costo, de superficie plana. Usando este método, las imágenes se pueden capturar cada pocos minutos a 4800 dpi. La configuración actual permite la recolección de 216 r individuoesponses por día. Los datos de imagen recogidos son de amplia calidad para aplicaciones de análisis de imágenes.
Introducción
Recogida de datos fenotípicos de alta resolución es útil en los estudios que tienen como objetivo comprender la interacción de la genética y el medio ambiente en la mediación del organismo función 1,2. Los estudios de esta naturaleza también son inherentemente de gran escala, por lo que es necesario, además, que los métodos empleados para medir fenotipos en este contexto ser altos en el rendimiento de 3,4. En el establecimiento de métodos para la investigación phenomics escala, intercambios entre la salida y la resolución entran en juego. Métodos que son más altos en el rendimiento también tienden a ser más bajos en la resolución, por lo que es más difícil de detectar pequeños efectos de la genética o el medio ambiente 5. Alternativamente, los métodos que miden más cuidadosamente un fenotipo deseado también tienden a ser menores en el rendimiento, por lo que es difícil para medir los efectos genéticos y ambientales ampliamente. Además, los métodos manuales para la cuantificación de fenotipos, incluyendo inspección visual, pueden estar sujetas a variación debido a las diferencias en los ingresos per humanacepción 6.
Tecnologías de la imagen pueden proporcionar un puente útil entre el rendimiento y la resolución en la obtención de observaciones fenotípicas 7-9. En general, una imagen es relativamente fácil de capturar, facilitando el rendimiento, y cuando se toma en suficiente resolución, fenotipos sutiles se puede detectar 1,2,7. Tecnologías de la imagen tienden a ser modificable para adaptarse a un sistema o proceso de interés y son generalmente escalable 10-12. Debido a esto, las tecnologías de imágenes son ideales para el desarrollo de estudios a gran escala de la función del organismo.
La respuesta de la raíz primaria a un estímulo gravedad es un proceso fisiológico complejo que se produce dentro de un órgano morfológicamente sencilla. La respuesta implica la activación de vías de señalización que se propagan a través del órgano de la raíz y su progresión está determinada por factores genéticos y ambientales, incluyendo factores genéticos influenciados por el ambiente 12-14 . La respuesta de la raíz primaria a un estímulo gravedad se ha estudiado por lo menos desde Darwin, todavía hay mucho que aprender acerca de cómo funciona, sobre todo en los primeros eventos de señalización y en los factores que median la respuesta plasticidad 12,14,15. Obtener un conocimiento detallado de la dinámica de esta respuesta es importante en la búsqueda de formas de mejorar la capacidad de las plantas de semillero para convertirse exitosamente establecida dentro de un entorno determinado 16. Además, la forma de la raíz hace que sea susceptible para aplicaciones de procesamiento de imágenes 8,12,17. Tomados en conjunto, la respuesta gravitrópica raíz es un sistema ideal para el desarrollo de la tecnología de formación de imágenes de alto rendimiento para el propósito de llevar a cabo estudios de genómica a nivel de la función del organismo.
En este informe se presenta un alto rendimiento, método de alta resolución de captura de imagen de la respuesta gravitrópica raíz utilizando escáneres planos baratos, disponibles en el mercado. La visión general de laprotocolo se muestra en la Figura 1. Las plántulas sembradas en placas de agar se colocaron sobre los escáneres planos orientados verticalmente equipados con los titulares de plexiglás de encargo de la placa. Las imágenes se recogieron cada pocos minutos a 4800 dpi y se guardan en una unidad local o en el servidor de datos. Metadatos asociados con cada serie de imágenes se almacena en una base de datos y las imágenes almacenadas se procesan. El método utiliza el software VueScan para la captura de imágenes. VueScan puede ser utilizado para ejecutar más de 2.100 escáneres diferentes en Windows, Mac, o sistemas operativos Linux (ver Tabla de Materiales). Se utilizó una resolución del escáner de 4800 ppp en esta aplicación para que coincida con la resolución alcanzada en los estudios anteriores utilizando cámaras CCD fijas 1,8,12. La flexibilidad del software VueScan junto con la interfaz común se utiliza para cualquier escáner se ejecuta permite a los usuarios adoptar fácilmente prácticamente cualquier hardware del escáner de suficiente resolución para el protocolo presentado en este documento. Rendimiento actual permite la colección de216 respuestas individuales por día. La tecnología es adaptable y escalable para su uso en las instituciones que van a escuelas preparatorias para investigar universidades. Además, las imágenes recogidas son de calidad suficiente para aplicaciones de análisis de imagen.
Protocolo
1. Imagen de protocolo de toma
Consideraciones:
Este protocolo se lleva a cabo de manera más eficiente con dos personas, aunque es posible para uno de trabajar solo. El acuerdo de trabajo mejor en este laboratorio era para una persona para preparar platos para el escaneo mientras que otros trabajos sobre la configuración del escáner, luego ambos trabajan juntos para colocar las placas en los escáneres e iniciar el proceso de escaneado.
También es importante señalar que los escáneres en este proyecto están orientados verticalmente con las tapas de escáner de descanso en la parte posterior del escáner. Se realizó un soporte personalizado para mantener los platos en esta posición vertical y se fija a la superficie de superficie plana con Tiras Command 3M (Figura 2). La cubierta de documentos desmontable que viene con el escáner utilizado en este protocolo (un Epson V700) estaba forrada por una cara de fieltro negro. La cubierta de documentos se posicionó en contra de la superficie plana con una cuerda elástica paramantener las placas en su lugar y para proporcionar contraste de la imagen (figura 3).
Cualquier escáner de suficiente resolución podría ser utilizado para la captura de imagen. La perfección V700 de Epson fue elegido debido a su perfil de la plaza (por lo que es fácil de colocar en posición vertical), su alta resolución y las opciones adicionales para escanear desde el tanto de la cama y la tapa y utilizar el canal infrarrojo. Estas opciones adicionales que no fueron utilizadas en este protocolo.
Una vez que las placas han sido retirados de la cámara de crecimiento, es imperativo que el protocolo de continuar hasta el final.
Preparación Plate
Se utilizaron placas de Petri estándar que contiene 10 ml de medio transparente y 9 semillas plantadas a través del centro de cada plato. Los procedimientos para el etiquetado de placas, preparación de medios y la siembra se puede encontrar en: http://www.doane.edu/doane-phytomorph
- Recuperar la primera placa de agar y absorber la condensación recogida en la tapa y el borde de la tapa de la placa de agar con un Kimwipe.
- Aplicar de Triton X-100 (un detergente) a la tapa con un Kimwipe - ser generoso.
(Tenga en cuenta que Triton X-100 ayuda a prevenir la acumulación de condensación en la tapa cuando la placa se escanea. Una aplicación generosa (lo suficiente para crear una película sobre la superficie de la tapa) le ayudará a asegurarse de que la tapa permanece transparente durante todo el plazo del escáner .) - Envolver la placa con cinta de microporos para asegurar la tapa, y para permitir la ventilación.
Configuración del escáner y la colección de imágenes
Este protocolo asume que se está usando más de 1 escáner, y proporciona instrucciones para iniciar varios escáneres desde un único equipo.
- Crear carpetas para almacenar imágenes de cada escáner. Cada escáner celebrará dos platos, así que tenga esto en cuenta al crear carpetas. Unopodrían optar por utilizar los metadatos como componentes del nombre de archivo, como identificadores únicos para cada placa, edades de plántulas, tamaño de la semilla, y los identificadores de las poblaciones de plantados. Un ejemplo de un nombre de carpeta utilizado en la recogida de datos que contiene estos metadatos es "1652-2-SM-9-92-17-1653-2-LG-88-79-161".
- Establecer temporizadores de salida para el tiempo recogiendo designado (9 hr fue utilizada en este laboratorio). Asegúrese de ajustar el tiempo extra (una hora aproximadamente) para la preparación.
(Tenga en cuenta que los escáneres deben ser conectados a los temporizadores de salida con el fin de establecer el tiempo de adquisición. Mientras que el software VueScan permite a un usuario para recoger imágenes en repetidas ocasiones, que no permite al usuario indicar la cantidad de imágenes para cobrar o por cuánto tiempo para recoger imágenes de .) - Encienda el primer escáner y esperar aproximadamente 10 segundos para el escáner para ir a través de sus primeros calentamientos.
- Abra el programa VueScan vez. VueScan 9.0.20 versión fue utilizada en este protocolo (véase la Tabla de Materiales), aunque las versiones más recientes se pueden utilizar con poco modificción. Asegúrese de que el botón "Más" se ha pulsado en el panel inferior de la interfaz de usuario con el fin de mostrar las opciones del menú que se describen a continuación.
- Establezca la repetición automática: cuadro desplegable a ninguno en la ficha de entrada y en la pestaña de cultivos establecido área Vista previa: para máxima (Figura 4). Presione en 'Vista previa'.
- Crear un cuadro de recorte que capturaría la región de interés utilizando el ratón para hacer clic y arrastrar a través de la región de interés en la imagen de vista previa. Los ajustes pueden ser alterados por la región de interés en la ficha Recortar. Los ajustes típicos utilizados para el cuadro de recorte fueron: desplazamiento x-0.675; y-desplazamiento en 1.924, aunque éste se ajustó a capturar el área de plántulas para cada escáner. El tamaño de la casilla de recorte utilizado fue 7.246 en ancho por 1,1 de altura (Figura 5).
- Para mover el cuadro de recorte, mantenga pulsada la tecla Mayús mientras arrastra con el ratón. Asegúrese de que el cuadro de recorte contiene todas las plántulas a digitalizar más cualquier metadatos deseado que pudiera estar contenida en una etiqueta (Figura 5).
- En la pestaña de cultivos, establecer el área de vista previa: a la caja de los cultivos y el Pulse 'Vista previa'.
- Ir a la ficha Salida y seleccione el archivo correcto para el escáner (Figura 5).
- Repita los pasos 1.7 a 1.12 en todos los escáneres de un ordenador. Elija la opción "sí" cuando se le pregunta si desea abrir más de una instancia de VueScan.
- Ir a través de cada ficha y comprobar la configuración es correcta. (Tenga en cuenta que los especificaciones pueden modificarse para adaptarse a las necesidades de cada laboratorio incluyendo el color de imagen, resolución, etc. Sin embargo, los valores utilizados en este protocolo pueden aplicarse directamente a la particular escanear el hardware de un laboratorio dado debido a la interfaz común del software VueScan. Consulte la lista de especificaciones adjunta para ver los parámetros utilizados en este proyecto, utilizando la versión 9.0.20 VueScan).
- En la pestaña Input elegir continua en la repetición automática: campo, o elija un intervalo de tiempo más largo entre las imágenes si así lo desea. El intervalo de tiempo es la longitud de tiempo que el escáner se detiene después de guardar la última imagen y comenzar la recolección de la siguiente imagen. En el modo continuo, 3-4 min resolución se puede obtener en 4800 dpi.
- Repita los pasos 1.14 a 1.15 para el resto de los escáneres conectados a un solo ordenador.
- Coloque las placas preparadas en los escáneres correctas con plántulas orientados horizontalmente (no gravistimulate).
- Coloque temporalmente un negro, fieltro fondo contra las placas para que no se caigan de la plantilla de plexiglás. Repita el procedimiento para exploraciónsocios.
(Nota: En este proyecto, las piezas negras de fieltro se adjunta al documento cubre suministra con el equipo para evitar el deslumbramiento y para proporcionar un contraste contra el tejido de la raíz El color de fondo específico utilizado dependerá del color del tejido que se va a ver.). - Haga que una persona a su vez las placas de 90 ° (placas se volvieron hacia la izquierda en este protocolo) y de inmediato reemplazar el fondo de fieltro.
- La otra persona debe estar de pie frente a la computadora para que puedan inmediatamente presione el botón 'Scan'.
- Asegure los antecedentes del escáner con una cuerda elástica (Figura 3). Haga que una persona sostenga el fondo en su lugar mientras otra posición el cable de bungee.
(Nota: Inmediatamente después gravistimulation (rotación de las placas a 90 °) y la colocación del fondo de fieltro, 'Scan' debe ser presionado). - Repetir los pasos 1.17 a 1.21 para el resto de los escáneres en un solo ordenadoreser.
- Repita los pasos 1.6 a 1.22 para la siguiente serie de escáneres de corresponder.
- No deje que los escáneres hasta varias imágenes han sido recogidos para asegurarse de que están ahorrando correctamente.
- Es ideal para mantener a los lectores en un área que va a estar libre de perturbaciones para el tiempo de exploración designada. También es prudente considerar las condiciones ambientales en el área de exploración para asegurar respuestas ideales fenotípicas.
- Cuando la recogida de datos se ha completado, pulse el botón de anulación verde en cada ventana VueScan que coincide con cada escáner.
- Cierre de todos los programas en el equipo.
- Reinicie el equipo y apague todos los escáneres antes de iniciar una nueva ronda de la colección de imágenes.
Resultados
Imágenes representativas
Este enfoque permite una rápida producción de series de tiempo de alta resolución de crecimiento de las plántulas de Arabidopsis. Imágenes primero y último de una corrida escáner se muestran en las figuras 7A y 7B. Figuras 7C y 7D muestran resultados óptimos a partir de la mitad de una imagen de escáner completo. Algunas cuestiones que pueden afectar a la calidad de imagen se muestran en las Figuras 7A y 7B. Estos temas incluyen la variación en la germinación, la variación en la trayectoria de crecimiento de las plántulas en el inicio de la carrera, y la acumulación de condensación durante el escaneo. La condensación puede ser resuelto en gran medida mediante el aumento de la cantidad de Triton X-100 se aplica a la parte interior de la tapa de la placa. Otros factores que podrían inhibir la colección de imágenes precisas son la configuración incorrecta del cuadro de recorte con respecto a las placas de posición de la placa y de posicionamiento de manera que están sesgadas con respecto al cuadro de recorte.
Aplicación de Análisis de Imagen: Compresión de imagen
Una vez se ha obtenido una secuencia de tiempo de las imágenes de escáner, debe ser almacenado de forma segura en una forma accesible de la red para facilitar el análisis de imágenes. Los archivos de imagen asociados con un avance de exploración individual ocupan una cantidad significativa de espacio en el disco duro. Un solo archivo TIFF recogida en 4800 dpi es de unos 220 MB y una carrera escáner típico genera 200 archivos de imagen. Por lo tanto, alrededor de 44 GB de espacio en disco duro es necesario por corrida. Para reducir los costes de almacenamiento y de transmisión de red asociados con análisis de imagen es deseable para reducir la cantidad de espacio necesario para almacenar datos de imagen, mientras que al mismo tiempo reducir al mínimo la pérdida de datos. Análisis Downstream implicará la identificación de cada plántula en archivos de imágenes posteriores asociados a una prueba experimental. Por lo tanto, la segmentación a cabo una plántula de la imagen del escáner se puede facilitar el análisis de aguas abajo. Debido a la segmentación de la plántula lejos del resto de the imagen también puede reducir significativamente el almacenamiento de fondo innecesarios pixeles, este enfoque también conduce a una reducción significativa en el tamaño de datos. Además, si el análisis de aguas abajo se centra en tejido de la raíz que puede no ser necesario retener la información de color desde los píxeles de raíz son relativamente estrecho en su espacio de color. Un protocolo de procesamiento de imagen de la computadora y el código para reducir el tamaño de los datos tanto por segmentar a cabo plántulas individuales y convertir imágenes a escala de grises se ha desarrollado. El enfoque da como resultado una reducción del 60% en los requisitos de espacio de almacenamiento.
El flujo de trabajo utilizado para lograr esta compresión de datos se describe en los siguientes pasos:
- Comience con una serie de tiempo de los archivos de imagen de escáner en una sola carpeta.
- Para cada imagen, convertir de RGB a escala de grises (Figura 8, arriba).
- Dividir la imagen en los lados izquierdo y derecho.
- Extraiga cada plántula de la imagen en su propio archivo (Figura 8).Esto se hace mediante la aplicación de un umbral para convertir píxeles a negro o blanco y luego el cálculo de la intensidad total de píxeles de cada fila de imagen. La fila con la mayor intensidad se identifica y cada píxel se clasifica como 'planta' o 'nonplant' basado en la intensidad de sus vecinos. El centro de cada 'planta' dentro de esta fila se encuentra y desde ese momento un cuadro de recorte de un tamaño predeterminado se dibuja (Figura 8, abajo).
- Crear una carpeta separada para cada lado de la imagen (izquierda y derecha) con subcarpetas separadas para cada plántula para el almacenamiento de archivos de imágenes de series de tiempo individual.
- Archive las carpetas resultantes en un archivo ZIP comprimido.
Es un código que lleva a cabo estos pasos se ha desarrollado utilizando el lenguaje de programación Python 20. El algoritmo permite una reducción de aproximadamente 60% en el tamaño de datos y tiene éxito en la identificación de todas las plantas de semillero individuales en 90% de la imag escánerarchivos electrónicos analizados hasta el momento. Los códigos están disponibles gratuitamente para su descarga bajo la Licencia Pública General GNU versión 3 (véase la Tabla de Materiales).
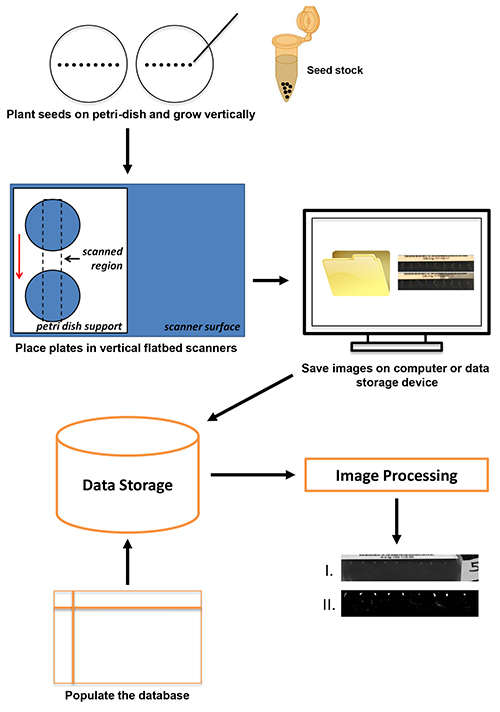
Figura 1. El procedimiento de exploración se inicia con la siembra de la semilla (hasta nueve semillas de Arabidopsis por placa) y termina con el almacenamiento de datos y procesamiento de imágenes. Haga clic aquí para ver la imagen más grande .
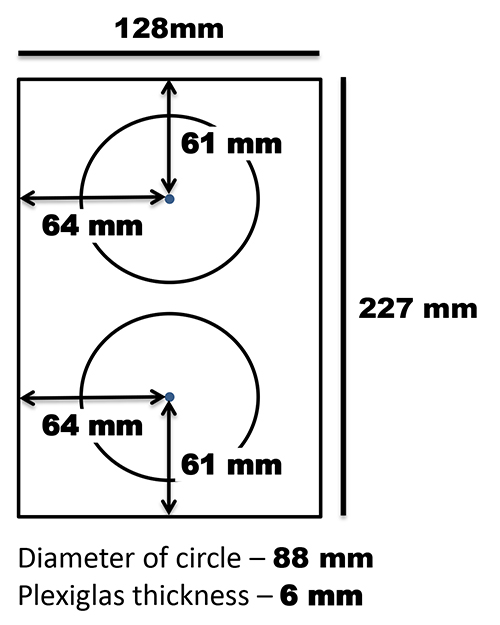
Figura 2. T emplate para la construcción de apoyo para la placa de Petri. Ple xiglas se cortan de tal manera que la anchura encaja la superficie plana (en este caso 227 mm) y la longitud era de 128 mm. Dos círculos con un diámetro de 88 mm se cortaron de la pieza restante de tal manera que se distribuyeron de manera uniforme a lo largo de la anchura y la longitud del soporte. El soporte se fija a la superficie plana con Tiras Command 3M. Haga clic aquí para ver la imagen más grande .

Configuración del escáner Figura 3. Después de plántulas han sido gravistimulated y la cubierta de documentos colocados. Esta es la configuración del escáner en el paso 1.21 de configuración del escáner y de la colección de imágenes."_blank"> Haga clic aquí para ver la imagen más grande.
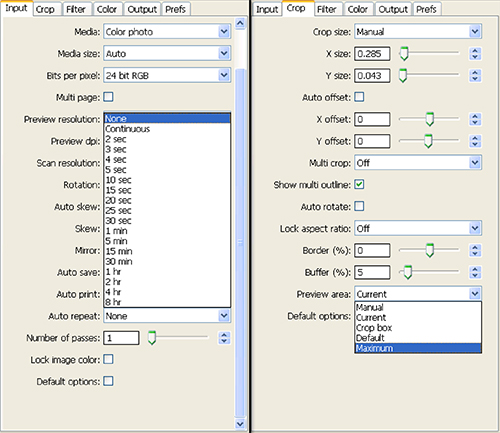
Figura 4. Captura de pantalla de los ajustes seleccionados para el paso 1.8 de configuración del escáner y de la colección de imágenes. Haga clic aquí para ver la imagen más grande .

Figura 5. Captura de pantalla del software VueScan durante los pasos 1.9 y 1.10 de la configuración del escáner y de la colección de imágenes. El cuadro rojo destaca el tamaño de la cosecha, mientras que la caja azul se destacan los ajustes específicos fo r x-e y-offset se utiliza con el fin de capturar las plántulas y la información de la etiqueta. La región de la cama plana para digitalizar se muestra como una línea de puntos en el área de vista previa. Haz clic aquí para ver la imagen más grande .
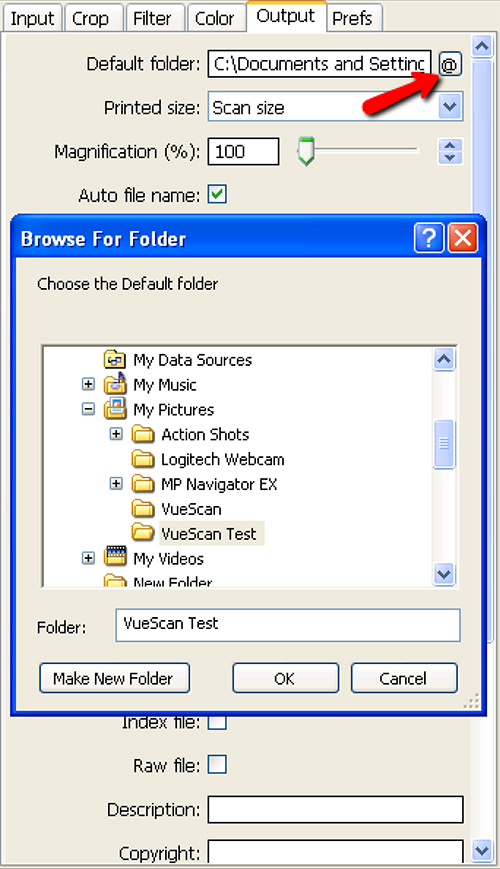
Figura 6. Selección de la carpeta de destino para el paso de 1,12 de configuración del escáner y de la colección de imágenes. Al pulsar el botón @ junto al cuadro de diálogo Buscar carpeta por defecto (flecha roja) permite al usuario seleccionar la carpeta de destino adecuado. Haga clic aquí para ver la imagen más grande .
re 7 "fo: content-width =" 5in "fo: src =" / files/ftp_upload/50878/50878fig7highres.jpg "src =" / files/ftp_upload/50878/50878fig7.jpg "width =" 600px "/>
Figura 7 (AD). Las imágenes anteriores son ejemplos de los recogidos utilizando el método descrito en este artículo. Paneles A, B y C, D son los primeros y finales imágenes, respectivamente, a partir de un único período de exploración. A, B muestran la completo del área de escaneado, mientras que C, D son una región recortada de la zona explorada, mostrando una sola placa. Varias inconsistencias pueden ser observados. El panel A muestra la variación en la germinación y en la trayectoria de crecimiento. Grupo B (los mismos plántulas como imagen; 9 horas posteriores) muestra que las placas se pueden acumular condensación. Los paneles C y D se consideran buenos resultados debido a la sólida o crecimientof plántulas y la calidad de imagen a lo largo de la carrera. Haz click aquí para ver la imagen más grande .
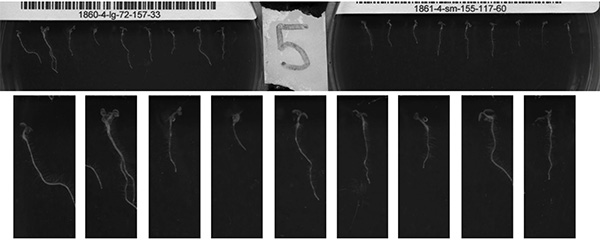
Figura 8. El algoritmo de compresión de imágenes que creó convierte una imagen de escáner a escala de grises (arriba). La imagen se divide en mitades derecha e izquierda y se eliminan bordes de la imagen (no se muestra). Las posiciones de las plántulas individuales de cada medio se identifican mediante la búsqueda de la fila con la intensidad de píxel total más grande. Esas posiciones se utilizan para definir una nueva área de recorte, se aplica a todas las plantas de semillero en la placa (abajo). Haga clic aquí para ver la imagen más grande .
Discusión
La observación fenotípica exacta es crucial para la comprensión de las manifestaciones de la función de genes dentro de un organismo. Una forma de adquirir información fenotípica es a través de la captura de datos de imagen de alta resolución. La plataforma basada en el escáner desarrollado ha permitido la recolección de muchas imágenes (200 imágenes / período de exploración) en alta resolución (4800 dpi) durante un número de horas. Además, esta plataforma se adapta fácilmente a una variedad de entornos de laboratorio y de la clase debido a la flexibilidad del software VueScan para funcionar miles de diferentes escáneres utilizando una interfaz común 18.
El método que aquí se presenta llena un vacío en el alto rendimiento de captura de imagen que se extiende desde las grandes instalaciones de fenotipado de escala y los sistemas automatizados implementables en un solo laboratorio. Las plataformas de alto rendimiento disponibles en la actualidad tienden a usar el hardware de imágenes especializado, incluyendo cámaras montadas sobre soportes robóticos, para capturar imágenes de alta resolución de primarily arriba tejidos vegetales del suelo (por ejemplo, Centro para la Planta de Tecnología Integrativa y el Scanalyzer HTS por LemnaTec) 20,21. Sistemas de imagen especializados que utilizan tecnologías de resonancia magnética de rayos X y también se han desarrollado para la imagen de abajo tejidos de tierra con notable resolución a medida que crecen en el ambiente del suelo (por ejemplo, el Centro de Tecnología Integrativa Vegetal) 11,22,23. Este desarrollo de la tecnología más especializada es generalmente a costa de rendimiento, por lo que los estudios fenotípicos dinámicos más difícil. Es importante destacar que las necesidades de coste y de infraestructura para estas plataformas de gama alta hacen inviable principalmente para su aplicación en los laboratorios más pequeños.
Plataformas también se han desarrollado, que utilizan la tecnología de captura de imágenes más estándar y son muy adecuadas para la medición de las respuestas dinámicas tales como la respuesta a un estímulo de la raíz de la gravedad. Por ejemplo, las cámaras CCD se han utilizado para capturar las respuestas de plántulas individuales a la luz y la gravedad en alto1,8,12 resolución espacial y temporal. Otros sistemas se han desarrollado lo que permite la medición de la orientación de la punta de la raíz de las múltiples raíces de una sola imagen (por ejemplo RootTipMulti por la iPlant Collaborative) 17,24. En el primer caso, el rendimiento es relativamente bajo dado que sólo una plántula se crea una imagen por cada cámara a la vez, mientras que en el último caso el rendimiento es superior, pero generalmente a costa de la resolución.
El procedimiento descrito en este artículo se presenta una plataforma para la captura de imágenes de alta resolución en un alto rendimiento con equipos y software que son fácilmente disponibles y relativamente asequible. Utilizando esta configuración, 1.080 respuestas individuales de raíz se pueden recoger cada semana en un único laboratorio equipado con una batería de seis escáneres. En 15 meses de recogida de un promedio de 864 respuestas individuales a la semana, un total de 41.625 plantas de semillero se analizan en busca de un estudio de la genómica. Alrededor del 15% de las colecciones individuales falló debido a un error de configuración, Nefracaso rk o mal funcionamiento del equipo. Otro 22% de respuestas fracasaron debido a la falta de germinación o crecimiento de las raíces insuficiente para provocar una respuesta de crecimiento. El último conjunto de datos consta de 27.475 respuestas de plántulas individuales a un estímulo gravedad desde 163 líneas endogámicas recombinantes, además de 99 líneas casi isogénicas. Los datos fueron recogidos en un solo laboratorio, haciendo de este un enfoque de muy alto rendimiento. Incluso teniendo en cuenta que los equipos utilizados para la adquisición es relativamente barato, que ha funcionado de forma fiable durante más de dos años, incluso con un uso intensivo.
Aunque este protocolo ha sido muy útil para los objetivos de investigación de este grupo, todavía existen algunas limitaciones. Debido a el rendimiento de alrededor de 50 GB de datos de imagen sin comprimir por día, era evidente que se necesita una gran cantidad de espacio a las imágenes de la casa a menos esquemas de compresión eficaces podrían desarrollarse. El problema de almacenamiento se resolvió temporalmente mediante la compra de discos duros externos para cada equipo. Además, dos 1Red 0 TB dispositivos de almacenamiento asociados fueron adquiridos. Más tarde, se desarrollaron algoritmos de compresión, como se describió anteriormente, que puede ayudar a reducir el tamaño de los datos hasta en un 60% (Figura 8). Es importante señalar que la velocidad a la cual los datos pueden ser guardados en un dispositivo de almacenamiento asociado red depende de la velocidad de la conexión de red. Esquemas de compresión también se han visto limitadas por el deseo de evitar la pérdida de datos de imagen.
También se están considerando otras limitaciones propias de un sistema de imagen basado en el escáner. Por ejemplo, en un enfoque basado en el escáner de plántulas están expuestos a luz de alta intensidad en los rangos blanco y potencialmente infrarrojos durante cada exploración. Esto probablemente afecta el crecimiento de las plántulas, aunque las plántulas todavía se pueden observar a someterse respuestas sólidas a un estímulo gravedad (Figura 7). Una mejora en el futuro podría incluir la programación de este tipo de escáneres que sólo LEDs infrarrojos están activos. Un área en la developmen activot es la creación de algoritmos de análisis y de concordancia con la resolución y el rendimiento de estos datos de la imagen. El gran conjunto de datos generados con este método basado en el escáner ha sido ideal para el desarrollo de herramientas robustas para el alto rendimiento fenotipificación de las imágenes de plántulas. El algoritmo de compresión empleado en estas imágenes que se muestran en la Figura 7 es compatible con la afirmación de que son susceptibles a aplicaciones de análisis de imagen. Además, las imágenes generadas pueden ser analizados por el algoritmo previamente publicado, RootTrace 17,24, si se recogen en una resolución más baja (menos de 1.200 dpi), y las plantas de semillero individuales se dividen en segmentos de la imagen utilizando el algoritmo de compresión descrito anteriormente antes del análisis. Datos de crecimiento de las raíces podrían ser extraídos de las imágenes reducidas a 1200 dpi, mientras que los datos del ángulo de punta podrían extraerse de las imágenes reducidas a 900 dpi (observación no publicada).
El procedimiento descrito en este documento se inscribe en su propio nicho en el mundo de la root de imágenes, ya que es de alto rendimiento y alta resolución sin dejar de ser relativamente asequible. Una ventaja adicional de este método es que puede ser fácilmente modificado para requisitos particulares para adaptarse a las necesidades de imagen de un grupo de investigación en particular.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue financiado por una beca de la National Science Foundation (adjudicación número IOS-1031416) y ha sido realizado en colaboración con Nathan Miller, Logan Johnson y Edgar Spalding, de la Universidad de Wisconsin y Brian Bockelman, Carl Lundstedt y David Swanson, de la Universidad de Holanda Computing Center de Nebraska.
Materiales
| Name | Company | Catalog Number | Comments |
| Epson Perfection V700 Photo Scanners | Epson | B11B178011 | - |
| Plexiglas Scanner Template | - | - | Custom made. See Figure 2. |
| Smart Strap Bungee Cords | SmartStraps | Wal-Mart 1079478 | |
| Brinks Digital Outdoor Timers | Brinks | Wal-Mart 42-1014-2 | |
| VueScan Software | Hamrick Software | http://www.hamrick.com | |
| Segmentation Software | Chris Wentworth, Doane College | https://sites.google.com/a/doane.edu/compphy-doane/projects/root-gravitropism/image-segmentation | |
| 3M Micropore Tape | Fisher Scientific | 19-061-655 | - |
| Holding racks | - | - | Custom made by gluing two cookie racks together. |
Referencias
- Miller, N. D., Brooks, T. L. D., Assadi, A. H., Spalding, E. P. Detection of a gravitropism phenotype in glutamate receptor-like 3.3 mutants of Arabidopsis thaliana using machine vision and computation. Genetics. 186, 585-593 (2010).
- Clack, N. G. Automated Tracking of Whiskers in Videos of Head Fixed Rodents. PLoS Comp. Biol. 8, (2012).
- Lussier, Y. A., Liu, Y. Computational approaches to phenotyping: high-throughput phenomics. Proc. Am. Thoracic Soc. 4, 18-25 (2007).
- Houle, D. Colloquium Paper: Numbering the hairs on our heads: The shared challenge and promise of phenomics. Proc. Natl. Acad. Sci. U.S.A. 107, 1793-1799 (2009).
- Elwell, A. L., Gronwall, D. S., Miller, N. D., Spalding, E. P., L, T. D. B. Separating parental environment from seed size effects on next generation growth and development in Arabidopsis. Plant Cell Env. 34, 291-301 (2011).
- Silk, W. K. Quantitative Descriptions of Development. Ann. Rev. Plant Physiol. 35, 479-518 (1984).
- Cronin, C. J., Feng, Z., Schafer, W. R. Automated imaging of C. elegans behavior. Methods Mol. Biol. 351, 241-251 (2006).
- Miller, N. D., Parks, B. M., Spalding, E. P. Computer-vision analysis of seedling responses to light and gravity. Plant J. 52, 374-381 (2007).
- Iyer-Pascuzzi, A. S. Imaging and Analysis Platform for Automatic Phenotyping and Trait Ranking of Plant Root Systems. Plant Physiol. 152, 1148-1157 (2010).
- Houle, D., Mezey, J., Galpern, P., Carter, A. Automated measurement of Drosophila wings. BMC Evol. Biol. 3, 25 (2003).
- Jahnke, S. Combined MRI-PET dissects dynamic changes in plant structures and functions. Plant J. 59, 634-644 (2009).
- Durham Brooks, T. L., Miller, N. D., Spalding, E. P. Plasticity of Arabidopsis Root Gravitropism throughout a Multidimensional Condition Space Quantified by Automated Image Analysis. Plant Physiol. 152, 206-216 (2010).
- Perrin, R. M. Gravity signal transduction in primary roots. Ann. Botany. 96, 737-743 (2005).
- Strohm, A. K., Baldwin, K. L., Masson, P. H. Molecular mechanisms of root gravity sensing and signal transduction. Dev. Biol. 1, 276-285 (2012).
- Harrison, B. R., Masson, P. H. ARL2, ARG1 and PIN3 define a gravity signal transduction pathway in root statocytes. Plant J. 53, 380-392 (2007).
- Swarup, R., Bennett, M. J., Beeckman, T. . Root Development. , 157-174 .
- French, A., Ubeda-Tomás, S., Holman, T. J., Bennett, M. J., Pridmore, T. High-throughput quantification of root growth using a novel image-analysis tool. Plant Physiol. 150, 1784-1795 (2009).
- Granier, C. PHENOPSIS, an automated platform for reproducible phenotyping of plant responses to soil water deficit in Arabidopsis thaliana permitted the identification of an accession with low sensitivity to soil water deficit. New Phytol. , 169-623 (2006).
- Walter, A. Dynamics of seedling growth acclimation towards altered light conditions can be quantified via GROWSCREEN: a setup and procedure designed for rapid optical phenotyping of different plant species. New Phytol. 174, 447-455 (2007).
- Gregory, P. J. Non-invasive imaging of roots with high resolution X-ray micro-tomography. Plant Soil. , 255-351 (2003).
- Pierret, A., Kirby, M., Moran, C. Simultaneous X-ray imaging of plant root growth and water uptake in thin-slab systems. Plant Soil. 255, 361-373 (2003).
- Naeem, A., French, A. P., Wells, D. M., Pridmore, T. P. High-throughput feature counting and measurement of roots. Bioinformatics. 27, 1337-1338 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados