Method Article
Un sistema de trabajo del corazón aislada por grandes modelos animales
En este artículo
Resumen
Most studies involving the Langendorff apparatus use small animal models due to the increased complexity of systems for larger mammals. We describe a Langendorff system for large animal models that allows for use across a range of species, including humans, and relatively easy data acquisition.
Resumen
Desde su introducción a finales del siglo 19, el aparato de Langendorff perfusión aislada del corazón, y el posterior desarrollo del modelo de corazón en funcionamiento, han sido herramientas muy valiosas para el estudio de la función cardiovascular y la enfermedad 1-15. Aunque la preparación de corazón Langendorff se puede utilizar para cualquier corazón de los mamíferos, la mayoría de los estudios con este aparato utilizan modelos animales pequeños (por ejemplo, ratón, rata, conejo) y debido a la mayor complejidad de los sistemas de los mamíferos más grandes 1,3,11. Una dificultad importante es garantizar una presión de perfusión coronaria constante en una gama de diferentes tamaños de corazón - un componente clave de cualquier experimento de la utilización de este dispositivo de 1,11. Mediante la sustitución de la columna de la clásica poscarga hidrostática con una bomba centrífuga, el aparato de trabajo del corazón Langendorff se describe a continuación permite un fácil ajuste y regulación estricta de las presiones de perfusión, es decir, la misma puesta a punto puede ser utilizado para diversos especies o tamaños de corazón. Además, esta configuración también puede cambiar sin problemas entre la presión constante o flujo constante durante la reperfusión, en función de las preferencias del usuario. La naturaleza abierta de esta disposición, a pesar de que la regulación de temperatura más difícil que otros diseños, permite una fácil recolección de los datos de presión-volumen de efluentes y ventriculares.
Introducción
Gran parte de nuestra comprensión de la biología y la fisiología cardíaca básica proviene de experimentos que utilizaron el corazón aislado y perfundido Langendorff-retrógrada y los sistemas aislados del corazón de trabajo. Estos sistemas experimentales están siendo ampliamente utilizados en la actualidad para extender nuestro conocimiento cardiovascular de los temas importantes, como la lesión por isquemia-reperfusión 2, 4 preacondicionamiento, la terapia basada en células de miocardio dañado 5,7, los efectos cardíacos de fármacos 6,9, y la preservación del injerto cardíaco técnicas 8,15-18.
Si bien ambos sistemas cardíacos aislados se pueden usar para cualquier especie de mamífero, que se utilizan principalmente de pequeños mamíferos, como conejillo de indias, ratas o conejos 3,12,13. Modelos animales más grandes, como los cerdos y los seres humanos, proporcionan datos clínicamente más relevantes, sino que se utilizan con menos frecuencia debido al mayor costo, mayor variabilidad biológica, grandes volúmenes de soluciones de perfusión sanguínea y bigger piezas de equipo 1,12-15. Además, la recogida de datos es más difícil, especialmente para los corazones aislados de trabajo 1,3,12-15. Como consecuencia de estas dificultades, rara vez se utilizan modelos de corazón aislado clínicamente relevantes, lo que dificulta gravemente el progreso de la investigación traslacional cardiovascular.
En un intento de resolver estas complejidades, la preparación aislada corazón en funcionamiento se modificó para crear un sistema que se puede adaptar fácilmente a los corazones de diferentes especies, incluidos los humanos, en régimen de presión constante o condiciones Langendorff flujo constantes. La cámara de cumplimiento de la poscarga fue reemplazado con una bomba centrífuga para simplificar el proceso de ajuste de la presión de perfusión en el modo de Langendorff y poscarga en el modo de trabajo. En lugar de una, con camisa de depósito cerrado para contener el corazón, este sistema utiliza una cámara abierta para hacer más fácil la recogida de datos, al permitir el uso de la vía transapical para la cateterización de la conductancia. Moreover, este diseño abierto permite el acceso para la evaluación ecocardiográfica del corazón, ampliando aún más los parámetros fisiológicos que se pueden medir en estos experimentos. Estas mejoras se espera que anime a otros a utilizar este sistema para la gran investigación traslacional animal.
Protocolo
1. Construcción del aparato Langendorff (Ver Figura 1)
- El uso de 3/8 tubos ", conectar el embalse corazón al depósito de sangre.
- Asegúrese de que este tubo pasa a través de una bomba de rodillos. NOTA: Esto puede requerir el uso de dos 3/8 "a 1/4" conectores de tubos para crear una pieza de 1/4 "tubo que pasar por la bomba de rodillos.
- Conecte el depósito de sangre para calefacción / oxigenador de 3/8 tubos ".
- Utilice 3/8 tubos "para conectar el calentador / oxigenador a un conector en Y.
- Conecte un brazo del conector en Y a la bomba centrífuga, a continuación, conecte la bomba centrífuga a un segundo conector en Y (todas con tubos de 3/8 ").
- Coloque una pieza de 3/8 "tubo asegurar una válvula de hemostasis en el brazo hacia arriba-hacia, que servirá tanto como una trampa de burbujas y los medios de inserción del transductor de presión.
- Coloque un pedazo de 3/8 tubos "para el brazo hacia abajo. Esta porción se conectará a la aor cánula tic (es decir, la línea de la poscarga).
- Conectar el otro brazo de la Y-conector a la entrada de la cámara de pre-carga usando 3/8 tubos ". Asegúrese de que este tubo pasa por una segunda bomba de rodillos.
- Conecte el exceso de 3/8 "tubo a la salida de esta cámara. Esta porción se conectará a la aurícula izquierda (es decir, la línea de precarga).
- Conectar el depósito de oxígeno y un aparato de calentamiento para el calentador / oxigenador.
- Fije la línea que va desde el conector en Y a la cámara de pre-carga, ya que esta línea no se utilizará hasta que el corazón se pone en el modo de trabajo.
2. Presión-Volumen Catéter Preparación
- En un 37 ° C baño de agua, calentar una botella de solución salina.
- Sumerja el transductor PV catéter de conductancia y presión en la salina caliente durante al menos 30 min.
- Encienda los sistemas de adquisición de datos, lo que permite tanto para el calentamiento durante al menos 30 min.
- Encienda el tanque de oxígeno, aparatos de calefacción, bomba de rodillo que conecta los dos embalses, y la bomba centrífuga. El aparato de calefacción se debe ajustar a la temperatura corporal del animal (~ 36 ° C).
- Lavar la sangre de acuerdo con las instrucciones del fabricante. Velocidades de lavado más lentas son recomendados para la eliminación más completa de productos de desecho de la sangre (por ejemplo, el exceso de electrolitos, material celular lisada).
- Una vez que la sangre se lava, se revise el nivel de hematocrito antes de la hemodilución.
- Reconstituir las células rojas de la sangre se lavaron con solución salina normal para la concentración deseada hematocrito (recomendado: 20-25%) y añadir al aparato de Langendorff.
- Ajustar las velocidades de las dos bombas para comenzar el flujo de sangre a través del sistema (con exclusión de la cámara de precarga).
- Compruebe el pH y los electrolitos de la mezcla de la sangre y ajustar hasta fisiológica de las especies utilizadas. NOTA: Para evitar deletérea enflujo de calcio en la reperfusión, los niveles de calcio en el aparato de Langendorff inicialmente deben mantenerse bajo (0.3-0.5 mmol / l).
- Si hay una disminución en el hematocrito con aumento simultáneo de potasio, comprobar la lactato deshidrogenasa y de plasma libre de la hemoglobina para descartar la hemólisis.
- En caso de que se produce la hemólisis, asegúrese de que todas las conexiones estén apretadas y no hay áreas de sheering obvio.
- Conecte el catéter de Millar en la ranura secundaria de la presión del sistema PowerLab.
- Calibrar el transductor de presión de acuerdo con las instrucciones del fabricante.
4. Preparación del corazón para su fijación al aparato Langendorff
NOTA: Un corazón correctamente detenido debe ser utilizado para cualquier grandes experimentos con animales que implican un sistema de corazón aislado. Falta de cardioplejía puede dañar el corazón de tal manera que no va a producir un trabajo medible. Celsior o baja en potasio Universidad de Wisconsin se recomienda la solución (UW), ya que no sólo son estas soluciones similares a las utilizadas clínicamente, pero el bajo nivel de potasio de la solución ayuda a evita hiperpotasemia, mientras que en el circuito. Volumen de solución cardiopléjica dependerá del tamaño del corazón, con 1 litro basta para corazones porcinos.
- Quite rápidamente el corazón del recipiente de almacenamiento, derrama cualquier solución de almacenamiento en los ventrículos, secar y pesar.
- Para ayudar a mantener una temperatura infarto de frío hasta que el corazón está listo para el de Langendorff, devuelva el corazón para recipiente de almacenamiento y orientarla de modo que la aorta se enfrenta hacia arriba.
- Inserte un 3/8 "de la cánula en la aorta y seguro con una abrazadera plástica.
5. Acoplamiento del Corazón al Langendorff
- Disminuir la bomba centrífuga a un goteo lento.
- Trickle la sangre en la aorta hasta que se llena de sangre y completamente-ventiló DE.
- Conecte con cuidado la c aórticaAnnula a la tubería de la aorta en el de Langendorff. Tome nota del tiempo de fijación.
- Inserte el transductor de presión calibrada a través de la válvula de hemostasia [DS1] dentro de la aorta nativa.
- Comience mediciones de presión y ajuste la velocidad de la bomba centrífuga hasta que se logre la presión deseada reperfusión. NOTA: La presión puede cambiar los cambios de resistencia como coronarias. Por lo tanto, controlar la presión aórtica de cerca, especialmente durante la reperfusión inicial.
- Aumenta la temperatura en la unidad de calentamiento de temperatura intramyocardial se mide a 37 ° C. NOTA: Habrá un retraso entre los ajustes realizados en la unidad de calentamiento y los cambios en las temperaturas intramiocárdicos. Por lo tanto, los cambios de temperatura se deben hacer de forma incremental.
- Obtener una línea de base (T = 0) de la muestra desde el depósito de sangre venosa para medir el pH, electrolitos, y otras mediciones bioquímicas.
- Inserte la sonda de temperatura en el septum y controlar la temperatura del miocardio. Reducir la temperatura de la unidad de calentamientosi la temperatura sube por encima de infarto 39 ° C.
- Tomar muestras de sangre cada 15 minutos, el ajuste de los parámetros fisiológicos como se desee para el experimento.
- Añadir aproximadamente 1 mmol de calcio a la solución de sangre cada 5 min, asegurándose de que el calcio iónico es> 0,8 mmol / l antes de la iniciación del modo de trabajo.
6. Poner el corazón en el modo de trabajo
- Insertar una cánula de tamaño adecuado en la vena atrio / pulmonar izquierda. Esto se puede hacer ya sea con una sutura en bolsa de tabaco o abrazadera plástica, según corresponda.
- Cierre todos los orificios de la aurícula izquierda que podrían tener fugas, tales como otros orígenes de las venas pulmonares con sutura o grapas, según sea necesario.
- Ajuste la altura de la cámara de precarga de tal manera que la altura de la columna da la presión de precarga deseada. NOTA: Suponiendo que la densidad de la mezcla de sangre / cristaloides es igual a la densidad del agua, 1 mmHg = 1,36 cm de la distancia desde la válvula aórtica a la parte superior deel nivel de sangre en el depósito de la precarga (por ejemplo, 15 mm Hg = 20,4 cm).
- Abra la abrazadera del tubo que va a la cámara de precarga y lentamente en marcha la bomba de rodillos de la precarga, lo que permite la cámara de precarga y el tubo de precarga se vuelva a llenar de sangre.
- Una vez que se ventiló-des completamente el tubo de precarga, llene lentamente la aurícula izquierda y la cánula con la sangre.
- Sin permitir que el aire para entrar en el sistema, conecte el tubo de precarga a la cánula de la aurícula izquierda.
7. Obtención ventricular presión-volumen (PV) Grabaciones
- Siga las instrucciones del fabricante para la calibración de presión y cubeta Rho de los sistemas de adquisición de datos.
- Coloque una sutura en bolsa de tabaco usando una sutura de polipropileno 3-0 en el ventrículo izquierdo (VI) ápice.
- Usando una aguja de 16, hacer una incisión dentro de la bolsa de tabaco.
- Inserte el catéter de conductancia PV en la incisión apical. NOTA: la colocación del catéter ideal tendrá depterminar en tener todos los electrodos de detección dentro de la LV y dos electrodos de excitación fuera de la LV. Asegúrese de que un animal de tamaño adecuado y el catéter se han seleccionado (ver Discusión).
- Pulse el botón "Inicio" en la esquina superior derecha para iniciar el registro de datos y determinar el número de segmentos de volumen están activos.
- Si todos los segmentos no están activos, ajuste la posición del catéter hasta que todos los segmentos están activos. NOTA: torsión leve del catéter puede ser necesario optimizar la morfología de bucle
- Si no puede obtener señales en todos los segmentos, ajustar la ubicación de los electrodos de excitación y de los electrodos de detección por las instrucciones del fabricante.
- Una vez que se obtiene la configuración deseada, siga las instrucciones del fabricante para el volumen y la calibración alfa.
- El uso de un catéter correctamente calibrado, obtener al menos 30 segundos de los datos de presión-volumen de referencia. NOTA: Estos bucles presión-volumen proporcionarán volumen dependientemella mediciones de la función cardíaca (por ejemplo, el gasto cardiaco, el volumen sistólico).
- Una vez que se obtienen bucles suficientes, continuar con el paso siguiente sin detener la grabación de datos, a fin de obtener datos de presión-volumen de oclusión.
- Ocluir el tubo de precarga lentamente utilizando una pinza de la línea. NOTA: Los bucles de presión-volumen deben comenzar a ser más pequeño y la marcha inferior y hacia la izquierda. Esto se llama el "caminar".
- Obtener 10-15 seg de la caminata hacia abajo, a continuación, suelte la abrazadera de la tubería para permitir la carga previa para volver a introducir la aurícula izquierda. NOTA: Estos bucles presión-volumen proporcionarán volumen mediciones independientes de la función cardíaca (por ejemplo, la precarga de trabajo sistólico recruitable, telesistólico relación presión-volumen).
- Detener grabación de datos pulsando el botón de "Stop" en la esquina superior derecha de la pantalla.
- Espere al menos 5 minutos antes de repetir eloclusión.
- Repita los pasos 7.7 y 7.8 para obtener mediciones repetidas.
Resultados
La figura 1 es un dibujo esquemático del circuito, incluyendo la colocación del catéter sugerido. Los elementos importantes de este aparato son las siguientes: el uso de una bomba centrífuga para el control de la postcarga; la colocación de un catéter de presión (línea azul oscuro) en la raíz aórtica para monitorear la presión de perfusión; y la colocación del catéter de presión-volumen (PV) (línea azul claro) transapical. Aunque las conexiones de la figura parecen ser las conexiones rectas, se recomiendan los conectores en "Y", especialmente para la línea de precarga.
La Figura 2 muestra los datos obtenidos desde el transductor de presión que se coloca en la raíz aórtica de un corazón porcino durante la reperfusión en el circuito, que es consistentemente entre 40-42 mmHg durante más de 20 min. Los cambios en la resistencia coronaria pueden causar fluctuaciones en la presión de perfusión (Figura 3). Estas variaciones pueden ser leves y graduales, corregirlos mismos a través del tiempo (Figura 3a). Sin embargo, en algunos casos, estas variaciones pueden ser abruptos y requieren un ajuste del flujo a través de la bomba centrífuga para mantener la presión deseada reperfusión (Figura 3b). Debido a que pueden producirse cambios, se requiere un control de la presión de la raíz aórtica durante la reperfusión.
Mediante la utilización de la incisión punzante transapical, los datos de presión-volumen se pueden obtener fácilmente en el sistema del corazón aislado. En este experimento, se utilizó un corazón porcino que se habían almacenado en solución de conservación en frío (4 ° C) durante 2 horas. Sobre la introducción inicial del catéter PV, los bucles eran de mala calidad (Figura 4a), con múltiples zonas de cruce y no hay componentes del ciclo cardiaco discernibles. Sin embargo, con un mínimo de manipulación del catéter dentro del ventrículo, la morfología de bucle mejorado de manera espectacular (Figura 4b), lo que permite mediciones que se obtienen.
ve_content "> A pesar de la optimización de la posición del catéter, los bucles adquiridos en el circuito ex vivo (Figura 5, fila superior) pueden tener una morfología diferente que los bucles en vivo (Figura 5, fila inferior). Estos cambios en la morfología de bucle son probablemente debido a la diferente orientación del corazón en el circuito de comparación en un animal en posición supina, así como la falta de los archivos adjuntos anatómicas encontradas dentro de un animal vivo (por ejemplo, pericardio). Además, el uso de cables de estimulación para ayudar a regular la frecuencia cardíaca ( sitio de unión recomendada: tabique interventricular) introduce una corriente eléctrica externa, lo que lleva a los picos observados en la parte inferior derecha de los ex vivo bucles Sin embargo, siempre y cuando estos lazos aún cuentan con los componentes del ciclo cardiaco, pueden todavía producir datos interpretables.. La Tabla 1 lista los parámetros funcionales múltiples obtenidos a partir de estos bucles de presión-volumen utilizando el catéter de PV. La almacenamiento estático en frío probablemente causado algún daño intrínseco al corazón, lo que ayuda a explicar algunos de los cambios en los valores obtenidos en el circuito en comparación con las mediciones in vivo. Parte de la variación dentro de las variables dependiente de la carga se debe también a las probables diferencias en la precarga entre el circuito y el animal vivo.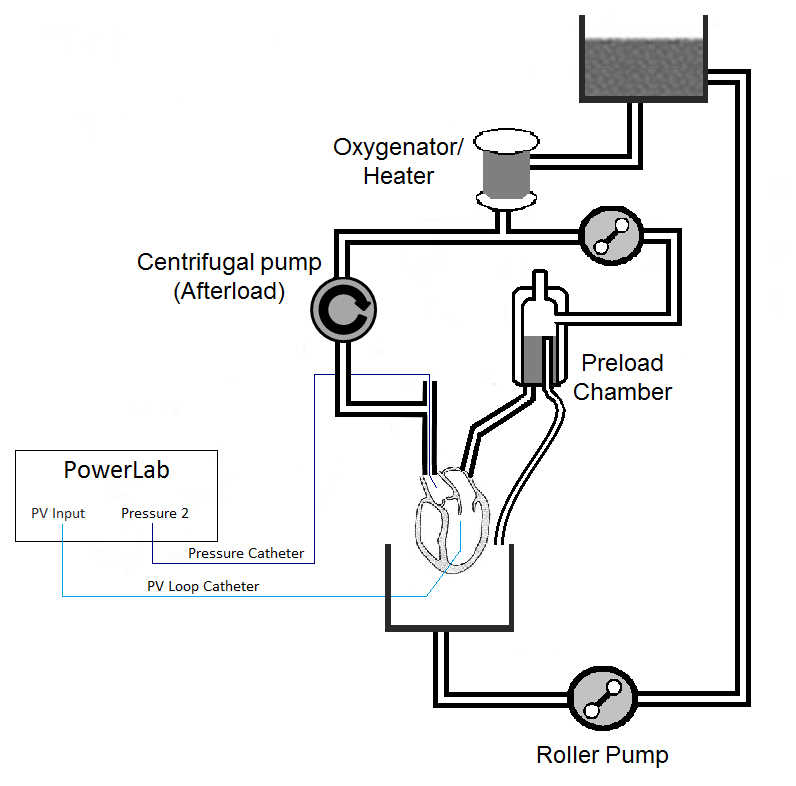
Figura 1. Diagrama de aparato.

Figura 2. Mediciones de la presión de la raíz aórtica representativas durante la reperfusión.
g3highres.jpg "width =" 500 "/>
Figura 3. Ejemplos de los cambios en la presión de la raíz aórtica que puede ocurrir durante la reperfusión. Estos cambios pueden ser graduales y de auto-corrección (A), o abrupto y requerir cambios en la configuración de la bomba centrífuga (B).
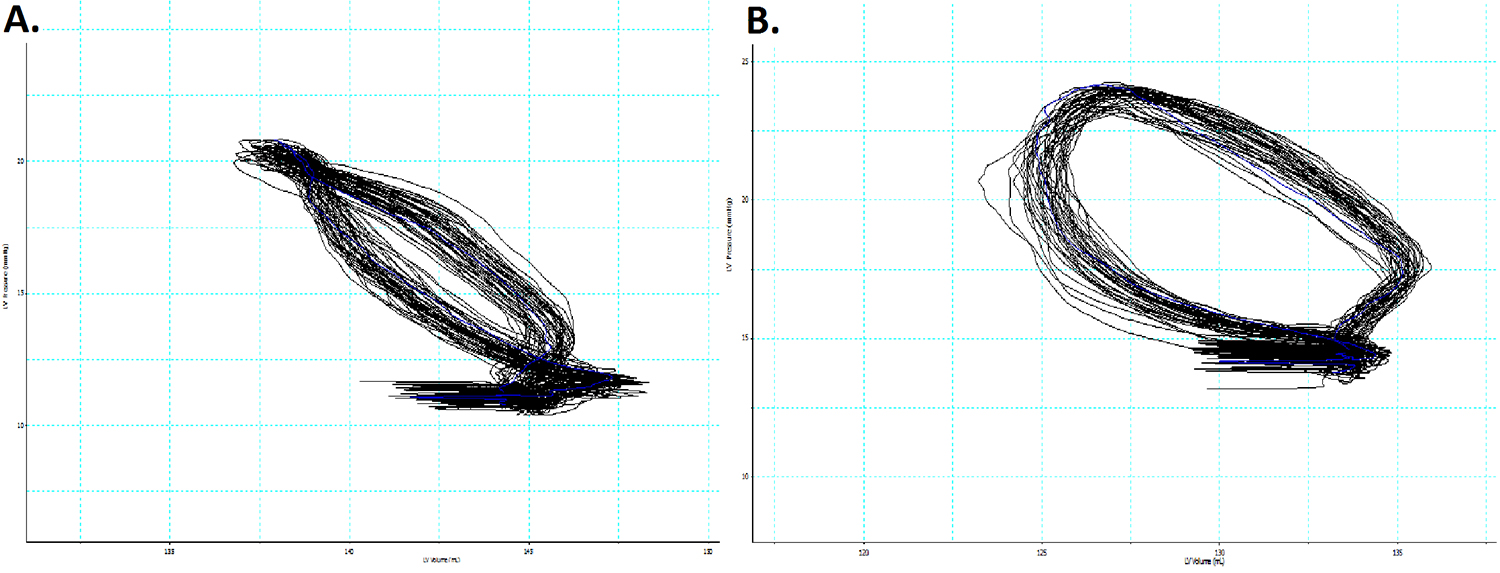
Figura 4. Bucles de presión-volumen obtenido tras la inserción inicial del catéter transapical (A) y después de la manipulación del catéter menor (B). Nota la mejora de la morfología de bucle, con lo cual se elimina el cruce de bucle y los elementos del ciclo cardíaco son reconocibles . Los picos en la parte inferior derecha de ambos conjuntos de bucles se deben a la utilización de un marcapasos, que introduce una señal eléctrica extrínseca.
"Figura 5" fo: content-width = "5in" src = "/ files/ftp_upload/51671/51671fig5highres.jpg" width = "500" />
Figura 5. Mediciones de presión-volumen representativas tomadas en el vivo del circuito ex (fila superior), con mediciones in vivo en (fila inferior) para la comparación. Una vez más, los picos del marcapasos se puede ver en la parte inferior derecha de los dos grupos de ex vivo bucles.
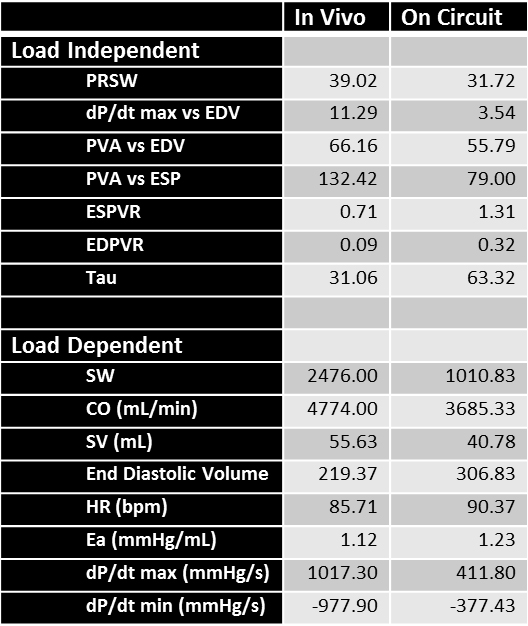
Tabla 1 Parámetros funcionales obtenidos para un corazón porcino in vivo (columna de la izquierda) y en el aparato de trabajo del corazón después de 2 h de almacenamiento en frío (columna derecha) CO:.. Gasto cardíaco; E a: elastancia arterial; EDPVR: telediastólico relación presión-volumen; EDV: volumen diastólico final; ESPVR: Terminar sistólica relación presión-volumen; PRSW: precarga-recruitable trabajo sistólico; PVA:zona de presión-volumen; SV: volumen sistólico; SW: trabajo sistólico.
Discusión
El aparato de perfusión aislada del corazón Langendorff y modelo de corazón de trabajo han dado lugar a algunos de los descubrimientos más fundamentales de la fisiología cardiaca, patología y farmacología. Versatilidad de este modelo permite su uso con una variedad de especies de bajo una variedad de condiciones normales y patológicas 1-18. Sin embargo, el modelo de corazón aislado no es de uso común para los grandes mamíferos, especialmente los corazones humanos, en parte debido a la mayor complejidad de diseño tanto aparato y recogida de datos. Por lo tanto, el protocolo presentado en el presente documento demuestra un intento de mejorar estas complejidades que se traduce en un medio relativamente reproducibles de estudio de corazones aislados de la especie porcina.
Un componente crucial de nuestra configuración es el reemplazo de la cámara de la distensibilidad arterial / poscarga con una bomba centrífuga. Este cambio permite un mejor control de la presión de perfusión coronaria y la poscarga en el corazón de Langendorff y modos de trabajo, respectivamente, permite que esta puesta a punto para adaptarse fácilmente a los corazones de diferentes tamaños y especies. Por ejemplo, en este diseño, corazones porcinos son reperfusión a 40-45 mmHg, mientras que los corazones humanos se reperfusión en 60-65 mmHg. Este cambio en la presión se logra simplemente mediante el ajuste de la configuración de la bomba centrífuga; ningún componente del sistema necesita ser ajustado físicamente. Además, la colocación de un transductor de presión dentro de la raíz aórtica para monitorear presiones de raíz permite una fácil transición entre el flujo constante y presión constante durante el modo de Langendorff. Aunque este cambio elimina la cámara de cumplimiento clásica, la bomba centrífuga, por lo que permite el flujo bidireccional ocurre basado en el gradiente de presión, puede servir como una cámara de cumplimiento. Con el volumen de eyección sístole y expulsado, el flujo retrógrado a través de la bomba sirve para disminuir la presión de la poscarga, replicando la elasticidad de la aorta.
El diseño abierto de este aparato es también importante. Tras el corazón que cuelga en una una abiertoREA, en lugar de una cámara semi-cerrado o embudo, permite fácil instrumentación de mediciones de presión-volumen. El diseño abierto permite el uso de una incisión transapical para LV colocación del catéter, evitando el enfoque transvalvular. El enfoque transvalvular es técnicamente más difícil, y por lo general requiere de fluoroscopia para la colocación adecuada. Además, este enfoque también puede inducir insuficiencia valvular. Mediante el uso de la vía transapical, que forma segura y fácil a colocar el catéter dentro del ventrículo izquierdo al tiempo que elimina el coste y los inconvenientes de la fluoroscopia adicional. El diseño abierto también permite un fácil acceso para la ecocardiografía y la recogida de efluentes, ampliando aún más los parámetros funcionales y bioquímicos que pueden ser evaluados, mientras que en este sistema.
El diseño abierto, al tiempo que facilita la recogida de datos, hace que la regulación de temperatura del miocardio más difícil. El mantenimiento de la temperatura fisiológica es uno de los problemas conocidos con una Langendorffo trabajando sistema del corazón 1,3,11,13. El sistema de Langendorff contiene típicamente una cámara térmica que ayuda a mantener una temperatura adecuada, pero esta cámara también hace que la inserción de un catéter de presión-volumen ventricular más difícil. Para resolver la regulación de la temperatura inferior del diseño abierto, un intercambiador oxigenador / calor se coloca después del depósito. El espacio mínimo entre el intercambiador de calor y la cánula aórtica reduce la pérdida de calor, y la sonda de temperatura infarto asegura la normotermia. El uso de tubos de encamisado o fuentes de calentamiento externas también se puede utilizar para ayudar con control de temperatura.
Otro elemento singular de este protocolo es el lavado de la sangre autóloga de los cerdos en estudio y reconstituir con solución salina normal. Aunque, el uso de cualquiera de perfundidos de sangre entera o células rojas de la sangre aumentada con tampones cristaloides no es raro, lo hace presente con temas. El ex general requiere una donación de animales, lo que añade substcostos antial del experimento, mientras que el último puede tener problemas de inmunogenicidad, ya que por lo general se deriva de 1,11-13 sangre bovina. Al lavar la propia sangre del cerdo original, el protocolo sólo requiere un único animal y las cuestiones de inmunogenicidad se ablación. Además, el proceso de lavado elimina la mayor parte de los electrolitos, lo que significa que pueden ser fácilmente manipulados por los parámetros experimentales. Finalmente, el uso de una unidad de conservación de la sangre elimina la mayor parte de las proteínas dentro de la sangre, que es a la vez una ventaja y desventaja de este proceso. La ventaja es que cualquier coagulación y proteínas inmunológicas / infecciosas se eliminan, disminuyendo la probabilidad de formación de coágulos o la contaminación. La desventaja es que esta mezcla tiene una presión oncótica baja, lo que puede conducir a edema miocárdico y, posiblemente, la pérdida de la función cardíaca en el tiempo. Este problema puede ser dirigida, sin embargo, a través de la adición de albúmina u otro coloide.
Asegurar que un tamaño adecuado de unaIMAL y el catéter se han seleccionado es tan importante como usar el aparato cardíaco funcionamiento. Idealmente, el catéter se coloca con todos los electrodos de detección dentro del espacio ventricular, con dos electrodos de excitación (es decir, los electrodos más proximales) fuera del espacio ventricular. Si cavidad ventricular del animal es demasiado pequeño, o la separación entre los electrodos es demasiado grande, entonces todos los segmentos no cabe en el espacio de LV. Si bien la ubicación de los electrodos de excitación se puede ajustar, una pequeña cavidad LV también puede hacer que el catéter se doble o se curva, lo que hace difícil la recogida de datos. Por lo tanto, para el análisis funcional de los corazones de animales grandes, se recomienda un tamaño de los animales de al menos 60 kg. Con un animal de este tamaño, el espaciamiento del electrodo de 7 mm por lo general permite la inserción completa del catéter.
En conclusión, este manuscrito describe un sistema aislado de trabajo del corazón que simplifica la regulación de la presión de perfusión, col de datoslección, y el diseño en general, al tiempo que el control de temperatura sólo un poco más difícil. Estas modificaciones en el corazón aislado de trabajo se espera que permitirá el aumento de su uso con grandes corazones de mamíferos, incluidos los humanos, la promoción de nuestra comprensión de la patología cardiaca y permitiendo más opciones de tratamiento clínicamente relevantes para ser descubierto.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
There are no acknowledgments.
Materiales
| Name | Company | Catalog Number | Comments |
| PowerLab 16/35 with LabChart Pro | ADInstruments | PL3516/P | |
| MPVS Ultra Pressure-Volume Unit | ADInstruments | 880-0168 | |
| Ventri-Cath Catheter (5F, 12E, 7 mm, DField, Straight, 122 cm) | Millar | VENTRI-CATH-507s | |
| Pressure Catheter (3.5F, Single, Straight, 100 cm, Ny, Non Repairable) | Millar | SPR-524 | |
| PV Extension Cable (10 ft) | ADInstruments | CEC-10PV | |
| Catheter Interface Cable (10 ft) | ADInstruments | PEC-10D | |
| Rho Calibration Cuvette | ADInstruments | 910-1060 | |
| MPVS Ultra BNC Cable Pack | ADInstruments | 880-0172 | |
| Autotransfusion system | Sorin | 7320000 | |
| Bowl Set with Low Volume (135 ml) Centrifuge Bowl | Sorin | 7135100 | |
| Oxygenator/Heat Exchanger | Terumo | 3CXSX18RX | |
| Perivascular flow probe | Transonic Systems | PAU Series | Size of flow probe will depend on animal size; for 60 kg pig, recommend 20 or 24 mm probe |
| Perivascular flowmeter module | Transonic Systems | TS420 | |
| Myocardial temerpature sensor | Smiths Medical | MTS-40015 | |
| 16 G 1" Regular needle | BD Inc. | 305197 | |
| 4-0 polypropylene suture (double-arm) | Ethicon | 8526H | For purse-string stitches |
| 2-0 polypropylene suture (single-arm) | Ethicon | 8833H | |
| Cable ties | ULINE | S-1021 | |
| Cable tie gun | ULINE | H-241 | |
| Clear, Flexible PVC Tubing | VWR International | 89068 | Inner diameter depends on cannulas, pumps and other equipment used; most commonly use 1/4", 3/8" tubing |
| Straight Tubing Connectors | VWR International | 46600 | |
| Y-Shaped Tubing Connectors | Thermo Scientific | 6152 | |
| Jacketed Bubble Trap | Radnoti | 14040 | For preload chamber |
| Centrifugal pump | Maquet | 70105 | The centrifugal pump and roller pumps were obtained used from perfusion department after clinical use. |
| Roller pumps | Maquet | HL-20 | |
| Hemostasis Valve | Merit Medical | MAP150 | |
| Blood gas analyzer | Instrumentation Laboratory | 570001000 |
Referencias
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. Journal of Pharmacological and Toxicological Methods. 55, 113-126 (2007).
- Cheung, P. Y., et al. Matrix metalloproteinase-2 contributes to ischemia-reperfusion injury in the heart. Circulation. 101, 1833-1839 (2000).
- Ytrehus, K. The ischemic heart--experimental models. Pharmacological Research: the Official Journal of the Italian Pharmacological Society. 42, 193-203 (2000).
- Ferdinandy, P., Schulz, R. Nitric oxide, superoxide, and peroxynitrite in myocardial ischaemia-reperfusion injury and preconditioning. British Journal of Pharmacology. 138, 532-543 (2003).
- Ohno, N., et al. Transplantation of cryopreserved muscle cells in dilated cardiomyopathy: effects on left ventricular geometry and function. The Journal of Thoracic and Cardiovascular Surgery. 126, 1537-1548 (2003).
- Hamlin, R. L., et al. Sensitivity and specificity of isolated perfused guinea pig heart to test for drug-induced lengthening of QTc. Journal of Pharmacological and Toxicological Methods. 49, 15-23 (2004).
- Lee, M. S., Lill, M., Makkar, R. R. Stem cell transplantation in myocardial infarction. Reviews in Cardiovascular Medicine. 5, 82-98 (2004).
- Ryugo, M., et al. Myocardial protective effect of human recombinant hepatocyte growth factor for prolonged heart graft preservation in rats. Transplantation. 78, 1153-1158 (2004).
- Valentin, J. P., Hoffmann, P., De Clerck, F., Hammond, T. G., Hondeghem, L. Review of the predictive value of the Langendorff heart model (Screenit system) in assessing the proarrhythmic potential of drugs. Journal of Pharmacological and Toxicological Methods. 49, 171-181 (2004).
- Southworth, R., Blackburn, S. C., Davey, K. A., Sharland, G. K., Garlick, P. B. The low oxygen-carrying capacity of Krebs buffer causes a doubling in ventricular wall thickness in the isolated heart. Canadian Journal of Physiology and Pharmacology. 83, 174-182 (2005).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50, 940-950 (2011).
- Hearse, D. J., Sutherland, F. J. Experimental models for the study of cardiovascular function and disease. Pharmacological Research: the Official Journal of the Italian Pharmacological Society. 41, 597-603 (2000).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research: the Official Journal of the Italian Pharmacological Society. 41, 613-627 (2000).
- Hill, A. J., et al. In vitro studies of human hearts. Ann Thorac Surg. 79, 168-177 (2005).
- Colah, S., et al. Ex vivo perfusion of the swine heart as a method for pre-transplant assessment. Perfusion. 27, 408-413 (2012).
- Ozeki, T., et al. Heart preservation using continuous ex vivo perfusion improves viability and functional recovery. Circ J. 71, 153-159 (2007).
- Garbade, J., et al. Functional, metabolic, and morphological aspects of continuous, normothermic heart preservation: effects of different preparation and perfusion techniques. Tissue engineering. Part C, Methods. 15, 275-283 (2009).
- Poston, R. S., et al. Optimizing donor heart outcome after prolonged storage with endothelial function analysis and continuous perfusion. Ann Thorac Surg. 78, 1362-1370 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados