Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Método simple de ADN de fluorescencia
En este artículo
Resumen
Here, we present a simple method for performing fluorescence DNA in situ hybridization (DNA ISH) to visualize repetitive heterochromatic sequences on slide-mounted chromosomes. The method requires minimal reagents and it is versatile for use with short or long probes, different tissues, and detection with fluorescence or non-fluorescence-based signals.
Resumen
ADN hibridación in situ (ISH ADN) es un método comúnmente utilizado para las secuencias de mapeo a regiones específicas de cromosomas. Este enfoque es particularmente eficaz en la cartografía de secuencias altamente repetitivas a heterochromatic regiones, donde los enfoques computacionales enfrentan desafíos prohibitivos. Aquí se describe un protocolo simplificado para ADN ISH que elude lavados de formamida que son medidas estándar en otros protocolos de ADN ISH. El protocolo se ha optimizado para la hibridación con sondas de ADN monocatenario cortos que llevan colorantes fluorescentes, que marcan efectivamente secuencias repetitivas de ADN dentro de las regiones cromosómicas heterocromatínicas a través de un número de diferentes tipos de tejidos de insectos. Sin embargo, las solicitudes podrán hacerse extensivas a utilizar con sondas de mayor tamaño y la visualización de las secuencias de ADN de copia única (no repetitiva). Demostramos este método mediante la asignación de varios diferentes secuencias repetitivas a los cromosomas de Drosophila melanogaster aplastadas células neuronales y Nasoniavitripennis espermatocitos. Mostramos los patrones de hibridación de ambas sondas pequeñas, sintetizados en el mercado y para una sonda grande para la comparación. Este procedimiento utiliza insumos de laboratorio sencillas y reactivos, y es ideal para los investigadores que tienen poca experiencia con la realización de ADN ISH.
Introducción
ADN hibridación in situ (ISH ADN) es un método comúnmente utilizado para las secuencias de mapeo a regiones específicas de cromosomas. Las sondas a las regiones de copia única dentro de la eucromatina se pueden generar a través de un puñado de enfoques, incluyendo nick-traducción o extremo etiquetado de los productos de ADN largas de 1,2 y la incorporación de deoxygenin (DIG) nucleótidos, adscritos y su reconocimiento a través de una amplia variedad de anticuerpos de grupo-conjugado 1-3. La visualización de secuencias euchromatic en pocos o un solo número de copias requiere el uso de cualquiera de las sondas individuales, grandes con alta actividad específica o un cóctel de múltiples sondas, más pequeñas que mejoran colectivamente señal.
En contraste, las secuencias altamente repetitivas que se encuentran en la heterocromatina, como ADN satélite, son blancos más fáciles para el ADN ISH porque normalmente existen como decenas de miles de repeticiones agrupadas en regiones cromosómicas individuales conocidos como bloques. Los elementos transponibles pueden ser tambiénque se encuentra en alto número de copias en distintos loci cromosómicos 2. En estos casos, las sondas individuales con baja actividad específica pueden etiquetar con eficacia heterochromatic secuencias debido a su hibridación en múltiples sitios. Las sondas a secuencias repetitivas pueden sintetizarse oligonucleótidos comercialmente como cortas (30-50 pb) y químicamente conjugados con cualquiera de los múltiples grupos fluorescentes diferentes. Mapeo secuencias repetitivas dentro de heterocromatina utilizando tecnologías de secuenciación del genoma es difícil debido a los problemas encontrados en los andamios de construcción dentro de los bloques de satélite altamente repetitivas 4-6,7. Actualmente, ISH se erige como la forma más efectiva de cartografía de estas secuencias a nivel sub-cromosoma. Esta estrategia es importante para el mapeo de un gran número de secuencias repetitivas que están siendo descubiertas por los estudios de secuenciación del genoma y transcriptoma en curso.
La eficiencia y la facilidad de mapeo secuencias repetitivas en los cromosomas de diapositivas montadas serían greatly mejorada por un protocolo simplificado para el ADN ISH. Por ejemplo, los protocolos existentes para el ADN ISH implican múltiples lavados de tejidos hibridados en solución de formamida 2,8, añadiendo así sustancialmente el tiempo requerido para las secuencias de cartografía y también la producción de grandes cantidades de residuos químicos para este reactivo costoso. Aquí se describe un método de ADN ISH revisado que evita la necesidad de lavados de formamida y utiliza equipos y reactivos de laboratorio básico. Este método fue diseñado originalmente para la rápida detección de las secuencias de ADN altamente repetitivas en las regiones heterocromáticas de neuroblastos de larvas de Drosophila mediante el uso de oligos sintetizados comercialmente que se conjugan con los tintes de fluorescencia. Sin embargo, este método también funciona para el mapeo de secuencias repetitivas mediante el uso de sondas más grandes sintetizados a través de otros medios de 9,10 y a través de múltiples diferentes tipos de tejidos y de cromosomas. Además, este método se puede utilizar para mapear secuencias euchromatic mediante el uso de más largo o multíparale, sondas cortas dentro de la secuencia euchromatic de interés.
Protocolo
1. Tejido disección y fijación (60 min)
- Para el cerebro de Drosophila, coloque larvas 3º en una gota de 1x PBS (tampón fosfato salino). Elija gran 3º estadio las larvas que se arrastraba activamente de los viales o botellas que no son de hacinamiento.
- Utilice uno ultrafino par de pinzas para agarrar los ganchos de la boca y otro par de pinzas para agarrar 2/3 abajo de la longitud del cuerpo (Figura 1 A, B). Tire suavemente de los ganchos de la boca para exponer el cerebro, los ganglios ventral, las glándulas salivales y parte del tracto digestivo de las larvas. Utilice las pinzas para separar el cerebro y ganglios ventral (Figura 1 A, B) de los otros tejidos y colocarlos en una gota de 1x PBT (tampón fosfato salino con Tween) en una placa de Petri de plástico.
- Para disecciones testículo Nasonia, elegir varones pupas de 3 días de edad (cuerpos de color amarillo con los ojos rojos). Hombre Nasonia tiene pequeñas longitudes pad ala relativos a females durante la fase de pupa (Figura 1C).
- Sostenga la pupa en la parte superior del abdomen, cerca de la región torácica con un par de pinzas, y usando el otro par de pinzas, agarra la punta muy distal del abdomen y extraiga los testículos en forma de lágrima, (que estarán rodeados de grasa cuerpo que puede ser sacudido suavemente; Figura 1D). Separe las piezas exteriores de la carrocería de los testículos, lo que evitará aplastamiento adecuado, y el lugar en una gota de 1x PBT en una placa de Petri de plástico.
- Para cada diapositiva, diseccionar un total de cuatro o cinco muestras de tejido (es decir., Drosophila cerebros larvas o testículos Nasonia).
NOTA: Más de cinco muestras dará lugar a núcleos de hacinamiento y cromosomas. - Opcionalmente, para lograr algo de separación de las cromátidas hermanas en euchromatic regiones de los cromosomas mitóticos, tratar el tejido con una solución hipotónica: transferir los cerebros de 1x PBT a una caída del 0,5% de citrato de sodio durante 5 a 10 (no más de 10) min.
NOTA: La colchicina (un inhibidor mitótico) puede ser útil para aumentar el número de figuras mitóticas en metafase 11. Sin embargo, su uso no es necesario si se utilizan larvas sanas muy grande, e incluso deseable, ya que puede afectar negativamente a la resolución de cromosomas, la difusión y la morfología. - Coloque una gota (~ 20 l) de solución de fijación (2,5% de paraformaldehído en ácido acético 45%) sobre la superficie de un cubreobjetos tratados con Sigmacote limpio.
NOTA: Asegúrese de solución fijadora nueva para cada día de uso. Soluciones para la adherencia que van desde 1,8 hasta 3,7% de paraformaldehído en ácido acético 45% producen los mejores resultados para los peces. El uso de tejidos distintos de cerebros o los testículos, o la adaptación de este protocolo para la inmuno-FISH puede requerir la experimentación con diferentes fijadores (para una lista de diferentes fijadores, ver 12). - Transferir cuidadosamente cada muestra de tejido del tampón de disección (1x PBT) en la gota de fijador con pinzas ultrafinas, minimizing la transferencia de la disección de búfer en la solución fijadora. Colocar las muestras de tejido para que se espacian uniformemente el uno del otro dentro de la gotita fijador. Incubar los tejidos en fijador durante 4 min a temperatura ambiente.
- Con cuidado, coloque una cara diapositiva poli-lisina abajo sobre el tejido y la cubierta deslizante. No presione hacia abajo en este punto, sino que permiten que los dos para contactar ligeramente de modo que la hoja de la cubierta se pega en la parte inferior de la diapositiva. Invierta la diapositiva para que la hoja de la cubierta está en la cima.
- Sandwich del deslizamiento diapositiva / tejido / cubierta dentro de un pedazo de papel doblado filtro. Sobre una superficie estable, con el pulgar, presione firmemente hacia abajo en la posición directamente por encima de la hoja de la cubierta. Tenga cuidado para evitar deslizamiento lateral de la hoja de la cubierta (esto hará que se corra del tejido).
- Sumerja el portaobjetos / tejido / hoja de cubierta en nitrógeno líquido (véase aparato de la figura 1E, F), y deje reposar hasta que el nitrógeno se detiene en ebullición (ya es fine). Retire el portaobjetos y coloque inmediatamente la hoja de la cubierta con una hoja de afeitar nueva accionando una esquina de la hoja de la cubierta en una dirección ascendente (no rayar el tejido fijado con la hoja de afeitar).
- Pre-enfriamiento de la diapositiva / tejido / hoja de la cubierta en un bloque de hielo seco, la tapa arriba, durante 1-2 minutos antes de la inmersión en nitrógeno líquido ayudará a evitar que las diapositivas se agriete.
- Colocar inmediatamente el portaobjetos con el tejido en una jarra Coplin llena de etanol al 100% a temperatura ambiente y dejar reposar durante al menos 5 min (este tiempo puede ser más largo si es necesario).
NOTA: etanol 100% frío también podría ser utilizado. - Retire la diapositiva con el tejido, absorber y expulsar el exceso de etanol con una Kimwipe (sin tocar el tejido fijado), y dejar el portaobjetos se seque al aire durante 1 hora.
- Vaya directamente al paso 2 o mantener diapositivas secas en el aire de baja humedad o en una cámara de desecación durante semanas a meses, incluso antes de realizar la hibridación.
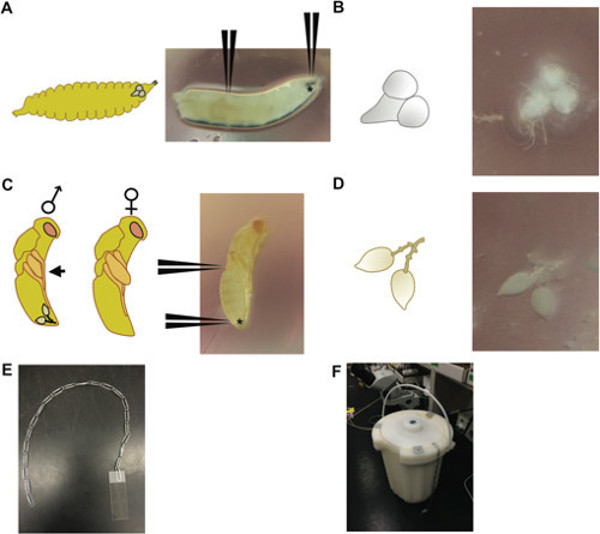
Figura 1: (A) Un estadio Drosophila larva 3 rd (derecha), con posiciones indicadas para dónde agarrar los ganchos de la boca (indicado con *) y 2/3 del camino hacia abajo las larvas para diseccionar los cerebros; (Izquierda) un esquema de una larva una la misma etapa de desarrollo, que representa la posición relativa del cerebro dentro de la cabeza de las larvas. (B) El cerebro y los ganglios disecados ventral de una larva de Drosophila 3 rd instar (derecha) y un esquema de este tejido (izquierda). (C) 3 días de edad, pupa Nasonia en la etapa de ojo rojo cuerpo amarillo. (D) Un par testículos disecados de un viejo macho pupa Nasonia 3 día (derecha) con posiciones que indica por dónde agarrar la pupa en la parte posterior del abdomen (indicado con *) ya mitad de camino en el cuerpo; (Izquierda) esquemática macho y hembra fue depictingp pupas; pupas macho puede ser distinguido por las alas que no se extienden más allá del perfil sagital (flecha negro), en contraste con las hembras, que tienen alas que se extienden más allá del perfil; la posición relativa del par de testículo se muestra en la pupa masculina. (E) El aparato de una cadena de clips-y método (F) utilizados para sumergir diapositivas en un recipiente de nitrógeno líquido. Cuerdas paperclip múltiples pueden ser utilizados para la inmersión simultánea de múltiples diapositivas.
2. Hibridación in situ (30 min el día 1; 1 hora-2.5 horas durante largos sondas en el día 2)
- Añadir 1 l (100 ng) de cada sonda a 20 l de tampón de hibridación 1.1x. Sonda de pipeta / tampón de hibridación sobre la superficie del tejido fijo (evite tocar el tejido).
- Con cuidado, coloque una hoja de cubierta directamente sobre el tampón de sonda / hibridación, asegurándose de que la hoja de la cubierta se centra directamente sobre el tejido. El tampón debe migrar a the borde exterior de la hoja de la cubierta, sin dejar burbujas de aire.
NOTA: Las pequeñas burbujas que no entran en contacto con el tejido no plantean problemas para el procedimiento. Quite las burbujas grandes levantando cuidadosamente una esquina de la hoja de la cubierta y cuidadosamente caer de nuevo en la diapositiva. - Coloque el deslizamiento de diapositivas / tejido / cubierta en la superficie de un bloque pre-calentado a 95 ° C (tapa arriba). Cubra con una hoja grande de papel de aluminio para evitar la exposición a la luz. Deje que la diapositiva se incuba a 95 ° C durante 5 min.
NOTA: un bloque de calor típico con agujeros para los tubos puede dar la vuelta para proporcionar una superficie plana sobre la que colocar la corredera / tejido / cubreobjetos. - Retire la tapa, dejar que se enfríe un poco hasta que esté caliente al tacto. Envuelva cuidadosamente un trozo de Parafilm extendía alrededor de la hoja de la cubierta para sellar el líquido debajo de ella.
- Colocar el portaobjetos sellado dentro de una cámara de humedad y colocar la cámara en un incubador precalentado a 30 ° C. Se incuba a 30 ° C durante 4 horas a la noche.
- Crear una cámara de humedad a partir de una caja de propina vacía o contenedor Tupperware con tapa con Kimwipes humedecidas o toallas de papel colocadas en la parte inferior.
NOTA: oligo sondas ADN de cadena sencilla se han diseñado para ser 28 a 33 bases para alcanzar una temperatura de fusión teórica (Tm) de 45 a 47 ° C. Estos rangos m de longitud y T reflejan el hecho de que muchas secuencias repetitivas que hemos estudiado son ricas en AT y por lo tanto tienen muy bajo contenido de GC. Sondas más largas probablemente tendrán valores de M T más altas; esto puede resultar en una mayor hibridación de fondo en la temperatura de hibridación estándar de 30 ° C. Por lo tanto, puede ser necesaria alguna solución de problemas con temperaturas de hibridación para lograr los mejores resultados. Para encontrar la mejor temperatura de hibridación, el aumento (o disminución) de la temperatura de 5 ° C, de forma incremental.
- Crear una cámara de humedad a partir de una caja de propina vacía o contenedor Tupperware con tapa con Kimwipes humedecidas o toallas de papel colocadas en la parte inferior.
- Retire con cuidado el Parafilm de la diapositiva y luego retire con cuidado la hoja de la cubierta lentamente levantando una esquina. Washingtonsh el portaobjetos tres veces durante 15 minutos cada lavado en tampón SSC 0,1x. Tapar el frasco Coplin con papel de aluminio durante los lavados para minimizar la exposición de la luz.
- Si no se utiliza una sonda biotinilada largo, continúe con el paso 2.8.
- Si se utiliza una sonda larga biotina, seque el área alrededor del tejido con un Kimwipe, teniendo cuidado de no tocar el propio tejido. Coloque 100 l de solución de bloqueo sobre el tejido y cubrir suavemente con un cubreobjetos, teniendo cuidado de evitar burbujas de captura. Envolver el portaobjetos sobre el cubreobjetos con Parafilm y lugar a 37 ° C durante 30 min.
- Retire con cuidado el cubreobjetos y borra todo el tejido con una Kimwipe. Pipetear 100 l de avidina-rodamina diluido 1: 1000 en SBT atención sobre el tejido y cubrir ligeramente con un cubreobjetos, tomando para evitar que queden atrapadas burbujas. Envolver el portaobjetos sobre el cubreobjetos con Parafilm y lugar a 37 ° C durante 30 min.
- Retire con cuidado el cubreobjetos y lavar la diapositiva 3 veces durante 5 minutos en cada una de 4x SSCT y después3 veces durante 5 minutos cada uno en SSC 0,1x.
NOTA: Las diapositivas se puede lavar por períodos más largos de tiempo.
- Retire la corredera y borrar todo el tejido con una Kimwipe seco para eliminar el exceso de tampón (evite tocar el tejido). Coloque el lado del tejido de diapositivas en un lugar oscuro durante 10-15 minutos o hasta que la humedad se disipa por completo.
- Pipetear 11 l de medio de montaje Vectashield (con 4 ', 6-diamidino-2-fenilindol-DAPI) sobre el tejido. Con cuidado, coloque un cubreobjetos limpio (no tratados con Sigmacote) directamente sobre el centro del medio de montaje y el tejido. El medio de montaje debe migrar lentamente hacia fuera, hacia los bordes de la hoja de la cubierta.
NOTA: Si el medio de montaje no logra alcanzar el borde de la hoja de la cubierta en todos los lados, entonces un 2.1 l adicional de medio de montaje se puede aplicar a una posición en el borde de la hoja de la cubierta para rellenar el volumen necesario. En este caso, asegúrese de limpiar cualquier exceso de medio de la superficie de deslizamiento antesde sellado. - Selle los bordes de la hoja de la cubierta con esmalte de uñas. Evite pintar el esmalte de uñas sobre la muestra de tejido.
- Colocar el portaobjetos en posición vertical en un lugar oscuro y dejar que el clavo seco polaco hasta que esté completamente duro (normalmente 30 minutos o más). En este punto, la imagen del tejido o almacenar a -20 ° C durante un máximo de 1 semana para imagen más tarde.
Buffer / Solución Recetas
10x PBS
- 80 g de NaCl
- 2,0 g KCl
- 14,4 g de Na 2 HPO 4
- 2,4 g KH 2 PO 4
- pH a 7,4, H 2 O para 1 L
1x PBT
- 5 ml PBS 10x
- 45 ml de H2O
- 0,1% de Tween 20
20x SSC
- 175,3 g NaCl
- 88,2 g de Citrato de Na
- en 800 ml de H2O
- pH a 7, H 2 O para 1 L
4x SSCT
- 200 ml de 20x SSC
- 799 ml de H 2 O
- 0,1% de Tween 20
0,1x SSC
- 5 ml de 20x SSC
- 995 ml de H2O
Mezcla de hibridación (20 l; modificado a partir de 11)
- 10 l de formamida
- 4 l 50% de sulfato de dextrano
- 2 l de 20x SSC
- 4 l H 2 O
SBT 8 (10 ml)
- 2 ml de 20x SSC
- 0,01 g Albúmina de suero bovino (BSA)
- 10 l de Tween 20
- 7,9 ml de H2O
Solución de bloqueo 8 (10 ml)
- 0,3 g BSA
- 10 l de Tween 20
- 2 ml de 20x SSC
- 8 ml de H2O
Solución de fijación con paraformaldehído (1 ml)
- 393,75 l H2O (agregar agua primero)
- 450 ácido acético glacial l
- 156,25 l 16% de paraformaldehído
Resultados
Para demostrar este método, hibridizada un conjunto de pequeñas oligos sintetizados comercialmente que se han modificado químicamente con conjugados fluorescentes (Figura 2) y una sonda biotinilada más larga (realizada a través de traducción nick de un producto de PCR; Figura 2B), a los cromosomas de varios tejidos diferentes tipos (ver Tabla 1). Las secuencias diana incluyen repeticiones satélite ubicadas en pericentromeric regiones (heterocromáticas) de los cr...
Discusión
ADN ISH se utiliza con frecuencia para mapear secuencias específicas a los cromosomas. Hemos descrito un método sencillo para el ADN ISH optimizado para alto número de copias, heterochromatic secuencias. En lugar de usar lavados en una solución de formamida, que es un requisito en otros protocolos de ISH de ADN existentes, ponemos diapositivas montado de tejidos directamente en un bloque de pre-calentada para desnaturalizar el ADN. Este método evita el uso de grandes cantidades de formamida. Un paso fundamental par...
Divulgaciones
The authors declare that they have no competing financial or any other conflict of interest.
Agradecimientos
We thank Zhaohua Irene Tang in the W. M. Keck Science Department for the use of her epifluorescence microscope and the Werren lab for donating Nasonia for dissections. This work was supported in part by an NIH-NRSA fellowship (5F32GM105317-02) to AML.
Materiales
| Name | Company | Catalog Number | Comments |
| Poly-L-lysine coated slides (regular slides also can be used) | Sigma Aldrich | ||
| Ultrafine tweezers (5 gauge) | Dumont | ||
| 22 x 22 mm cover slips | Fisher | Sigmacote-treated by immersion for 15 sec, blotting dry, and wiping away all traces of Sigmacote so that cover slip is clear | |
| Sigmacote | Sigma | ||
| Filter paper | 75 - 150 mm | ||
| Paraffin wax paper | |||
| Heat block with thermometer | |||
| Dry incubator | |||
| Razor blades | |||
| Humidity chamber | empty pipette tip box or Tupperware, lined with moistened paper towels or Kimwipes | ||
| Coplin jars | with slide grooves | ||
| Aluminum foil | |||
| Pasteur pipettes | |||
| 1.5 ml microfuge tubes | |||
| Nail polish | clear or colored | ||
| P20 micropipette and plastic tips | |||
| Paperclips | 20 - 25 standard metal paperclips linked to form a chain | ||
| Reagents | |||
| 16% EM grade paraformaldehyde | Electron Microscopy Reagents | ||
| Acetic acid | Sigma | ||
| Liquid nitrogen | |||
| 100% Ethanol, chemical grade | |||
| Commercially synthesized, fluorescently labeled oligos | |||
| Long biotinylated probe | Invitrogen; Alternative steps 2.7.1-2.7.3 | e.g., nick translated and biotinylated with BioNick from Invitrogen | |
| Rhodamine-Avidin | Roche; Alternative steps 2.7.1-2.7.3 | for detection of long biotinylated probe | |
| Hybridization buffer | Recipe above | ||
| 4x SSCT | Recipe above | saline-sodium citrate + Tween | |
| 0.1x SSC | Recipe above | saline-sodium citrate | |
| Blocking solution | Recipe above | ||
| SBT | Recipe above | SSC, bovine serum albumin, Tween | |
| 1x PBT | Recipe above | phosphate-buffered saline + Tween | |
| 1x PBS | phosphate-buffered saline | ||
| Hypotonic solution | 0.5% sodium citrate in H2O | ||
| Formamide | Sigma Aldrich | ||
| Vectashield mounting medium with DAPI | Vector laboratories | ||
Referencias
- Blattes, R., Kas, E. Fluorescent in situ hybridization (FISH) on diploid nuclei and mitotic chromosomes from Drosophila melanogaster larval tissues. Cold Spring Harbor Protocols. 2009 (9), (2009).
- Dimitri, P. Fluorescent in situ hybridization with transposable element probes to mitotic chromosomal heterochromatin of Drosophila. Methods in Molecular Biology. 260, 29-39 (2004).
- Pardue, M. L. In situ hybridization to polytene chromosomes in Drosophila using digoxigenin-labeled probes. Cold Spring Harbor Protocols. 2011 (8), 1003-1006 (2011).
- Hoskins, R. A., et al. Heterochromatic sequences in a Drosophila whole-genome shotgun assembly. Genome Biology. 3 (12), (2002).
- Hoskins, R. A., et al. Sequence finishing and mapping of Drosophila melanogaster heterochromatin. Science. 316 (58331), 1625-1628 (2007).
- Treangen, T. J., Salzberg, S. L. Repetitive DNA and next-generation sequencing: computational challenges and solutions. Nature Reviews Genetics. 13 (1), 36-46 (2012).
- He, B., et al. Mapping the pericentric heterochromatin by comparative genomic hybridization analysis and chromosome deletions in Drosophila melanogaster. Genome Research. 22 (12), 2507-2519 (2012).
- Pimpinelli, S., Bonaccorsi, S., Fanti, L., Gatti, M. Fluorescent in situ hybridization (FISH) of mitotic chromosomes from Drosophila larval brain. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Larracuente, A. M., Noor, M. A., Clark, A. G. Translocation of Y-linked genes to the dot chromosome in Drosophila pseudoobscura. Molecular Biology and Evolution. 27 (7), 1612-1620 (2010).
- Ferree, P. M., Barbash, D. A. Species-specific heterochromatin prevents mitotic chromosome segregation to cause hybrid lethality in Drosophila. PLoS Biology. 7 (10), e1000234 (2009).
- Williams, B. C., Karr, T. L., Montgomery, J. M., Goldberg, M. L. The Drosophila l(1)zw10 gene product, required for accurate mitotic chromosome segregation, is redistributed at anaphase onset. The Journal of Cell Biology. 118 (4), 759-773 (1992).
- Gatti, M., Bonaccorsi, S., Pimpinelli, S. Looking at Drosophila Mitotic Chromosomes. Methods in Cell Biology. 44, 371-391 (1994).
- Werren, J. H., Stouthamer, R. PSR (paternal sex ratio) chromosomes: the ultimate selfish genetic elements. Genetica. 117 (1), 85-101 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados