Method Article
Grabación combinado de salida Mecánicamente estimulada aferente y nervio terminal Etiquetado en ratón del pelo del folículo lanceoladas Endings
En este artículo
Resumen
A simple and novel technique for recording afferent discharge due to mechanical stimulation of lanceolate terminals of palisade endings innervating mouse ear skin hair follicles is presented.
Resumen
Una nueva técnica de disección y grabación se describe para el disparo de monitoreo aferente evocada por desplazamiento mecánico de pelos en el pabellón de la oreja del ratón. La técnica es muy rentable y fácilmente llevado a cabo con los materiales que se encuentran comúnmente en la mayoría de los laboratorios de electrofisiología, o fácilmente adquiridos. La disección es sencillo y rápido, con el desplazamiento mecánico proporcionado por una oblea de electrocerámica genérico controlado por software propietario. El mismo software también registra y analiza la salida electroneurograma. La grabación de la actividad nerviosa evocada es a través de un amplificador diferencial comercial conectado a microelectrodos de vidrio estándar pulida al fuego. Consejos útiles se dan para mejorar la calidad de la preparación, la estimulación y las condiciones de grabación para optimizar la calidad de grabación. El sistema es adecuado para el ensayo de las propiedades electrofisiológicas y ópticas de terminales lanceoladas de terminaciones en empalizada de los folículos pilosos, así como lalos resultados de su manipulación farmacológica y / o genético. Se da un ejemplo de la combinación de registro eléctrico con la estimulación mecánica y etiquetado con un colorante vital estiril piridinio.
Introducción
Los terminales lanceoladas de los axones sensoriales que inervan los folículos pilosos de los mamíferos forman empalizadas de todo el epitelio-tallo del pelo. Su propósito es detectar el desplazamiento mecánico de los pelos que rodean. Son una mezcla de adaptarse rápidamente y poco a poco terminaciones que producen predominantemente pequeños momentos de actividad en respuesta al movimiento del cabello. Actividad deja muy rápidamente cuando el movimiento se detiene, incluso en presencia de desplazamiento continuo. A continuación se describe el desarrollo de este modelo murino pabellón auricular para los estudios correlativos de la estructura y función de los terminales lanceoladas. El pabellón auditivo tiene muchas características ventajosas para el estudio de estas terminaciones. En primer lugar, el pabellón auricular es esencialmente dos capas de la piel yuxtapuestas espalda con espalda, con poco tejido entre sí para interferir con el acceso a los folículos y terminales. La piel es muy delgada y es fácil diseccionado debido a cantidades mínimas de tejido conectivo duro. La inervación es fácilmente accesible e identificable. Mientras que el pelo folliclES están presentes, se distribuyen relativamente poco, lo que facilita la estimulación de grupos individuales o pequeños de folículos mecánicamente. La capa dérmica subyacente fina proporciona una buena accesibilidad a los terminales nerviosos con fármacos farmacológicos y colorantes. Esto los hace particularmente ideal para los estudios de imagen mediante microscopía de fluorescencia. La formación de imágenes puede estar o bien en terminales vivos, o después de la fijación y posterior procesamiento histológico.
Las respuestas de las neuronas que inervan mechanosensory folículos pilosos tradicionalmente se han estudiado en roedores vibrisas 1,2 y, en menor grado, en preparaciones para la piel aisladas 3,4. Estos han enseñado mucho acerca de los principios generales de la fisiología mecanosensorial en los terminales de los nervios que rodean el eje del pelo. La preparación vibrissal permite el control exquisito sobre el movimiento de un solo folículo piloso. Sin embargo, puede ser difícil de descifrar la salida debido a su complejidad, como vibrissalfolículos contienen al menos 8 diferentes tipos de anatómicamente distintos final mecanosensorial 5 y la coincidencia de estos tipos morfológicos a respuestas electrofisiológicas específicas es todavía un tema de controversia. La preparación de los nervios de la piel del ratón / safena se utiliza con mayor frecuencia en su estado depilada para investigar tacto y el dolor respuestas. La inervación de los folículos pilosos en una preparación de este tipo es menos complejo, pero la densidad de los folículos del pelo, además de la presencia de tres tipos folículo diferentes (de guardia, Punzón / auchene y pelos en zigzag) en tal proximidad 6, significa el estudio de las respuestas específicas de un único folículo o un solo tipo de terminación es más difícil. Además, esta preparación implica una disección compleja. Por último, tanto en vibrissal y otros productos para la piel, es difícil de visualizar las terminaciones implicadas mientras que el ex vivo de las preparaciones siguen vivos. Por lo tanto, se requiere seccionar los tejidos, incluso en las líneas de ratón que expresan GFP. alternativamente, se requiere más procesamiento histológico / inmunológica, tales como la fijación y / o anticuerpos de incubación para inmunofluorescencia.
Por ello, hemos desarrollado la preparación pabellón auricular y lo utilizó para hacer grabaciones eléctricas a partir de una población restringida de los aferentes del folículo piloso y mostrar que el ciclismo membrana se produce en estas terminaciones lanceoladas, evidenciado por la absorción de tintes estirilo piridinio. Por último, hemos demostrado que el colorante no interfiera con la sensibilidad mecánica, lo que indica que no bloquea los canales mechanotransduction. Se ilustran los resultados de los protocolos de estimulación y análisis simples.
Protocolo
la cosecha de tejidos post mortem ratón debe utilizar métodos aprobados éticos. En el Reino Unido, la dislocación cervical es un método aprobado por el gobierno ratones adultos (un método que aparece en el Anexo 1 los Animales del Reino Unido (Scientific Procedures) Act de 1986 y la Directiva Europea 2010/63 / UE). Esta legislación se aplica localmente en la Universidad de Aberdeen por el Bienestar Animal y Ética Junta de Revisión que revisó y aprobó todos los procedimientos utilizados en el siguiente protocolo.
Nota: Estos métodos fueron utilizados en la investigación publicada en Banks et al 7.
1. Preparación para los oídos Electrofisiología
- Antes de la disección, preparar una solución salina fisiológica estándar, como Liley de (1956) y saturar con 90% O2 / 5% de CO 2. Solución salina de Liley (mM) se compone de: NaHCO 3 (12), KCl (4), KH 2 PO 4 (1), NaCl (138,8), MgCl 2 (1), CaCl 2 (2) y glucosa(11).
- Humanitariamente la eutanasia a un ratón adulto sin dañar el cráneo cerca de los oídos. Aquí utilizamos ratones C57 / BL6J y MF1 pero cualquier cepa de ratón estándar de laboratorio puede utilizarse. Lo ideal es utilizar ratones que son <25 g si la grabación eléctrica es para ser combinado con tinte de etiquetado estirilo, como el etiquetado en ratones más grandes es menos fiable, a menudo se encuentra sólo en las zonas circunscritas restringidas.
- Retire la cabeza con grandes tijeras o cizallas de hueso.
- Coloque el lado dorsal de la cabeza en gaseados Liley de en un plato de suela amplia disección (50 cm suele ser conveniente) en el escenario de un microscopio de disección estéreo. Regularmente (~ 10 min) de compuerta o sumergir la cabeza con solución salina gaseados.
- incisión cuidadosamente y separar la piel de la base del oído externo (pabellón de la oreja) con unas tijeras Springbow y # 3 fórceps, exponiendo el cartílago del meato auditivo externo (EAM). Identificar las ramas del trigémino (división mandibular, MDV) y grandes nervios auriculares a medida que surgen from el cráneo en la hendidura del proyecto conjunto y mandibular a través de la base de cartílago para inervan la parte cóncava (anterior) y convexas (posterior) aspectos de la piel del pabellón auricular, respectivamente.
- Cerca del cráneo, identificar donde las ramas del nervio dos de salida en la ranura entre la mandíbula y la apófisis mastoides. Maximizar su longitud tirando suavemente del pabellón auricular lejos del cráneo y cortar los nervios tan cerca del cráneo como sea posible.
- Retire el pabellón de la oreja de la cabeza con las tijeras Springbow, teniendo cuidado de evitar los muñones distales de los nervios divididos y la minimización de la cantidad de pelaje denso en la base de la oreja que se elimina.
- Transferir el pabellón de la oreja a un caucho de silicona flexible (PDMS) -lined plato lleno de líquido gasificado de Liley. Abra la EAM dividiéndolo en su punto más estrecho (más anterior). Aplanar el pabellón de la oreja, la piel anterior (cóncava) y el pin lado negativo a las PDMS cuidadosamente en los bordes con ~ 6-8 regularmente espaciados muy finos (~ 0,2 mm de diámetro) pasadores de insectos.
- Movimiento rápido del ojoove la piel de la cara posterior del pabellón auricular completamente y retirar parcialmente el cartílago pabellón auricular mediante disección roma con # 3 fórceps, asegurando la piel anterior se deja intacta.
- Con la punta de un alfiler de insectos bien captado por el nº 3 de fórceps, se extiende suavemente las ramas (por lo general 2) del MDV que emergen posteriormente entre la piel y los cartílagos EAM. Pin de estos para el PDMS con los más finos posibles pasadores de insectos, empalar el tejido conectivo adyacente a sus extremos cortados y no los propios troncos nerviosos.
- Eliminar la mayor parte del tejido conectivo circundante alrededor de ellos, evitando cuidadosamente los daños causados por el exceso de tracción o de corte.
2. Disposición de la grabación electrofisiológica
- Pin de la piel del pabellón auricular a la base de una cámara de registro con finos alfileres de insectos alrededor de los bordes de PDMS-alineados (~ 6-8 por oído), la colocación de los nervios limpiados en la base de la oreja cerca de dos electrodos de succión - una para la grabación (para tomar el nervio) y el otella un electrodo indiferente (para proporcionar la señal neutra a un amplificador diferencial, véase 7).
- Para el electrodo de registro, haga coincidir cuidadosamente la abertura y el diámetro interno de la abertura con el grosor combinado de los dos nervios, de modo que encajan ajustadamente como sea posible y tan grande una longitud posible.
- Dibujar los nervios en el electrodo por succión suave de una jeringa 2 ml unido al otro extremo con un tubo de goma de silicona. Asegúrese de que los nervios son rectas, no plegado o doblado.
- Desarrollar un alto ajuste de resistencia / impedancia eléctrica mediante el uso de una succión más fuerte para extraer el tejido conectivo o un tejido adiposo para formar un tapón que sella herméticamente la abertura alrededor del nervio.
- Llene el otro electrodo (indiferente) con solución salina por aspiración si es necesario (se puede llenar por acción capilar).
- Coloque los cables de grabación idénticos (plata o platino) en el orificio interno de los electrodos de registro para contactar con la solución salina y el nervio(Grabación) o estrecha, extremo pulida al fuego (indiferente) del electrodo. Cada electrodo está soldado de forma individual a los diferentes núcleos de cable blindado de dos hilos. Coloque el electrodo de baño (suelo) (Ag / AgCl pellets) en el baño, y lo molió a la pantalla del cable de dos conductores conectados a los electrodos de registro.
- Alimentar la actividad eléctrica de los dos electrodos en los canales separados de un amplificador diferencial, filtro (banda de paso obligatorio 0,2-2 kHz), y la vista en una pantalla de osciloscopio. Compruebe que el canal A (grabación) y el canal B niveles de ruido eléctrico (indiferente) parecen similares. En esta etapa puede que no sea posible ver los potenciales de acción espontáneos normales en el canal A antes de que los dos electrodos están equilibrados.
- Corregir cualquier diferencia en el ruido de fondo entre los electrodos mediante el aumento de la impedancia de la grabación (canal A) o electrodos indiferentes (canal B). Para ello, la succión del tejido conectivo areolar (adiposo) más lejos en ninguno de los electrodos, y /o la aplicación de una mayor fuerza de aspiración de la jeringa 50 ml.
- Una vez "equilibrada" de esta manera, cambiar de nuevo a la diferencia de la grabación (AB) y buscar potenciales de acción espontáneos (AP) en la traza o cuando se frota ligeramente pelos en el margen del pabellón auricular. Si no se observa actividad (spiking), re-comprobar el ajuste apretado del nervio en el electrodo de registro y el tejido conectivo areolar en el electrodo indiferente - por lo general el más fuerte (mayor resistencia) el sello y el más iguales la impedancia en los dos electrodos, mejor. Con la práctica, con ello se consigue una buena calidad (> 2: 1) relación señal: ruido.
- Registre el electroneurograma a través de una interfaz de software de laboratorio de electrofisiología y se ejecuta en un ordenador. Una salida de audio de un rápido aumento es muy útil y se puede lograr por la alimentación de la neurogram a través de un amplificador de audio y un altavoz de audio asociado. Ajustar el umbral para ser justo por encima del ruido de la línea de base (identificados por la ausencia de blanco-nOise 'silbido').
- Para aumentar fluorescente acceso tinte estirilo a las terminaciones lanceoladas de drogas o, cuidadosamente retire la capa adiposa sub-cutánea cerca del margen del pabellón auricular, abriendo una ventana de ~ 5 mm x 5 mm de la exposición de la dermis y la base de los folículos (Figura 1A, B ).
- Plegar hacia atrás un pliegue de ~ 1 mm de piel de oreja adiposo de aduana en el borde delantero (a nivel de la ventana se acaba de producir, en su caso), dejando un espacio lleno de solución salina clara entre las capas de la piel yuxtapuestas. Frotar suavemente los pelos que sobresalen a lo largo del borde doblado con un alfiler o unas pinzas finas puestas a tierra, sin tocar la piel, para localizar la zona de máxima salida de AP en el osciloscopio y el distintivo 'clics' y 'pops' en la salida de audio.
3. Los potenciales de acción evocados-Estímulo de grabación
- Coloque la sonda de estimulación mecánica - 10 cm de vidrio de borosilicato de microelectrodos pulida al fuego unido a un Ceramic piezoeléctrico actuador - lo que el movimiento es paralelo con el pliegue de la piel. Coloque la punta alrededor de 0,5-1 mm de pliegue de la piel, por lo que toca a los pelos, pero no la piel. Verificar la estimulación efectiva moviendo lentamente la punta de la sonda manualmente para desviar los pelos y observar / escuchar el rápido aumento.
- Utilice el software para manejar la estimulación mecánica de 1-3 pelos (por ejemplo 3 segundos a 5 Hz sinusoides, cada 10 seg. La sonda desplazamiento 200-500 micras), y registrar las respuestas evocadas por estimulación de los nervios.
- Dar varios trenes de estimulación mecánicas idénticas a intervalos de 10 seg. Optimizar la posición de la sonda de repetibilidad, a continuación, reducir la frecuencia de estimulación de acuerdo con un protocolo experimental (por ejemplo, tasa de repetición caída de 10 seg a 30 seg).
- Utilice el software para discriminar la actividad de AP-como por ejemplo, usando un umbral sencillo ajustado a ~ 2x la amplitud del ruido de alta frecuencia y ~ 25% de los puntos de acceso más grandes.
- Contar los puntos de acceso que cruzan el umbral"eventos", cuantificando la frecuencia y características de los puntos de acceso producidos.
4. La cocción-evocó Estímulo de impresión combinados con N- (3-triethylammoniumpropyl) -4- (4- (dibutilamino) estiril) piridinio dibromuro de Etiquetado
- Para examinar los efectos de los colorantes de estirilo de cocción provocada por estímulo aferente y etiquetado terminal, añadir la concentración apropiada de un colorante de estirilo de elección, a la solución de baño y continuar con la grabación eléctrica.
- Después de que el tiempo de exposición requerido (por lo general al menos 30 min), preparar la preparación para la visualización de los folículos. Despliegue la aleta de la piel mediante la eliminación de los pasadores de retención, y exponer la zona dérmica autorizado para revelar la denominación de los terminales.
- Eliminar el tinte externa con solución salina libre de tinte, haciendo 3 cambios completos de solución salina.
- Incubar en el cambio final de solución salina libre de tinte gaseados durante 10-15 minutos para permitir que la contaminación de tinte más persistente que se filtre a partir de membranas expuestas / externos.
- Eliminar tinte no internalizado restante en membranas con un agente secuestrante (sulfobutylated beta-ciclodextrina, 1 mM, 5 min) en solución salina.
- La transferencia de la cámara de la grabación en la platina de un microscopio de epifluorescencia vertical y enganchar la cámara con el mecanismo de movimiento de la platina / diapositiva.
- Iluminar con la preparación adecuada de luz de excitación para el tinte de estirilo. Utilice un objetivo de microscopio 10X o 25X de fluorescencia para observar el etiquetado folículo (Figura 1).
Resultados
La disposición de registro electrofisiológico, con el tejido adiposo subcutáneo retira para exponer los folículos pilosos, se muestra en la Figura 1A. Una parte de esta área expuesta se muestra con una ampliación mayor en iluminación de campo claro en la Figura 1B. Al doblar el margen de oreja hacia arriba y atrás sobre sí mismo en esta área expone la superficie epidérmica. Esto posiciona los pelos en el borde de la tapa para sobresalir horizontalmente, en una situación ideal para la estimulación mecánica con una sonda roma (no mostrada). La Figura 1C muestra que después de la exposición de tinte y devolver el margen a la posición desplegada de nuevo, los folículos estimulados en esta posición se han marcado con un colorante estiril piridinio. Electroneurograms a partir de preparaciones típicamente muestran actividad AP en curso, incluso en ausencia de movimiento impuestas de la sonda de fibra de vidrio, que incluye puntos de acceso de la mayor dimensión (Figura 2A i-iii). Actividad se produce a una velocidad de aproximadamente 10 a 20 impulsos / seg (traza 'picos'), sin mostrar la estructura o signos de tonicidad, como el auto-correlación para los intervalos entre los periodos de estimulación son bastante plana. Durante 5 Hz, 100 micras estimulación mecánica de los ejes del pelo, la producción global normalmente se eleva a 20-50 impulsos / seg, o 4-10 por ciclo sinusoidal. Construcción de histogramas ciclo continuación, revela una fuerte arrastre (la llamada 'fase de bloqueo') de las respuestas (Figura 2Bi-iii)). Esto es bastante repetible, aunque la fase de la forma de onda en la que las respuestas están bloqueados depende de su posición, es decir, momento en el cual en el movimiento de los vibradores de la sonda entra en contacto con el pelo. Un simple detección de umbral (línea horizontal que cruza las huellas neurogram en A (i-iii)) se ha utilizado para este análisis. Sin embargo, la funcionalidad de software de grabación a menudo se puede utilizar de una manera más sofisticada paradiscriminar características de tamaño y forma espiga. Esto puede aislar a las respuestas de las fibras aferentes particulares por estas características para permitir el análisis de una sola grabación de pseudo-unidad que ha de realizar.
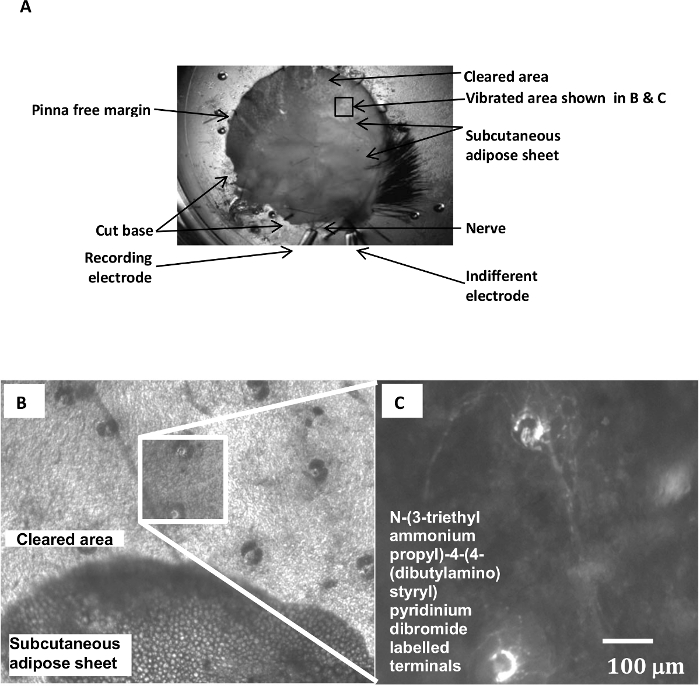
Figura 1:. Disposición registro electrofisiológico y N- (3-triethylammoniumpropyl) -4- (4- (dibutilamino) estiril) piridinio dibromuro de Etiquetado de folículo piloso terminaciones aferentes lanceoladas (A) Un pabellón auricular preparación establecieron para un experimento electrofisiológico mostrando el pabellón auditivo la orientación, la localización de los nervios, los electrodos de registro y el área expuesta de la inervación folículo después de la eliminación del tejido adiposo. (B) Varios folículos pilosos son visibles en iluminación de campo brillante en el área despejada de los tejidos adiposos suprayacente a la dermis. La oscuridad, por lo general bilobulado, las formas son las glándulas sebáceas. ( C) Vista ampliada del área de caja en B) muestra dos terminaciones lanceoladas, marcadas con el colorante de estirilo N- (3-triethylammoniumpropyl) -4- (4- (dibutilamino) estiril) dibromuro de piridinio y fotografiado después de la estimulación mecánica mediante microscopía de epifluorescencia . Del 7, con el permiso. Haga clic aquí para ver una versión más grande de esta figura.
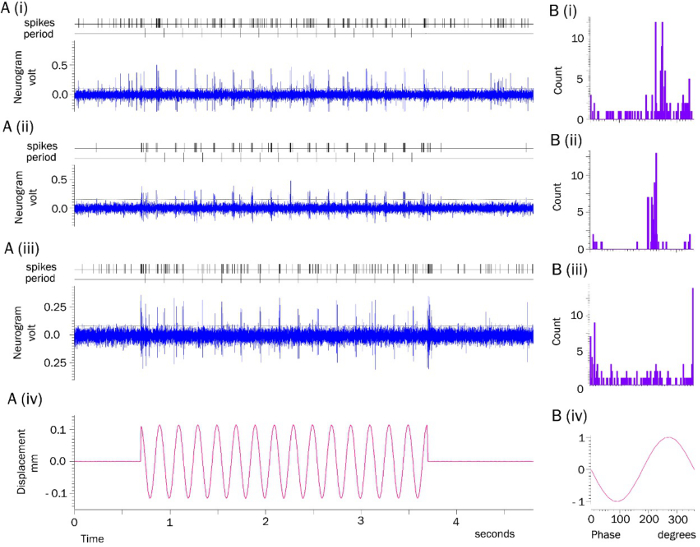
Figura 2: (a) La actividad provocada por estímulo de grabación del ratón Pinna. (Ai-iii) Los ejemplos, tomados de 3 experimentos diferentes, de la actividad de neurograms continuos de pabellones auriculares en solución salina estándar de Liley. Cada registro muestra una sección 5 segundos aproximadamente 5 minutos después del inicio de la grabación, incluyendo un período de 3 segundos de desplazamiento sinusoidal de tanNúmero centro del tallo del cabello. La estimulación mecánica se repitió cada 30 segundos a lo largo de la grabación continua, que generalmente duró durante 1-2 horas. archivos de comandos personalizados marcados eventos individuales que cruzaron un umbral fijado por el cursor horizontal (picos), así como el inicio de cada ciclo sinusoidal (período). (Aiv) La señal de mando para el desplazamiento sinusoidal. (B) Análisis de estímulo evocado Rematar actividad. (Iii) Bi-histogramas de ciclo en 3 ° contenedores construidos a partir de las muestras neurogram (Ai-III) respectivamente, que muestran las respuestas de las terminaciones lanceoladas supuestamente implicados en la estimulación mecánica de 5 Hz desplazamiento sinusoidal de los ejes del pelo por una sonda de vidrio. Tenga en cuenta la fase de bloqueo marcado, en diferentes fases del ciclo, dependiendo de su posición relativa a la posición de partida de la sonda mecánica. (BIV) sonda normalizada desplazamiento sinusoide; la amplitud real era de aproximadamente 1001;. M Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, hemos desarrollado una preparación relativamente simple que puede ser disecado rápidamente, tiene baja densidad folículo del pelo y permite la estimulación mecánica relativamente selectiva de un pequeño número de folículos pilosos. Es de fácil acceso para el registro electrofisiológico y de imagen fluorescente de células vivas, incluyendo las respuestas a los tintes de aplicación para visualizar los folículos del pelo estimulado mecánicamente, es decir, los folículos de imagen con respuestas electrofisiológicas definidos. A pesar de que no lo hemos hecho, este sistema también parece que se presta fácilmente a la sub-división del nervio sensorial por una sola unidad de grabación (solo axón sensorial) y el uso de GFP-expresión dirigida para visualizar la morfología terminal de poner fin sensorial.
Hemos utilizado la preparación de la piel del oído para investigar las características de la internalización y la liberación de los tintes fluorescentes pridinium membrana estirilo 7, una técnica desarrollada originalmente para estudiar Vesic localizadael reciclaje de membrana le en los terminales sinápticos 8. En la sinapsis, la imagen también se combina fácilmente con el registro electrofisiológico simultánea de respuestas en terminales identificados 8,9. Fue en estos primeros estudios que hemos observado por primera vez los tintes también fueron internalizados por las terminaciones mecanosensoriales 10. Para neuronas sensoriales en la cultura y en las células ciliadas cocleares, gran parte del etiquetado por los tintes estirilo piridinio parece implicar colorantes que pasan a través de los canales mechanosensory, que luego bloquean 11,12. Los colorantes luego etiquetar las membranas intracelulares, y esto es irreversible etiquetado. Sin embargo, en células de pelo que no son estimuladas mecánicamente 13,14 y en los terminales completamente diferenciadas primarias sensoriales nerviosas en situ, tales como terminaciones Ia en los husos musculares 15, y en las terminaciones lanceoladas aquí 7, tinte de etiquetado estiril parece reflejar la endocitosis de la membrana, ya que el etiquetado es reversible y no bloquea la res mechanosensoryponses 7,15,16. Mientras que algunos internalización colorante por permeación de canal en estas terminaciones no se puede descartar por completo, es evidente a partir de la cocción continua durante la incubación de colorante y la reversibilidad de la etiqueta que la gran mayoría de la etiqueta en terminales diferenciadas in situ es por internalización con reciclaje de vesículas membrana. Por lo tanto, esta técnica simple se utiliza fácilmente para el control eléctrico y óptico combinado de una gama de funciones de los terminales mechanosensory en los tejidos ex vivo.
Al igual que con la mayoría de las técnicas prácticas, reproducibilidad requerirá la repetición y la práctica. A continuación se describirá algunos de los puntos clave especial atención merece la pena. A lo largo de la disección y grabación de la sesión, maximizar la viabilidad del tejido y la supervivencia asegurando la preparación se perfundió constantemente con solución salina totalmente saturado con 95% O 2/5% de CO 2. Asegúrese de que el pelo de los folículos no sean desplazados durante este proceso, WHIch will estimular la cocción final sensorial. O bien utilizar un sistema continuo de flujo laminar de perfusión, o cuidadosamente gas de burbujas a través del baño de órganos con un tubo fino a una distancia de la preparación, o refrescar cuidadosamente soluciones cada 20 a 30 min, manteniendo la preparación por debajo de la superficie de la solución salina en todo momento. electrodos de registro de succión se hacen mediante la modificación de las pipetas de borosilicato electrodos afilados utilizados normalmente para el registro intracelular. En primer lugar, romper con cuidado las puntas afiladas con # 3 fórceps para dar el diámetro interno apropiado para adaptarse a los nervios y de incendio-polaco por muy breve (1 s <) la exposición a la llama de un mechero Bunsen (ver 2.4 y 2.5). Para obtener una buena relación señal a ruido durante la grabación, es esencial que la impedancia eléctrica (resistencia) en estos dos electrodos es a la vez maximiza y de igualdad. Para ello, prestando atención a lo siguiente en los dos electrodos. Para el electrodo de registro, garantizar el diámetro interno es un ajuste perfecto para el nervio, y la longitud máxima de neRVE se introduce en el electrodo de registro. Trate de usar el tejido conectivo que rodea el nervio para sellar efectivamente la punta del electrodo. Alternativamente, o además, extraer el extremo estrecho de una pieza de tamaño adecuado, cónica de tejido adiposo en junto con el nervio. A continuación, conecte la punta del electrodo mediante la aplicación de succión fuerte para ~ 1 min con una jeringa de 50 ml unida a la tubería. Para una punta bien sellada, aplicando succión fuerte simplemente reforzar la eficacia de la clavija y no dibujar en más líquido o en el nervio. Para evitar daños en los nervios, sin embargo, asegúrese de que el tejido conectivo está amortiguando el nervio de la compresión sobre el material circundante y los cartílagos EAM. El electrodo indiferente debe imitar la resistencia / impedancia del electrodo de registro lo más estrechamente posible. Esto se ve favorecido por la punta hasta lo más pequeño posible una apertura sin tener que sellar cuidadosamente pulido al fuego. Si se necesita más resistencia, a continuación, conecte el extremo del electrodo indiferente con adipoSE tejido conectivo, como se describe anteriormente para el electrodo de registro.
El electrocerámica da un control exquisito sobre desplazamiento mecánico, tanto espacial como temporalmente. Sin embargo, tenga cuidado de hacer las conexiones eléctricas - las altas temperaturas que se destruyan, así que no use la soldadura caliente. Utilice pegamento epoxi cargada con metal, o utilizar una toma de push-fit especialista recomendado por el proveedor. Esto tanto sujetarlo firmemente y establecer la conectividad eléctrica. Coloque la sonda estimulante de vidrio a la electrocerámica con resina epoxi estándar. Fuego-pulimento final de un estándar de 10 cm x borosilicato diámetro del tubo capilar de vidrio de 1,5 mm utilizado para la fabricación de parches o electrodos afilados para registro electrofisiológico para reducir al mínimo el riesgo de daño tisular. Si es necesaria la estimulación del folículo solo pelo, extinción de esmalte de la punta para encajar un solo pelo, y la posición de la sonda con un solo pelo en el interior de la abertura abierta. Esto proporciona un control exquisito sobre un solo pelo. Para dy estiriloe etiquetado, generalmente es más uniforme en los tejidos de los animales más jóvenes. No está del todo claro por qué, pero esto probablemente refleja un menor trauma mecánico y la eliminación más eficaz del tejido profundo de los tejidos más jóvenes. Sea cuidadoso en la eliminación de la capa espumosa asemeja poliestireno expandido que cubre las bases del folículo piloso. Sin embargo, evitar ser demasiado vigorosa, ya que corre el riesgo de eliminar la capa plexo nervioso y los terminales asociados lanceoladas. Si hay poca o ninguna respuesta eléctrica al movimiento folículo del pelo, y la aplicación de tinte de estirilo conduce a etiquetado predominante de las glándulas sebáceas (amarillo / blanco), con distinta autofluorescencia de la base del eje del pelo en lugar de terminaciones lanceoladas (naranja / amarillo), aclaramiento demasiado entusiasta ha dañado los tejidos subyacentes. Por último, utilizando un agente colorante quelante antes de la imagen mejora en gran medida el contraste de imagen y la calidad de las imágenes finales.
Esta técnica podría ser útil en una serie de estudios adicionales. estos coULD incluyen, por ejemplo, la detección de la canal (s) mecanosensorial responsable de las respuestas de estiramiento-evocado, mediante la incubación de la preparación con ligandos farmacológicos selectivos de canales candidatos o cribado de líneas de ratón con tales canales borrados genéticamente. Este último podría combinarse con la evaluación de fluorescencia de cualquier cambio en la morfología de terminales debido a la manipulación genética en las líneas de ratón, por ejemplo, con la expresión de GFP ligado a Npy2r 17. Un último ejemplo puede ser la investigación de la función de las vesículas sinápticas-como (SLVs) 7 en estos terminales lanceoladas examinando el efecto de los moduladores de rotación SLV (Ca, Mg, latrotoxina, ligandos del receptor de glutamato) sobre las respuestas de estiramiento-evocado y la absorción de colorante estiril /lanzamiento. Por lo tanto, esta nueva técnica abre un abanico de posibilidades potencialmente interesantes de la investigación en neurociencias mechansensory.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The work was in part funded by UK Medical Research Council project grant G0601253 to G.S.B. and R.W.B.
Materiales
| Name | Company | Catalog Number | Comments |
| PDMS - Sylgard 184 | Dow Corning | Flexible, inert, translucent solid silicone polymer. | |
| No. 3 Dumont forceps | Fine Science Tools | 11231-20 | |
| Austerlitz Insect pins | Fine Science Tools | 26002-10 | Very fine pins to attach pinna preparation securely to the PDMS with minimal damage. |
| AC Differential Preamplifier | Digitimer | Neurolog NL104A | Amplifying the size of the incoming afferent electroneurogram. Differential recording minimises the extraneous electrical noise and baseline drift. |
| High/Low-pass Filter | Digitimer | Neurolog NL125 | Signal conditioning, by reducing extraneous electrical noise to ensure best signal to noise ratio. |
| Spike Trigger | Digitimer | Neurolog NL201 | Sets the event detector threshold and displays it on the oscilloscope. This shows the action potential detection efficacy. |
| Audio Amplifier & speakers | Digitimer | Neurolog NL120S | Useful audio monitoring for the presencec of electrical firing of the sensory endings while adjusting the mechanical stimulation preparation down the microscope |
| Oscilloscope | Digitimer | PM3380A | We use this old model but any standard oscilloscope will suffice. |
| Piezo electroceramic wafer | Morgan Electroceramics, Southampton UK | PZT507 | Electrophysiology/computer interface |
| Piezo electroceramic powersupply | Home made | 0-200 V DC output to drive the ceramic wafer displacement, with variable electronic control of output via recording/stimulation software and computer interface. We use Spike2 software and 1401micro computer interface. | |
| Electrophysiology Software | Cambridge Electronic Design (CED) | Spike2 v7 | Electrophysiology recording, stimulation and data analysis software |
| Laboratory interface | Cambridge Electronic Design (CED) | 1401 micro | Electrophysiology interface, between the amplifier/filters and the computer. It inputs the electroneurogram and also drives the electroceramic movement. |
| FM1-43/Synaptogreen C4 | Biotium/Cambridge Bioscience | BT70020 | Fluorescent membrane probe that reversibly partitions into the outer leaflet of cell membranes. Used predominantly for monitoring vesicle membrane endo-/exocytosis. |
| Advasep 7 | Biotium/Cambridge Bioscience | BT70029 | A sulfonated b-cyclodextrin derivative that chelates FM1-43 (& other styryl pyridinium dyes) out of the exposed membranes, leaving internalised dye to be seen more clearly by lowering the background labelling/fluorescence. |
| Retiga Exi Fast 1394 | Qimaging | Monochrome, cooled CCD camera - basic model | |
| Volocity 3D Image Analysis Software | Perkin Elmer | Volocity 6.3 | Image capture and analysis software. |
Referencias
- Cahusac, P. M. Effects of transient receptor potential (TRP) channel agonists and antagonists on slowly adapting type II mechanoreceptors in the rat sinus hair follicle. J. Peripher. Nerv. Syst. 14 (4), 300-309 (2009).
- Fagan, B. M., Cahusac, P. M. Evidence for glutamate receptor mediated transmission at mechanoreceptors in the skin. Neuroreport. 12, 341-347 (2001).
- Price, M. P., et al. The mammalian sodium channel BNC1 is required for normal touch sensation. Nature. 407 (6807), 1007-1011 (2000).
- Ranade, S. S., et al. Piezo2 is the major transducer of mechanical forces for touch sensation in mice. Nature. 516 (7529), 121-125 (2014).
- Ebara, S., Kumamoto, K., Matsuura, T., Mazurkiewicz, J. E., Rice, F. L. Similarities and differences in the innervation of mystacial vibrissal follicle-sinus complexes in the rat and cat: a confocal microscopic study. J. Comp. Neurol. 449 (2), 103-119 (2002).
- Li, L., Ginty, D. D. The structure and organization of lanceolate mechanosensory complexes at mouse hair follicles. eLife. 3, 01901 (2014).
- Banks, R. W., et al. Glutamatergic modulation of synaptic-like vesicle recycling in mechanosensory lanceolate nerve terminals of mammalian hair follicles. J. Physiol. 591 (10), 2523-2540 (2013).
- Betz, W. J., Bewick, G. S. Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science. 255 (5041), 200-203 (1992).
- Reid, B., Slater, C. R., Bewick, G. S. Synaptic vesicle dynamics in rat fast and slow motor nerve terminals. J. Neurosci. 19, 2511-2521 (1999).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. J. Neurosci. 12, 363-375 (1992).
- Meyers, J. R., et al. Lighting up the senses: FM1-43 loading of sensory cells through nonselective ion channels. J. Neurosci. 23, 4054-4065 (2003).
- Drew, L. J., Wood, J. N. FM1-43 is a permeant blocker of mechanosensitive ion channels in sensory neurons and inhibits behavioural responses to mechanical stimuli. Molecular Pain. 3 (1), 1 (2007).
- Griesinger, C. B., Richards, C. D., Ashmore, J. F. FM1-43 reveals membrane recycling in adult inner hair cells of the mammalian cochlea. J. Neurosci. 22, 3939-3952 (2002).
- Griesinger, C. B., Richards, C. D., Ashmore, J. F. Apical endocytosis in outer hair cells of the mammalian cochlea. Eur. J. Neurosci. 20 (1), 41-50 (2004).
- Bewick, G. S., Reid, B., Richardson, C., Banks, R. W. Autogenic modulation of mechanoreceptor excitability by glutamate release from synaptic-like vesicles: evidence from the rat muscle spindle primary sensory ending. J. Physiol. 562 (2), 381-394 (2005).
- Watson, S., Aryiku, C., Banks, R. W., Bewick, G. S. Comparison of gadolinium and FM1-43 as blockers of stretch-evoked firing of rat muscle spindle afferents. Proc. Phys. Soc. 21 (PC22), (2010).
- Li, L., et al. The functional organization of cutaneous low-threshold mechanosensory neurons. Cell. 147 (7), 1615-1627 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados