Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tridimensional Ensayo de Cultivo para explorar invasividad de las células del cáncer y la formación de tumores satélite
En este artículo
Resumen
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Resumen
cultivo de células de mamíferos en monocapas se utiliza ampliamente para estudiar diversos procesos fisiológicos y moleculares. Sin embargo, este enfoque para estudiar las células en crecimiento a menudo genera artefactos no deseados. Por lo tanto, el cultivo de células en un entorno de tres dimensiones (3D), a menudo el uso de componentes de la matriz extracelular, surgió como una alternativa interesante debido a su estrecha similitud con el nativo en el tejido vivo o un órgano. Hemos desarrollado un sistema de cultivo celular 3D utilizando dos compartimentos, a saber, (i) un compartimiento central que contiene las células cancerosas embebidas en una actuación gel de colágeno como un tumor macrospherical pseudo-primaria y (ii) un compartimento libre de células periférica hecha de un gel de fibrina, es decir, un componente de la matriz extracelular diferente de la utilizada en el centro, en el que las células cancerosas pueden migrar (frente de invasión) y / o formar tumores microesféricas representan tumores secundarios o satélite. La formación de tumores de satélite en el compartimiento periférico esnotablemente correlacionada con la agresividad conocido u origen metastásico de las células tumorales nativas, lo que hace que este sistema de cultivo 3D único. Este enfoque de cultivo celular podría considerarse para evaluar la invasividad del cáncer celular y la motilidad, las interacciones célula-matriz extracelular y como un método para evaluar las propiedades de fármacos anti-cáncer.
Introducción
La investigación de las características fundamentales y biomédicas de la invasión de células de cáncer / migración y el posterior establecimiento de metástasis es objeto de una intensa investigación de 1,2. La metástasis es la última etapa del cáncer y su tratamiento clínico sigue siendo difícil de alcanzar. Una mejor comprensión de la metástasis en los niveles celular y molecular permitirá el desarrollo de terapias más eficientes 3.
Varias propiedades de las células metastásicas se pueden explorar in vitro 4 incluyendo su stemness y potencial de adquirir un estado de transición (por ejemplo, la transición epitelioide-mesenquimal) para migrar e invadir dentro y desde el tumor primario 5. Sin embargo, la evaluación in vitro de procesos / metástasis invasión ha sido un reto, ya que prácticamente elimina la contribución de la circulación de la sangre / linfático. Los cultivos organotípicos que incorporan fragmentos de tumor en geles de colágeno tienen Previouastuta ha utilizado para controlar la agresividad del cáncer. Aunque se preserva la complejidad de los tumores (por ejemplo, la presencia de células no cancerosas), fragmentos de tumor están expuestos a la difusión medio limitado, a la variación del muestreo, y a un crecimiento excesivo de las células del estroma 6. Un método alternativo consiste en el crecimiento de células de cáncer dentro de los componentes de la matriz extracelular (ECM), que imita el entorno celular en tres dimensiones (3D). La proliferación de líneas celulares de cáncer de mama en un gel de colágeno y / o una matriz derivada de la membrana basal es uno de los ejemplos mejor caracterizados de cultivo celular en 3D. Mediante el uso de entornos de cultivo de células 3D específicas, el conjunto desorganizado observado para las células de cáncer de mama cultivadas en condiciones estándar se puede invertir para la formación espontánea de acinos mamaria y estructuras tubulares 7-10. Además, la formación de esferoides de tumor multicelulares derivados de células de cáncer de adenocarcinoma congregó utilizando diferentes técnicas (por ejemplo, colgando gotas, esferoides flotante, agar empotramiento) constituye ahora el ensayo de cultivo celular 3D utilizado más comúnmente 11-13. Sin embargo, este ensayo está limitado por el conjunto restringido de líneas celulares de cáncer que pueden formar esferoides y por el corto período de tiempo disponible para estudiar las células en estas condiciones.
En esta técnica visualizado, que en el presente documento introduce un ensayo de cultivo celular 3D sofisticado donde las células de cáncer de interés están incrustadas en un gel de colágeno para permitir la formación in vitro de un tumor pseudo-primaria que puede ser, alternativamente, recubierta con una matriz de membrana derivada de sótano. Una vez formado, el tumor primario se pseudo-entonces intercalado en una matriz acelular (gel de fibrina en el presente caso), que permite a las células cancerosas para cruzar la interfaz entre los dos compartimentos de la matriz (véase la Figura 1). Curiosamente, las estructuras similares a tumores secundarios procedentes de la pseudo-tumor primario junto con células cancerosas agresivas aparecen en elgel de fibrina. Tal sistema de cultivo 3D ofrece la flexibilidad requerida para investigar, por ejemplo, medicamentos contra el cáncer, la expresión génica y la célula-célula y / o las interacciones célula-ECM 14-16.
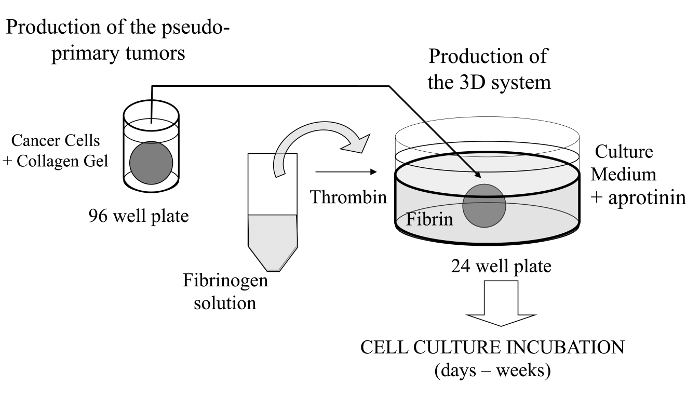
Figura 1:.. Descripción general del método de resumen esquemático del método para generar el sistema de cultivo celular 3D como modelo para estudios de cáncer Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
NOTA: No se cuenta la ética ya que las células cancerosas humanas y animales fueron comprados o amablemente proporcionados a nosotros.
1. Realización de colágeno enchufes (Pseudo-Tumor primario)
- Preparar una dispersión de colágeno. Colágeno de tipo I de tendones de cola de rata (RTT) puede ser o bien extraídas y esterilizadas como se informó anteriormente 17, o comprar. Dispersar el colágeno liofilizado RTT (3,25 a 3,50 mg / ml en 0,02 N de ácido acético) usando un mezclador (ajuste de alta velocidad; cinco carreras 2 min) para una mezcla uniforme.
- Cosecha (tripsina-EDTA, por lo general) y utilizar la exclusión de azul de tripano para el recuento de células viables utilizando un hemocitómetro. Ajuste a la densidad celular deseada (5 x 10 4 células por enchufe).
- Preparar todas las soluciones (NaOH, suero fetal bovino, DMEM 5x, NaHCO 3) por separado (Tabla 1) bajo condiciones estériles y mantener refrigerados en hielo. Nota: El orden de adición de las diversas soluciones es importante para prevenir los choques osmóticos o ácidas en las células.
- Realizar dispersión celular (1,25 x 10 6 células) en la solución de colágeno final (5 ml) lo más rápidamente posible. Mezclar bien (pipeteando arriba y abajo), evitando burbujas de aire, y luego distribuir rápidamente 200 l de la solución lista para el uso en cada pocillo de una placa de 96 pocillos. golpear suavemente la placa de múltiples pocillos en la superficie del área de trabajo de la campana de cultivo de células para eliminar las burbujas de aire y difundir la solución uniformemente en el interior de los pozos.
- Después de llenar todos los pocillos (este paso toma alrededor de 15-20 minutos por placa de 96 pocillos), almacenarlo en la incubadora.
- Incubar la placa a 37 ° C de 2 horas hasta toda la noche. La gelificación del colágeno (es decir, la fibrilogénesis) se produce dentro de 30 min. Añadir medio de cultivo (100 l / pocillo) al cultivo para realizar una incubación durante la noche.
2. La primera capa de fibrina Gel
- Preparación de soluciones de fibrinógeno.
NOTA: El mismo lote de gel de fibrina idealmente se debe utilizar para resul más reproduciblets, la formación de gel como la fibrina puede variar entre los diferentes lotes de fibrinógeno comercial liofilizado.- Siempre use una solución de fibrinógeno recién preparada. Llevar el fibrinógeno liofilizado a temperatura ambiente antes de abrir el vial para evitar la formación de cristales de hidrato.
- Progresivamente disolver el fibrinógeno en pre-calentado (37 ° C) solución salina equilibrada de Hank (HBSS) con Ca2 + / Mg2 + a una concentración de trabajo de 3 mg / ml (considerar la preparación de un exceso de 15% del volumen final mínima requerida : por ejemplo, 17,25 mg en 5,75 ml de una solución de 5 ml).
- Añadir gota a gota pre-calentado HBSS en un primer momento para solubilizar fragmentos de fibrinógeno. Descomponer fragmentos más grandes con una espátula en el vaso de precipitados. Agitar el vaso de precipitados de vez en cuando para facilitar la mezcla. No utilice una placa de agitación durante el procedimiento. Disolver el polvo restante pipeteando la suspensión de arriba abajo.
- Mantenga la solución de fibrinógeno tibia mientras sterilizing la solución pasándola a través de un filtro de 0,22 micras. Nota: Si el HBSS no es lo suficientemente caliente o el fibrinógeno no se disuelve completamente, la solución puede obstruir el filtro. En su caso, reemplace el filtro de una o dos veces, lo que puede disminuir la concentración de fibrinógeno, y por lo tanto la rigidez del coágulo de fibrina.
- Suspender las células de interés (por ejemplo, células endoteliales) en solución de fibrinógeno-lista para usar mientras se ajusta su volumen final, como un procedimiento alternativo.
- Preparación de las soluciones de trombina.
- Preparar una solución madre en ddH 2 O (50 NIH unidades / ml), a continuación, esterilizarla utilizando un filtro de 0,22 micras.
- Utilice una relación / trombina de fibrinógeno ≥1: 0,0075 (v / v) con el fin de generar el gel de fibrina.
- Generando el gel de fibrina.
- Mantenga el fibrinógeno y trombina estéril soluciones madre en el hielo durante todos los pasos a seguir. Los geles de fibrina se les permite formar en placas de 24 pocillos.
- º prontitud superposicióne superficie de cada pocillo con la solución de fibrinógeno (200 l / pocillo), evitando la formación de burbujas de aire. Procedimiento 6 pocillos a la vez.
- Una vez que la solución de fibrinógeno cubre completamente la superficie de los pocillos, la inclinación de la placa en un ángulo de 45 ° y añadir 1,5 l de solución de trombina a la primera bien dejando caer la trombina en el centro del pozo, y luego agitar suavemente la placa en posición horizontal para 1-2 seg.
- Dejar la placa en una posición estable bajo la campana de flujo laminar (5-10 min) hasta que el proceso de gelificación / coagulación ha completado (NB: el proceso de polimerización no debe ser perturbado, por ejemplo, mediante el transporte de la placa a la incubadora).
- Una vez que los primeros seis pozos han polimerizado, repetir la misma secuencia (es decir, los 3 pasos anteriores) para los próximos seis pozos hasta que todos los pozos han sido procesados.
3. Segunda capa de fibrina gel de colágeno e intercalado Plug
- OpciónA: (El uso del tapón de colágeno Inmediatamente).
- Asegúrese de que la primera capa de gel de fibrina se polimeriza en todos los pozos inclinando suavemente la placa. Coloque la placa de 96 pocillos que contiene el lado tapones de gel de colágeno a lado con la placa de 24 pocillos (que contiene los geles de fibrina) para facilitar la transferencia de los tapones de colágeno.
- Añadir una gota de HBSS en cada pocillo de la placa que contiene los tapones de colágeno.
- Retire cada tapón de colágeno del pozo con una aguja delgada montada en una jeringa (utilizado como asa) o utilizando un micro-cuchara (ver video). Transferir cada tapón de colágeno sobre la primera capa de gel de fibrina usando uno o dos micro-cucharas, mientras se asegura de que el tapón de colágeno está bien centrado en el pozo y que la esterilidad se mantiene bien.
- Superposición de gel de fibrina previamente formada con la segunda capa de solución de fibrinógeno (300 l / pocillo) e introducir la trombina como se describe en 2.3, manteniendo un mínimo 1:. Relación de 0,0075 y una secuencia de seis pocillos a la vez
- Opción B (recubrimiento del tapón de colágeno con una capa delgada de la reducción de factor de crecimiento-membrana basal (GFRBM)).
- Enfriar todos las soluciones preparadas e instrumentos de antemano y mantenerlos a 4ºC o en hielo (por ejemplo, pipetas, puntas, tubos de ensayo) durante la manipulación ya alícuotas congeladas de GFRBM son muy sensibles a la velocidad de calentamiento excesivo durante la descongelación (siga las instrucciones del fabricante) .
- Después de la eliminación de los pocillos de la placa, en remojo cada tapón de colágeno durante 2 minutos en un tubo de centrífuga de 1,5 ml en hielo que contiene 100 l de una solución GRFBM puro.
- Transferir cada tapón revestido sobre la primera capa de fibrina garantizando al mismo tiempo que es bien centrada, como se describió anteriormente. Incubar las placas que contiene enchufables a 37 ° C durante 5 min para permitir que el GRFBM para formar un gel. Añadir la segunda capa de fibrina como en el paso 3.1.4.
4. Cell Culture Medium Condiciones
- Llenar cada pocillo con medio de cultivo (400 l). Los medios de cultivo y los suplementos se seleccionarán sobre la base de la línea celular y las condiciones experimentales.
- Añadir aprotinina, un agente antifibrinolítico, al medio de cultivo a una concentración final de 100 unidades de inhibidor de calicreína (KIU) / ml.
NOTA: Guarde las placas en una incubadora de cultivo de células en las condiciones utilizadas para la línea celular probado. - Reponer los cultivos con medio fresco cada dos días o de acuerdo con el calendario experimental, y añade aprotinina. Antes de la adición de medio fresco, ligeramente la inclinación de la placa (en un ángulo de 30 a 35 °) y inclinar la pipeta contra el lado del pozo, mientras que la aspiración cuidadosamente el medio acondicionado en observación constante.
Resultados
Como se mencionó anteriormente, una característica interesante de este ensayo de cultivo de células 3D es que las células cancerosas no sólo pueden migrar desde el tapón de colágeno al gel de fibrina adyacentes, sino también establecer tumores secundarios (estructuras por ejemplo, vía satélite tumorales-like). Esto puede observarse directamente con un microscopio de contraste de fase invertida a bajas y altas magnificaciones a través del espesor de gel, especialmente ...
Discusión
Como un importante nota técnica, es esencial que ningún hueco está presente en la interfaz entre la central y los geles periféricos. De lo contrario, podría reducir la capacidad de las células para migrar / invadir el gel de fibrina. Un espacio entre el colágeno y los geles de fibrina puede formar durante la primera 24 horas de cultivo si la trombina no se ha diluido apropiadamente. También es posible que la línea celular probado podría llevar el gel de colágeno se contraiga durante el cultivo, causando así ...
Divulgaciones
The authors have no disclosure.
Agradecimientos
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materiales
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
Referencias
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados