Method Article
Banco inmovilizado cromatografía de afinidad metálica, reconstitución y ensayo de un Polyhistidine etiquetada metaloenzima para el laboratorio pregrado
En este artículo
Resumen
Aquí presentamos un protocolo para la sobremesa inmovilizado metal afinidad cromatografía purificación y posterior reconstitución de un polyhistidine etiquetada, es hierro no hemo enlace dioxygenase conveniente para el laboratorio de enseñanza de pregrado.
Resumen
Cromatografía de afinidad metálica de sobremesa inmovilizado (IMAC), de proteínas con la etiqueta del polyhistidine es fácilmente dominado por estudiantes de pregrado y se ha convertido en el método de purificación de proteínas más ampliamente utilizado en la literatura moderna. Sin embargo, la aplicación de la cromatografía de afinidad a proteínas de Unión metálicos, especialmente los metales sensibles redox tales como el hierro, a menudo se limita a laboratorios con acceso a una caja de guante - equipo que no está disponible rutinariamente en el pregrado laboratorio. En este artículo demostramos nuestros métodos de trabajo de aislamiento, purificación y metal iones reconstitución de una histidina polivinílico con la etiqueta IMAC, redox-activo, no heme hierro obligatoria extradiol dioxygenase y el ensayo de la dioxigenasa con variado sustrato concentración y saturación de oxígeno. Estos métodos son ejecutados por estudiantes de pregrado e implementados en el laboratorio de docencia e investigación universitario con instrumentación que es accesible y asequible en principalmente instituciones de pregrado.
Introducción
Los primeros informes de la purificación de una proteína con la etiqueta del polyhistidine de extractos de un organismo anfitrión mediante quelación de la etiqueta histidina por un metal inmovilizado entraron en la literatura en 19881,2. Desde entonces, la adición de etiquetas polyhistidine para proteínas recombinantes y su purificación por cromatografía de afinidad metálica inmovilizados (IMAC) se han vuelto prácticamente ubicua en la literatura bioquímica3,4, 5. Métodos de purificación de IMAC pueden ser implementados en el escritorio, usando la cromatografía automatizada y en formatos de spin-columna. Mientras que los métodos de purificación de afinidad, sobre todo IMAC, son ampliamente utilizados en el laboratorio de investigación, son menos comunes en el laboratorio de enseñanza de pregrado. Los libros de texto de laboratorio más utilizado para el laboratorio de bioquímica rutinaria no enseñan estos métodos, en lugar de otro optar por la más tradicional intercambio iónico o cromatografía de unión a la tinte6,7,8 , 9. por ejemplo, la purificación de la lactato deshidrogenasa por Anderson10 utiliza afinidad de unión a la tinte, y la purificación de la leche bovina de7,α-lactoalbúmina11 por Boyer utiliza un níquel-nitriloacetic matriz de ácido, pero ninguna etiqueta de poly-histidina recombinante, confiando en cambio en afinidad intrínseca de la proteína de la resina. Algunos libros de texto modernos laboratorios universitarios y publicaciones aplicar cromatografía de afinidad metálica inmovilizados sobre objetivos de proteína poli-histidina etiquetado como verde o rojo fluorescente proteínas12,13, 14,15,16de anticuerpos y enzimas seleccionadas17,18,19,20, incluso algunos de función desconocida21. Sin duda, la purificación de una enzima es preferible en el laboratorio de enseñanza, porque el blanco puede ensayarse para la actividad en sesiones posteriores, enriqueciendo la experiencia de la "ciencia real" por parte del estudiante; de hecho, estos tipos de experiencias de laboratorio han sido publicados y los resultados beneficiosos en el aprendizaje de los estudiantes reportó17,18,20,21. Y sin embargo, aplicaciones del IMAC a la purificación de la enzima en el laboratorio siguen siendo escasos, y los métodos publicados pueden presumir incluso acceso a instrumentación de cromatografía que no está típicamente disponible para la enseñanza de Bioquímica en el laboratorio del aula 20. también existen limitaciones en la aplicación de IMAC a metaloproteínas, especialmente aquellos que se unen metales divalentes redox-sensibles que son esenciales para la actividad22. Con frecuencia, el ion del metal está perdido u oxidado durante la purificación que rinde una enzima inactiva inadecuados en el laboratorio de pregrado.
Un tercio completo de las enzimas unen un ion de metal23, y a pesar de un requisito casi universal para hierro en todas las formas de vida23, el hierro es sin duda entre los iones metálicos más problemáticos en la enzimología. No-heme Fe2 + atar enzimas son particularmente propensas a la pérdida y oxidación del metal durante el IMAC; probablemente debido a la falta de un ligando orgánico dedicado como heme y la facilidad con que Fe2 + puede disociar del aminoácido ligandos24. Además, la oxidación dependiente de oxígeno de Fe2 + a Fe3 + es espontánea en solución acuosa, debido al cambio de energía libre negativa y la relativa estabilidad de Fe3 +. A menudo, estos retos se superan por medio de anaerobio ambiente o IMAC no métodos cromatográficos22. En este artículo, demostraremos el uso de sobremesa IMAC para purificar la Fe2 + metaloenzima dependiente de l-dopa dioxygenase usando fuentes de cromatografía simple, bajo costo, seguidos por la reconstitución del sitio activo del Fe2 +, y análisis enzimático. Estos métodos son estándar en nuestro propio laboratorio de pregrado bioquímica de los grupos de estudiantes 6-12 y se pueden utilizar para ampliar el repertorio de investigaciones de la enzima en el pregrado.
Protocolo
1. preparación para la purificación
- Preparación del extracto crudo sin células
- Obtener un precipitado de células de g ~ 9-10 de e. coli (BL21) que sobreexpresa la etiqueta del polyhistidine metalloprotein25 en un tubo cónico de 50 mL.
- Añadir 5 mL por gramo de tampón de lisis/bind temperatura habitación (50 mM fosfato, 300 mM de NaCl, imidazol de 10 mM a pH 8) ~ 9-10 g de precipitado de células para un volumen total ~ 45-50 mL. Periódicamente vortex a disolución. Si el pellet se congela, descongela en un baño de agua tibia.
- Usando el baño de agua helada, enfriar la suspensión de células a ~ 3 ° C en la preparación de lisis celular.
Nota: En este punto, es posible lisis celular por sonicación, molienda del grano o cualquier otro método. Molienda de grano se demuestra aquí porque es rápido, relativamente barato y no requiere protección para los oídos. - Montar un cordón de 50 mL fresado según las instrucciones del fabricante.
- Llenar la cámara de molino de grano la mitad llenos de frío 0,1 granos de cristal de mm que se han almacenado a-20 ° C.
- Llene el resto de la cámara con la suspensión de células refrigeradas y buffer de lisis/bind de 4 ° C para llenar completamente la cámara.
- Utilice una pequeña espátula para girar el eje del molino de grano y la suspensión de células se mezclan con los granos.
- Eliminar las posibles burbujas grandes con una pipeta y luego atornille la tapa.
- Seco de la cámara de cualquier fuga.
- Añadir aproximadamente 1 taza de hielo a la chaqueta claro, plástico, incorporar la cámara de llenado de 50 mL a la chaqueta llena de hielo y el tornillo cerrado.
- Sujete la cámara con cubierta de hielo en el motor.
- Apague el motor en el molino de bolas durante 15 segundos a 15.800 rpm, luego dejar para reposar durante 45 segundos. Repetir 8 veces.
- Cuando terminan los 8 ciclos, decantar la suspensión de lisis de la célula entera en un tubo más grande clasificado para la centrifugación de alta velocidad (25.000 x g o superior) o 50 mL. Coloque un par de tubos equilibrados en la centrifugadora y vuelta a 25.000 x g durante 40-45 minutos a 4° C para que sedimenten residuos y cristal cuentas de celular.
Nota: Si no dispone de 50 mL o más grandes tubos de centrifugación de alta velocidad, quitar los granos de cristal por centrifugación a 1000-2000 x g durante 2-3 minutos en un tubo cónico de 50 mL para obtener un menor volumen de suspensión celular (~ 25 mL) que puede decantar en un volumen más pequeño tubo e clasificada para la centrifugación de alta velocidad. - Al terminar la centrifugación, decantar los extractos en un tubo cónico de 50 mL limpio claro, amarillo, sin células, crudos. Tenga cuidado de no para transferir los residuos de la célula.
- Recoger una pequeña muestra de los extractos crudos libres de células para su posterior análisis de la purificación por SDS-PAGE26.
- Preparación de la columna IMAC
- Obtener una columna de 1,5 x 20 cm equipada con un soporte inferior de la cama para retener las partículas de resina, una toma de la cerradura de Luer y una tapa superior que también contiene un tipo Luer lock. Encaja en el tomacorriente de la Luer-cerradura con una llave de paso para controlar el flujo.
- Trabajar en el Banco, Monte firmemente la columna en un soporte de anillo.
- Obtener una mezcla de 50% de níquel-limite nitriloacetic la resina del ácido (Ni-NTA) en etanol al 20% que ha sido almacenada a 4 ° C.
- Agitar suavemente la botella para resuspender uniformemente la resina.
- Trabajando a temperatura ambiente y en el escritorio, uso una pipeta graduada a retirar 2 mL de la mezcla, que producirá 1 mL de colocado resina capaz de atar 50-60 mg de polyhistidine etiquetado proteína y transferir la mezcla a la columna.
- Abra la llave de paso y deje que la solución de almacenamiento de exceso de drenaje por gravedad de la resina.
- Cierre la llave de paso bien
- Con cuidado utilizando una pipeta Pasteur, añadir tampón de lisis frío/bind (50 mM fosfato, 300 mM de NaCl, imidazol de 10 mM a pH 8) y a la columna de resina – por lo menos 30 mL. Tenga cuidado de no para perturbar la superficie de la resina. Ejecutar el buffer por las paredes de la columna para evitar salpicaduras.
- Equilibre la resina al permitir que el tampón de lisis/bind drene lentamente la columna por gravedad en un vaso de colección.
- Cuando el búfer de lisis/bind ha drenado sobre todo, cerrar la llave de paso para detener el flujo de buffer cuando ~ 5 mL de tampón de lisis se mantiene por encima de la resina y dejar la columna, montada verticalmente, hasta que esté listo para continuar, o hasta 1 semana.
2. purificación del Polyhistidine-etiqueta meta por IMAC
- Preparar el tampón de lavado (50 mM fosfato, 300 mM de NaCl, pH de imidazol 20 mM 8) y tampón de elución (50 mM fosfato, 300 mM de NaCl, imidazol de 250 mM, glicerol al 10% pH 8). Enfriar a 4° C.
- Preparar la columna Ni-NTA para la adición de los extractos crudos libres de células abriendo la llave de paso y permitiendo el restante buffer de lisis/obligatorio para drenar por gravedad a través de la resina de Ni-NTA. Cuando se ha vaciado el buffer, y se expone la superficie de la resina, cierre la llave de paso.
- Utilizando una pipeta Pasteur, pipeta extrae el crudo libre de la célula en la resina, teniendo cuidado de no para perturbar la superficie. Ejecutar los extractos crudos abajo las paredes de la columna para evitar salpicaduras. El volumen de extractos crudos aplicado es dependiente en el nivel de expresión de la proteína del polyhistidine-etiqueta; asegurar el volumen total de extractos crudos contiene 50-60 mg o menos de la proteína diana por mL de resina Ni-NTA (ver paso 1.2.4).
- Cuando todos los extractos crudos se han transferido a la columna, abra la llave de paso para que la columna puede drenar por gravedad. Este flujo a través de está compuesto por proteínas que no se unen a la resina – recoger 100 μL para su posterior análisis de la purificación por SDS-PAGE. 26
- La viscosidad de los extractos crudos libres de células puede reducir considerablemente el flujo de la gravedad de la columna. Para aumentar la velocidad de flujo, aplicar un simple "bomba de mano":
- Tome una jeringa de 10 mL Luer-lock y conecte a la tapa de la columna usando un tramo corto de tubería plástica y conexiones Luer-lock entre la tapa de la columna y la jeringa. Extraer el émbolo de la jeringa y luego ajuste bien la tapa de la columna en la parte superior de la columna.
- Comprimir suavemente el émbolo de la jeringa mientras evaluar manualmente el caudal por recoger el eluyente en una probeta graduada; las tasas de 1-2 mL por minuto son compatibles con la resina y esta configuración. Irá aumentando la compresión del émbolo de la jeringa como la tasa de flujo disminuye.
- Para evitar la introducción de aire en la resina, retirar la tapa de la columna une bomba de mano cuando el menisco del líquido aplicado alcanza 5-10 mm por encima de la capa de resina y permite el volumen restante drenar por gravedad.
- Cuando los extractos crudos libres de células han terminado el drenaje y la superficie de la resina se expone otra vez, utilice una pipeta Pasteur cuidadosamente agregar 30 mL de tampón de lavado frío a la columna, teniendo cuidado de no para perturbar la superficie de la resina. Ejecutar el buffer por las paredes de la columna para evitar salpicaduras.
- Abra la llave de paso y permitir que el tampón de lavado al desagüe a través de la columna. Este proceso es quitar las proteínas débilmente consolidadas de la resina. Deseche el eluyente.
- Mientras que el tampón de lavado está drenando, preparar dieciséis, etiquetado, tubos de microcentrífuga para recoger fracciones de 1 mL.
- Cuando se haya drenado todo el tampón de lavado, y la superficie de la resina se expone otra vez, cerrar la llave de paso. Utilice una pipeta Pasteur para añadir cuidadosamente 30 mL de tampón de elución refrigerados a la columna, teniendo cuidado de no para perturbar la superficie de la resina. Ejecutar el buffer por las paredes de la columna para evitar salpicaduras.
- Abrir la llave de paso lentamente y permitir que el tampón de elución eluir la proteína polyhistidine con la etiqueta de la columna. Recoger 1 mL de eluyente en cada uno de los tubos de microcentrífuga marcada, 1 a 16.
- Prueba de las fracciones de proteína mediante un ensayo colorimétrico de proteína como el ensayo de Bradford o espectroscopia UV-Visible de acuerdo con los métodos específicos de reactivo o instrumento fabricantes27,28. Como se muestra aquí, el ensayo colorimétrico con azul de Coomassie es reducido a un volumen μL 100 para sacrificar solamente un pequeño volumen de cada fracción.
- Mezcla 3 μL de cada fracción con 100 μl de una proteína colorimétrica reactivo de ensayo y manualmente, observar la formación de cualquier color para indicar la presencia de proteína en la fracción; no es necesaria la detección con un espectrómetro.
- Si la proteína se encuentra en la fracción 16, continúe liberador de fracciones de 1 mL y análisis para la proteína periódicamente, hasta que las fracciones eluídas ya no contienen una cantidad significativa de proteína.
- Fracciones que contienen proteínas se combinan en un tubo cónico limpia y retirar una muestra de 100 μL para su posterior análisis por SDS-PAGE26.
- Proceder a la reconstitución del cofactor iones metálicos o congelar la proteína en alícuotas de 3 mL a-80 ° C. Asegurar que glicerol al 10% se incluye en la elución buffer es un crioprotector para estabilizar la proteína pura durante la congelación.
- Elución de la columna de Ni-NTA es completa, es decir, la proteína es la columna y en fracciones, pasar otros 25 mL de tampón de elución a la columna y almacenar la columna a 4 ° C en ~ 5 mL de tampón de elución para almacenamiento a corto plazo , o tampón de lisis/bind con 20% de etanol para el almacenamiento a largo plazo.
3. reconstitución de la proteína de la blanco con el Fe2 +
- Adición de Fe2 +
Nota: Un hierro no hemo (II) enlace enzima, como la l-dopa dioxigenasa en este ejemplo, requiere un ión de Fe2 + para la actividad; sin embargo, el hierro (II) se oxida fácilmente al hierro (III), que es inactivo, y una fracción de la proteína se purifica sin cualquier hierro a todos.- Para empezar la reconstitución del metal, obtener 3 mL de la enzima purificada suspendida en tampón de elución. Si se congela, descongelar rápidamente a través de un baño de agua tibia y una vez descongelados, puesto la proteína en el hielo.
- Mediante el volumen de la proteína en el tubo, calcular la cantidad de ascorbato de sodio (198.1 g/mol) necesario para que la concentración final 12.5 mM en la muestra. También, calcular la cantidad de Ditiotreitol (DTT, 154.25 g/mol) necesario para que la concentración final 12.5 mM en la muestra.
- Añadir el ascorbato de sodio sólido y TDT y suavemente pero a fondo, mezclar para disolver totalmente. Tenga cuidado de no para causar precipitación de proteínas con una mezcla demasiado agresiva. Agregue una pequeña cantidad de hierro (II) sulfato heptahidrato (MW 278.01 g/mol) a la muestra de proteína.
- Para obtener una cantidad bastante pequeña del toque de sal, hierro 1 unos mm gránulos de FeSO4•7H2O sólido hacia fuera en un pedazo de pesan papel, doblan el papel sobre el gránulo y aplastar con la parte plana de una espátula de metal.
- Añadir un grano del polvo resultante en el tubo de la proteína.
- Vortex para mezclar y una rosa color rosa aparece en el tubo.
- Incubar la solución rosa de proteína, capsulada, de 10 a 30 minutos en hielo. El color rosa se desvanecerá lentamente con el tiempo.
- Filtración de gel
- Utilice una columna de gel filtración con 10 mL de gel de poliacrilamida al esférico con un límite de exclusión del peso molecular de aproximadamente 6.000 y un rango de tamaño de partícula hidratada de 90 – 180 μm en una columna de 1,5 x 12 cm, que también está equipada con un depósito de 10 mL. Asegúrese de que la columna está equipada con inferior y superior de la cama apoya en forma de 30 discos de Umm poroso de polietileno para retener la resina en la columna y evitar que la capa de resina seco. Monte la columna de gel filtración en un soporte de anillo.
- Si utiliza una columna de filtración de gel envasado, retire la tapa y quite el exceso de tampón sobre el soporte superior de la cama.
- Para equilibrar la columna, comience por llenar el depósito con buffer compatible con posterior análisis y almacenamiento de información, por ejemplo, 50 mM NaH2PO4, 200 mM NaCl, glicerol al 10% a pH 8.0.
- Si utiliza una columna de filtración de gel envasado, quite la punta inferior de la columna de gel filtración para iniciar el flujo de buffer y exponer el luer deslizante. Montar una llave de paso hasta el final de la resbalón de Luer de la columna, pero dejo abierto y permitir que la columna de goteo por gravedad.
- Cuando el buffer se haya drenado de la columna y se expone el apoyo superior de la cama, cerrar la llave de paso y agregar el ~ 3 mL de la metaloenzima de Fe (II) reconstituido a la columna pipetear la solución en el soporte de la cama superior expuesta.
- Abrir la llave de paso y deje que la muestra entera 3,0 mL entrar en la columna por gravedad. Deseche estos primeros 3 mL del eluyente. Cualquier color rosa que se forma durante la manipulación de la solución será atrapado en la parte superior de la columna.
- Cuando la columna ha dejado de gotear y se expone el apoyo superior de la cama, agregar 4 mL de la solución de la filtración de gel (por ejemplo, 50 mM NaH2PO4, 200 mM NaCl, glicerol al 10% a pH 8.0) a la columna. Abra la llave de paso y recoger el eluyente en tubos de microcentrífuga en ocho fracciones de 0,5 mL.
- Prueba de las fracciones de proteína mediante un ensayo colorimétrico de proteína o de27,UV-Vis28 como se describió anteriormente.
- Combinar fracciones de proteína que contienen.
- Retirar una muestra para análisis de SDS-PAGE26.
- Proceder con el ensayo o el almacenamiento de la muestra.
Resultados
Estos resultados representativos fueron recolectados por estudiantes de pregrado como ejecuta este protocolo durante dos períodos de laboratorio curso de BCM 341: Bioquímica Experimental Universidad de Muhlenberg. Figura 1 muestra los resultados de la purificación de un poli-histidina de 20 kDa tagged metaloenzima, l-dopa dioxigenasa, realizado por dos estudiantes durante un período de 4 horas aula laboratorio y analizan por SDS-PAGE por el mismo estudiantes durante un período de laboratorio posterior. La proteína poli-histidina tagged es efectivamente purificada (figura 1, carril 2). Un immunoblot del gel usando anticuerpos contra la etiqueta de poly-histidina indica que se pierde una pequeña cantidad de la proteína diana de poly-histidina etiquetado en el paso (datos no mostrados), probablemente porque la mayor cantidad de 100 mg de proteína diana en la lisado excedió la capacidad de unión de la resina.
Figura 2 muestra los datos de actividad recogidos por el estudiante en la reacción enzimática de la blanco de etiquetado metaloenzima poly-histidina, dioxygenase del l-dopa, después de la reconstitución con hierro (II) y posterior filtración de gel como se describe en el protocolo en este documento. Los cinco segundos comienza el tiempo muerto antes de que los datos recogidos es típica de los estudiantes ejecutando esta técnica por primera vez. La actividad fuerte de la metaloenzima fue detectada usando un análisis publicado y rindió el estado estacionario parámetros cinéticos consistentes con resultados publicados29. Se determinaron parámetros cinéticos estacionaria ajustando las curvas de progreso30 que se muestra en la figura 2; sin embargo, el ajuste de mínimos cuadrados no lineales de tasas iniciales recogidos en una serie de concentraciones de sustrato es igualmente posible31.
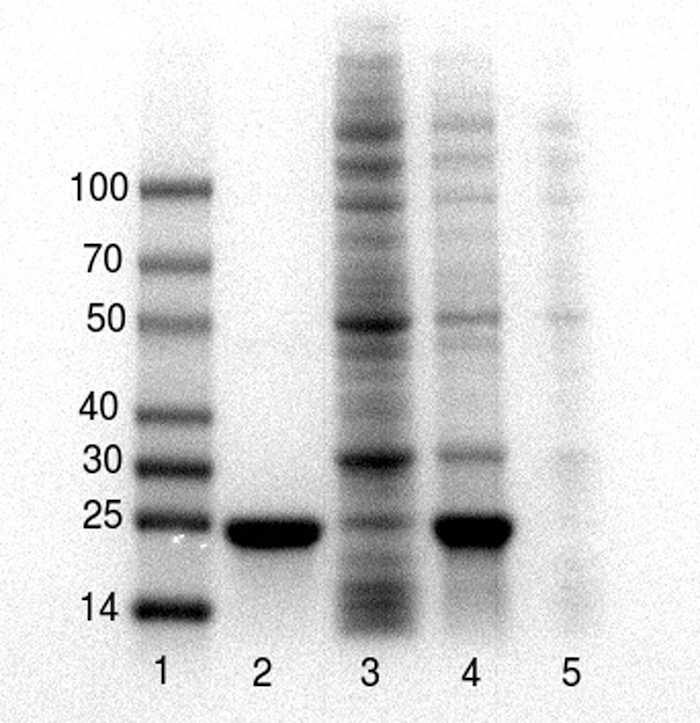
Figura 1. Análisis de SDS-PAGE26 de poly-histidina etiquetan proteína antes, durante y después de la purificación. Carriles 1 - marcadores de peso Molecular, proteína purificada 2 (20 kDa) post Ni-NTA, 3-Ni-NTA atraviesa, 4 lisis pelotilla del post - celular gratis extractos crudos antes de la purificación, 5 - restos celulares. Muestras fueron preparadas con 5 x buffer de carga de muestra y separadas en geles de poliacrilamida de prefabricado 4-20% mediante un sistema de electroforesis de gel. Haga clic aquí para ver una versión más grande de esta figura.
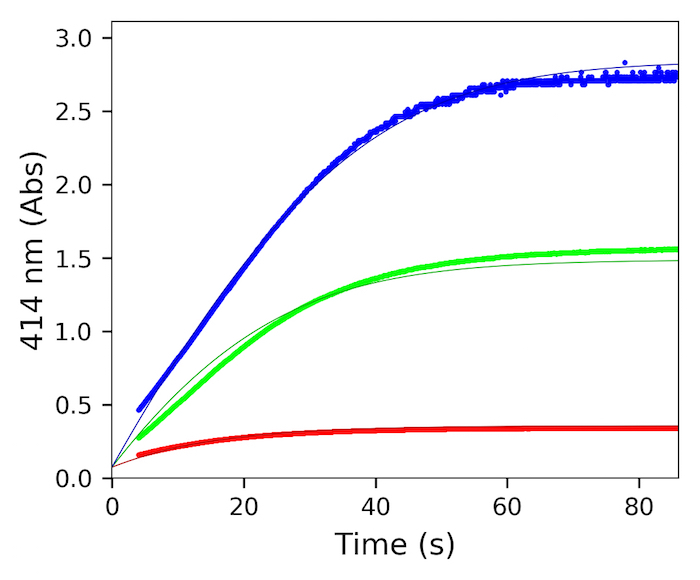
Figura 2. Análisis de estado estacionario de hierro (II) reconstituyen metaloenzima (es decir, l-dopa dioxigenasa, 10) con sustrato (l-dopa-5 μm (rojo), 25 μm (verde), 50 μm (azul)) en tampón (fosfato de 50 mM, 200 mM NaCl, pH 8). Rastros representan la formación de producto a 414nm. Datos de absorbancia fueron adquiridos continuamente utilizando cubetas de metacrilato de 1 mL en un espectrómetro UV-Visible análisis de split-beam29. Datos se adapten a un modelo de Michaelis-Menten de la aproximación de estado estacionario (KM 30.8 μm ± 14,4, kgatoaparente 2.3 s-1 ± 0.05)30. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Mientras que la adición de etiquetas polyhistidine para proteínas recombinantes y su purificación por IMAC se ha convertido en prácticamente ubicua en la literatura bioquímica3,4,5, aplicaciones de IMAC a la purificación de la enzima en la bioquímica laboratorio de enseñanza siguen siendo escasos, y los métodos publicados no siempre consideran las limitaciones de recursos de la enseñanza de laboratorio20. Además, el uso del IMAC en el laboratorio de enseñanza es más eficaz cuando está junto a los experimentos que evalúan la actividad y pureza, haciendo la purificación de una enzima, una actividad educacional ideal del IMAC. Con el fin de ampliar la aplicación de IMAC para la purificación de enzimas, incluyendo metaloenzimas, en el laboratorio de enseñanza, se necesitan métodos confiables y de bajo costo. En este protocolo, demostramos sobremesa IMAC con suministros de laboratorio fácilmente disponibles y baratos, al tiempo que también las limitaciones en la aplicación de IMAC a de metaloproteinas22, reconstituyendo el hierro (II) dependiente metaloenzima, l-dopa dioxigenasa, post purificación. Usando los reactivos y materiales descritos, estimamos que el costo de consumibles para ocho grupos de estudiantes es de entre $500-$ 600 por semestre para ejecutar este protocolo, incluyendo los pasos de análisis descritos en la figura 1 y figura 2.
Debido a la facilidad con que Fe2 + puede disociar de aminoácido ligandos24 y la fácil oxidación del Fe2 + O2 a Fe3 +, reconstitución del no-heme, amino ácido-quelatado (II) en una metaloenzima recombinante es un componente típico de la purificación de la enzima. Cuando se utiliza la cromatografía clásica, es posible evitar la pérdida total de hierro en algunos casos32, pero más a menudo, el hierro (II) se agrega nuevamente en presencia de agentes reductores33,34,35, 36 a menudo bajo un atomosphere anaerobio37,38,39y en algunos casos el exceso de hierro no es quitado33,34,36, que complica la cualquier análisis posterior. Pasos consecutivos de cromatografía clásica y un ambiente anaerobio no son realistas para el laboratorio de pregrado, lo que provocó el desarrollo de este protocolo.
Mientras que la preparación manual de la columna de Ni-NTA y el procesamiento de muestras en gran parte por la gravedad llevará más tiempo y esfuerzo cuando comparado con las columnas y automatizado de instrumentación de la cromatografía, los pasos manual permiten prácticas el estudiante que resultan en mayor comprensión de la ciencia detrás del proceso de aprendizaje. La adición de una sal de hierro (II) bajo las condiciones indicadas aquí es particularmente sensible al exceso Ditiotreitol. Si un estudiante por error añade un exceso de Ditiotreitol, un evento de precipitación es probable. Nos hemos encontrado útiles a los estudiantes realizar cálculos de cantidades de reactivo antes de llegar en el laboratorio, por lo que el tiempo de laboratorio se puede utilizar más eficazmente en el Banco. La purificación de la IMAC de sobremesa todo - de lisis celular para la elución de la proteína - se puede lograr en un período de 4 horas laboratorio, seguida de reconstitución y análisis en un período de laboratorio posterior.
Divulgaciones
Los autores no tienen ninguna revelación.
Agradecimientos
Esta publicación está basada en trabajo apoyado por la National Science Foundation bajo la subvención no. CHE 1708237.
Materiales
| Name | Company | Catalog Number | Comments |
| consumables | |||
| BeadBeater 0.1mm glass beads | BioSpec Products | 11079101 | 1 pound each |
| 50mL Conical Tubes with Screw Caps, sterile | VWR | 21008-178 | |
| Sodium chloride | Fisher Bioreagents | BP358-1 | |
| Potassium phosphate, monobasic | Acros (Fisher) | AC42420-5000 | |
| Sodium Ascorbate | Acros (Fisher) | AC35268-1000 | |
| DTT (Dithiothreitol) | Lab Scientific | D-115 | |
| Iron(II) sulfate heptahydrate | Sigmaaldrich | 310077 | |
| HisPur NiNTA Resin | Fisher (pierce) | PI88221 | |
| Econo-Column Chromatography Columns - 1.5 x 20cm | Bio-Rad | 737-1522 | 1.5 x 20 cm, 35 ml, 2ea, |
| Stopcock Valve, one way, female to male luer | Kimble | 420163-0000 | pack of 50 |
| BD 10mL luer-loc syringe (non-sterile, without needle) | VWR | 301029 | |
| Fitting for tubing: 1.6 mm Barb to Female Luer | Biorad | 7318222 | |
| Fitting for tubing: 1.6 mm Barb to Male Luer | Biorad | 7318225 | |
| Silicon Tubing (1.6 mm ID/0.8 mm wall, for 0.2-5 ml/min on Peristaltic Pump) | Bio-Rad | 7318211 | Pkg of 1, 1.6 mm ID/0.8 mm wall, 10 m, low-pressure tubing for liquid handling |
| Glycerol | Fisher (Pierce) | 17904 | |
| Coomassie Plus (Bradford) Protein Assay | Thermo Scientitic | 23236 | |
| Microcentrifuge Tubes, snap cap, 1.5mL | VWR | 89000-028 | |
| Fisherbrand polystyrene disposable serological pipets | Fisher | 13-676-10F | |
| Fiserbrand universal pipet pump | Fisher | 14-955-110 | |
| Fisherbrand Transfer Pipets | Fisher | 13-711-9AM | |
| Econo-Pac 10DG desalting columns | Bio-Rad | 732-2010 | box of 30 |
| ExpressPlus PAGE 5x sample buffer | Genscript | MB01015 | 5mL (Dilute 1:5 with sample) |
| ExpressPlus PAGE Gel, 4-20%, 12 wells | Genscript | M42012 | 20 gels |
| Fisherbrand Disposable Cuvettes, Methyacrylate | Fisher | 14-955-128 | case of 500 |
| Cuvette Caps Square Disposable | Fisher | 14-385-999 | |
| L-DOPA (3,4-dihydroxyphenylalanine) | Acros | D9628-5G | |
| Permanent Equipment: | |||
| BeadBeater 50mL chamber | BioSpec Products | 110803-50SS | 1 chamber |
| BeadBeater | BioSpec Products | 1107900-101 | 350 ml polycarbonate chamber, rotor assembly, motor base, ice-water cooling jacket and one pound of glass beads. |
| Centrifuge tubes, High-Speed PPCO, 50mL | Fisher | 3119-0050PK | |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels, 4-gel | Bio-Rad | 1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam |
| PowerPac HC Power Supply | Bio-Rad | 1645052 | 100–120/220–240 V, power supply for high-current applications, includes power cord |
| UV-1800 with UV-Probe Software | Shimadzu | UV-1800 | |
| Kintek Global Kinetic Explorer | Kintek Corp | version 6 | https://www.kintekexplorer.com/downloads/ |
Referencias
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nature Biotechnology. 6 (11), 1321 (1988).
- Smith, M. C., Furman, T. C., Ingolia, T. D., Pidgeon, C. Chelating peptide-immobilized metal ion affinity chromatography. A new concept in affinity chromatography for recombinant proteins. Journal of Biological Chemistry. 263 (15), 7211-7215 (1988).
- Block, H., et al. Chapter 27 Immobilized-Metal Affinity Chromatography (IMAC): A Review. Methods in Enzymology. , 439-473 (2009).
- Derewenda, Z. S. The use of recombinant methods and molecular engineering in protein crystallization. Methods. 34 (3), 354-363 (2004).
- Gräslund, S., et al. Protein production and purification. Nature Methods. 5 (2), 135-146 (2008).
- Switzer, R. L., Garrity, L. F. . Experimental Biochemistry. , (1999).
- Boyer, R. . Modern Experimental Biochemistry, 3rd Edition. , (2001).
- le Maire, M., Chabaud, R., Hervé, G. . Laboratory Guide to Biochemistry, Enzymology, and Protein Physical Chemistry: A Study of Aspartate Transcarbamylase. , (2012).
- Bettelheim, F. A., Landesburg, J. M. . Laboratory Experiments for General, Organic, and Biochemistry. , (2013).
- Anderson, A. J. Affinity chromatography of lactate dehydrogenase: An experiment for the undergraduate biochemistry laboratory. Journal of Chemical Education. 65 (10), 901 (1988).
- Boyer, R. F. Purification of milk whey α-lactalbumin by immobilized metal-ion affinity chromatography. Journal of Chemical Education. 68 (5), 430 (1991).
- Moffet, D. A. From gene mutation to protein characterization. Biochemistry and Molecular Biology Education. 37 (2), 110-115 (2009).
- Sommer, C. A., Silva, F. H., Novo, M. T. M. Teaching molecular biology to undergraduate biology students: An illustration of protein expression and purification*. Biochemistry and Molecular Biology Education. 32 (1), 7-10 (2004).
- Wu, Y., Zhou, Y., Song, J., Hu, X., Ding, Y., Zhang, Z. Using green and red fluorescent proteins to teach protein expression, purification, and crystallization. Biochemistry and Molecular Biology Education. 36 (1), 43-54 (2008).
- Ward, W. W., Swiatek, G. C., Gonzalez, D. G. Green fluorescent protein in biotechnology education. Methods in enzymology. 305, 672-680 (2000).
- Kay, B. K., Winter, J., McCafferty, J. . Phage Display of Peptides and Proteins: A Laboratory Manual. , (1996).
- Arkus, K. A. J., Jez, J. M. An integrated protein chemistry laboratory. Biochemistry and Molecular Biology Education. 36 (2), 125-128 (2008).
- Crowley, T. E. Expression, purification, and characterization of a recombinant flavin reductase from the luminescent marine bacterium Photobacterium leiognathi. Biochemistry and Molecular Biology Education. 38 (3), 151-160 (2010).
- Colabroy, K. L. A writing-intensive, methods-based laboratory course for undergraduates. Biochemistry and Molecular Biology Education: A Bimonthly Publication of the International Union of Biochemistry and Molecular Biology. 39 (3), 196-203 (2011).
- Kreiling, J. L., Brader, K., Kolar, C., Borgstahl, G. E. A real-time and hands-on research course in protein purification and characterization: Purification and crystal growth of human inosine triphosphate pyrophosphatase. Biochemistry and Molecular Biology Education. 39 (1), 28-37 (2011).
- Gray, C., et al. Known structure, unknown function: An inquiry-based undergraduate biochemistry laboratory course. Biochemistry and Molecular Biology Education. 43 (4), 245-262 (2015).
- Kocabas, E., Hernick, M. Metalloenzymes: Use of Recombinant Protein Expression and Affinity Tags to Aid Identification of Native Metal Ion Cofactors. Biochemistry & Analytical Biochemistry. 2 (2), 1-3 (2013).
- Ellis, W. R. Metalloenzymes. Reviews in Cell Biology and Molecular Medicine. , (2006).
- Williams, R. J. P., Begley, T. P. Metallo-Enzymes and Metallo-Proteins, Chemistry of. Wiley Encyclopedia of Chemical Biology. , (2007).
- Mierendorf, R. C., Morris, B. B., Hammer, B., Novy, R. E. Expression and Purification of Recombinant Proteins Using the pET System. Molecular Diagnosis of Infectious Diseases. , 257-292 (1998).
- He, F. Laemmli-SDS-PAGE. BIO-PROTOCOL. 1 (11), (2011).
- He, F. Bradford Protein Assay. BIO-PROTOCOL. 1 (6), (2011).
- Johnson, M. Protein Quantitation. Materials and Methods. , (2017).
- Colabroy, K. L., Hackett, W. T., Markham, A. J., Rosenberg, J., Cohen, D. E., Jacobson, A. Biochemical characterization of L-DOPA 2,3-dioxygenase, a single-domain type I extradiol dioxygenase from lincomycin biosynthesis. Arch Biochem Biophys. 479 (2), 131-138 (2008).
- Johnson, K. A. Fitting enzyme kinetic data with KinTek Global Kinetic Explorer. Methods in Enzymology. , 601-626 (2009).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).
- Wang, Y. Z., Lipscomb, J. D. Cloning, overexpression, and mutagenesis of the gene for homoprotocatechuate 2,3-dioxygenase from Brevibacterium fuscum. Protein Expr Purif. 10 (1), 1-9 (1997).
- Amaya, A. A., Brzezinski, K. T., Farrington, N., Moran, G. R. Kinetic analysis of human homogentisate 1,2-dioxygenase. Archives of Biochemistry and Biophysics. 421 (1), 135-142 (2004).
- Johnson-Winters, K., Purpero, V. M., Kavana, M., Nelson, T., Moran, G. R. 4-Hydroxyphenyl)pyruvate Dioxygenase from Streptomyces avermitilis: The Basis for Ordered Substrate Addition. Biochemistry. 42 (7), 2072-2080 (2003).
- Bugg, T. D. H. Overproduction, purification and properties of 2,3-dihydroxyphenylpropionate 1,2-dioxygenase from Escherichiacoli. Biochimica et Biophysica Acta (BBA). Protein Structure and Molecular Enzymology. 1202 (2), 258-264 (1993).
- Mendel, S., Arndt, A., Bugg, T. D. H. Acid-Base Catalysis in the Extradiol Catechol Dioxygenase Reaction Mechanism Site-Directed Mutagenesis of His-115 and His-179 in Escherichia coli 2,3-Dihydroxyphenylpropionate 1,2-Dioxygenase (MhpB). Biochemistry. 43 (42), 13390-13396 (2004).
- Viggiani, A., Siani, L., Notomista, E., Birolo, L., Pucci, P., Di Donato, A. The Role of the Conserved Residues His-246, His-199, and Tyr-255 in the Catalysis of Catechol 2,3-Dioxygenase from Pseudomonas stutzeri OX1. Journal of Biological Chemistry. 279 (47), 48630-48639 (2004).
- Uragami, Y., et al. Crystal structures of substrate free and complex forms of reactivated BphC, an extradiol type ring-cleavage dioxygenase. Journal of Inorganic Biochemistry. 83 (4), 269-279 (2001).
- Veldhuizen, E. J. A., et al. Steady-state kinetics and inhibition of anaerobically purified human homogentisate 1,2-dioxygenase. Biochemical Journal. 386 (Pt 2), 305-314 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados