Method Article
Sinergia antimicrobiana prueba asistida por la impresora de inyección de tinta matriz tablero automatizado y el método Manual de tiempo de matar
En este artículo
Resumen
Prueba de sinergia antimicrobiana se utiliza para evaluar el efecto de dos o más antibióticos se usan en combinación y se realiza generalmente mediante uno de dos métodos: la matriz de tablero de ajedrez o el ensayo de tiempo de matar. Aquí, presentamos un automatizado, de inyección de tinta impresora-asistida tablero matriz sinergia técnica y un estudio clásico matar tiempo de sinergia.
Resumen
Como índices de patógenos multirresistentes de (MDR) continúan aumentando, superando el desarrollo de nuevos antimicrobianos, nuevos enfoques para el tratamiento de bacterias MDR están convirtiendo en una necesidad. Uno de los enfoques es la terapia de combinación, en que dos o más antibióticos se utilizan juntos para tratar una infección contra la cual uno o ambos de los fármacos pueden ser ineficaces solo. Cuando dos fármacos, en combinación, ejercen un mayor que efecto aditivo, se consideran sinérgicos. Investigación in vitro de actividad sinérgica es un primer paso importante en la evaluación de la posible eficacia de combinaciones de fármacos. Se han desarrollado dos métodos de pruebas de sinergia in vitro principal: la matriz de tablero de ajedrez y el estudio de tiempo de matar. En este trabajo presentamos un método de la matriz de tablero automatizado que hace uso de la tecnología de impresión de inyección de tinta para aumentar la eficiencia y la exactitud de esta técnica, así como un método estándar manual sinergia de matar tiempo. La matriz de tablero automatizado puede servir como un ensayo de cribado de alto rendimiento, mientras que el estudio de tiempo-kill manual proporciona datos adicionales y complementarios en matanza y actividad sinérgica.
La matriz de tablero de ajedrez es una modificación del estándar concentración inhibitoria mínima (MIC) de prueba, en el que las bacterias son incubadas con antibióticos en combinaciones de diferente concentración y evaluadas para inhibición del crecimiento después de la incubación durante la noche. Funcionamiento manual de la matriz de tablero de ajedrez requiere una serie de cálculos y diluciones laboriosa y propenso. En el método automatizado presentado aquí, el cálculo y la distribución de la solución madre antibiótico requiere de volúmenes están automatizados mediante el uso de tecnología de impresora chorro de tinta. En el ensayo de sinergia de matar tiempo, bacterias son incubadas con los antibióticos de interés, juntos e individualmente y muestreadas en intervalos a lo largo de 24 h para cultivo cuantitativo. Los resultados pueden determinar si una combinación es sinérgica y si es bactericida y proporcionan datos sobre inhibición y muerte de bacterias con el tiempo.
Introducción
La propagación de patógenos bacterianos de multidrug-resistente (MDR), particularmente MDR las bacterias Gram negativas como enterobacterias resistentes a carbapenem (CRE), ha dejado a los médicos con cada vez más limitadas opciones para la terapia antiinfecciosa exitosa 1, un problema exacerbado por el lento ritmo de descubrimiento de nuevo fármaco antibacteriano2,3. Sinergia antimicrobiana, en el que dos medicamentos en combinación ejercen un efecto mayor que el aditivo, ofrece la posibilidad de recuperación de los antibióticos existentes para el uso en el tratamiento de las bacterias de TB, incluso cuando estas bacterias son resistentes a uno o ambos de los antibióticos individualmente. Las técnicas descritas en este artículo proporcionan dos métodos complementarios de sinergia in vitro pruebas de que, cuando se usan juntos, permiten a los investigadores eficacia antimicrobiana combinaciones de pantalla de interés para la evidencia de actividad sinérgica (automatizado método de matriz de tablero de ajedrez) y luego evaluar la cinética de inhibición y muerte demostrada por combinaciones promisorias identificadas en la etapa de selección (el método manual de tiempo de matar).
Uno de los métodos más utilizados de las pruebas de sinergia in vitro es el análisis de la matriz de tablero de ajedrez, una modificación de las pruebas de concentración mínima inhibitoria (CMI) en el que la actividad inhibitoria de dos antibióticos diferentes contra un bacteriano aislar son probados en un rango de concentración combinaciones4,5. Si los dos fármacos ejercen mayor actividad aditivo cuando se usan juntos, la combinación se considera sinérgico6. Sin embargo, configurar manualmente una matriz de tablero de ajedrez consiste en una serie de cálculos y pasos de dilución y pipetas que son laboriosos y vulnerables al error humano. Estas limitaciones han tenido el efecto de limitar el uso de pruebas principalmente para la evaluación retrospectiva de una pequeña cantidad de combinaciones de antibióticos y aislamientos bacterianos de sinergia y resultados no siempre han sido consistentes entre los estudios7, 8,9,10,11. Además, la complejidad de la prueba de sinergia ha contribuido a su falta de disponibilidad en el laboratorio de microbiología clínica y la ausencia virtual de datos pruebas de sinergia in vitro de los estudios clínicos de terapia de combinación12, 13.
Para aumentar la eficiencia y rendimiento del método de matriz de tablero de ajedrez, hicimos uso de una técnica de prueba automatizada de MIC desarrollada previamente en nuestro laboratorio que utiliza la tecnología de impresión de inyección de tinta para precisamente y consistentemente dispensar volúmenes pequeños de solución madre de antibiótica en los pocillos de una placa de microtitulación14. La plataforma evita la necesidad de cálculos complejos y múltiples pasos de pipeteo. El software asociado calcula y distribuye volúmenes adecuados de antibióticos para crear una matriz de dos dimensiones del tablero de ajedrez si el usuario simplemente entradas de la gama de la concentración deseada y concentración de la solución stock de los antibióticos. Inicialmente probamos este método contra una colección de aislamientos CRE15 y posteriormente se han centrado en pruebas de combinaciones que contienen colistina para actividad contra cepas resistentes a la colistina16. La colistina es un fármaco de último recurso, reservado generalmente para el uso en el tratamiento de la resistencia MDR patógeno gramnegativos17,18y colistina ya hace TB bacterias pan-resistentes casi19, lo que es ideal candidatos para el desarrollo de nuevas estrategias terapéuticas con drogas que son insensibles individualmente. Encontramos que la combinación de colistina y la minociclina antibiótico inhibidor de proteína síntesis tenía un índice muy alto de sinergia, incluso contra cepas que eran resistentes a cada uno de estos fármacos individualmente, probablemente porque la colistina ejerce un subinhibitory efecto permeabilizing de bacterias incluso resistentes a la colistina. Hemos elegido esta combinación para usar como ejemplo en este artículo. De nota, prueba de sinergia puede usarse para evaluar para mejorar eficacia de dos fármacos que son eficaces tanto individualmente.
El método de la matriz de tablero automatizado facilita la prueba de sinergia rápido y alto rendimiento. Sin embargo, el método de la matriz de tablero de ajedrez tiene limitaciones. Como un ensayo MIC modificado, proporciona datos sólo en la inhibición del crecimiento bacteriano y no en la matanza, y no proporciona datos sobre los efectos del antibiótico en el tiempo. Por el contrario, funcionamiento manual de ensayos de matar tiempo sinergia es más laborioso pero proporciona información sobre inhibición y muerte por un tiempo de 24 horas curso20,21. Utilizamos análisis de tiempo de matar en un menor número de aislamientos para confirmar nuestros resultados de la matriz de tablero de ajedrez y para determinar si las combinaciones sinérgicas que se identificaron también son bactericidas.
Ambos métodos de sinergia tablero matriz y matar tiempo proporcionan información valiosa sobre la actividad de combinaciones de fármacos y son especialmente útiles en la evaluación de posibles opciones terapéuticas novela para patógenos bacterianos resistentes. Los métodos también tienen limitaciones inherentes. El método de dilución MIC microbroth estándar tiene un rango de error esperado conocido de 1 doble dilución22, que se incrementa cuando dos fármacos se prueban juntos en una matriz de tablero de ajedrez. Espera de la definición estándar de sinergia, que considera que una combinación sinérgica sólo si los fármacos son activos juntos en un cuarto sus respectivos micrófonos6, tiene en cuenta esta variabilidad, pero dicha variabilidad (que se piensa para resultar de una combinación de fluctuaciones biológicas y técnicas23) inevitablemente genera incierto acerca de la fiabilidad de los resultados de la sinergia. La falta de normas de control de calidad establecidas para la prueba de sinergia es también una limitación actual. Quizás la limitación más importante de los métodos de prueba de sinergia es la falta de correlaciones establecidas entre los resultados in vitro y los resultados clínicos cuando se utilizan combinaciones para tratar pacientes24. Sinergia más rápido y más simple prueba métodos como el método de la matriz de tablero automatizado descrito aquí, puede facilitar la integración de sinergia in vitro dentro de ensayos clínicos o de otras evaluaciones de los resultados del paciente la prueba para mejor caracterizar la relación entre in vitro e in vivo efectos en el futuro.
El método de matriz de tablero automatizado que presentamos ofrece una opción para la detección de alto rendimiento de una variedad de combinaciones y permite la evaluación rápida de combinaciones de "alto riesgo-alta recompensa" inusuales, sin una gran inversión de tiempo y recursos. El método de tiempo de matar, que se demuestra posteriormente, puede proporcionar información de apoyo adicional sobre la actividad sinérgica de la combinación y puede ayudar a caracterizar su actividad bactericida y cinética antibacteriano.
Protocolo
PRECAUCIÓN: Utilizar procedimientos de seguridad apropiados cuando se trabaja con bacterias. Use guantes y una bata de laboratorio en todo momento. Realizar el trabajo en una bioseguridad gabinete si se genera aerosoles o trabajo con agentes patógenos de alto riesgo.
Nota: 20 a 24 h antes de iniciar los experimentos, raya a la isolate(s) bacteriana a probar (a partir de un purificado de Colonia mínimamente los stock congelado a-80 ° C en caldo de soja tríptica con stock de glicerol al 50%) sobre una placa de agar sangre. Incubar la placa a 35 ° C en el aire ambiente.
1. impresora de inyección de tinta-asistencia automatizada tablero matriz sinergia
- Hacer soluciones acción antimicrobianas (colistina y minociclina).
- Determinar las concentraciones de antibiótico solución basan en la solubilidad de los antibióticos y deseado concentraciones finales en la matriz de tablero de ajedrez. Hacer reservas de 10 mg/mL de colistina y minociclina para este ejemplo. Utilice el documento CLSI M100 para determinar disolventes apropiados para cada antibiótico25. Colistina y minociclina son solubles en agua; porque la impresora de chorro de tinta D300 requiere la adición de surfactante para la correcta manipulación de fluidos acuosos, disolver los antibióticos en agua desionizada ultrapura con 0.3% polisorbato 20.
- Antibiótico en polvo utilizando una balanza analítica pesar y calcular el volumen de disolvente necesario para obtener la concentración de población objetivo.
- Si el antibiótico se suministra como una sal (sulfato de colistina, el clorhidrato de minociclina) o en forma hidratada (como meropenem trihidrato), o si es reportado por el fabricante que menos que 100% de pureza, realizar un cálculo de potencia26 a determinar la cantidad de disolvente requerida.
- Siga este ejemplo de clorhidrato de minociclina con una pureza indicada de 900 mg/mg:
Ensayo de pureza: 900 mg/mg
Contenido de agua: ninguno
Fracción activa: 0,926 (obtenido al dividir el peso molecular de la minociclina (457.48 Da) por el peso molecular del clorhidrato de minociclina (493.94 Da)).
Potencia = (pureza de ensayo) * (1 – contenido de agua) * (fracción activa)
= (900 mg/mg) * (1) * (0,926) = 833,4 mg/mg o 83.34%
Luego determinar el volumen de disolvente necesario como sigue:
Volumen (mL) = [peso (mg) * potencia (mg/mg)] ÷ [concentración (mg/mL)]
Por ejemplo, si es pesado 34,7 mg de minociclina clorhidrato polvo, use el siguiente cálculo para determinar el volumen de disolvente necesario para hacer una solución de 10 mg/mL:
Volumen = (34,7 mg) * (833.4 mg/mg) = 2,89 mL
10.000 mg/mL
- Vierta el polvo antibiótico en un tubo cónico de 15 mL y añadir el volumen adecuado de agua y 0,3% polisorbato 20. Vortex hasta que se disuelva.
- Solución stock antibióticos alícuota en tubos de microcentrífuga de 0, 5 mL y conservar a-80 ° C hasta que esté listo para su uso.
- Realizar control de calidad (QC) de las acciones antimicrobianas para uso en experimentos de la matriz de tablero de ajedrez al menos un día antes de la prueba de sinergia para que los resultados del control de calidad pueden evaluarse antes de usar el caldo para la prueba de sinergia.
NOTA:La técnica de control de calidad descrita aquí es idéntica a la técnica que se utilizará para las pruebas de concentración mínima inhibitoria (CMI) de los fármacos individuales y puede ser utilizada como tal con cualquier cepas de interés para el investigador.- Preparar suspensión bacteriana.
- Tomar una alícuota de cada acción antibiótica del congelador de-80 ° C para iniciar la descongelación y preparación de la suspensión bacteriana. Vórtice descongelado para asegurar que el antibiótico en solución.
- Seleccione una cepa control de calidad adecuada y determinar el rango aceptable de MIC para están probando fármacos basándose en la tabla 5A-1 en el CLSI M10025. De los medicamentos aquí, utilizar e. coli ATCC 25922; los rangos de MIC para esta cepa son 0.25-1 mg/mL para minociclina y 0.25-2 mg/mL de colistina.
- Seleccione un rango de concentraciones antibióticas para probar que incluyen toda la gama de control de calidad. Utilizar la gama de 0,0156 mg/mL de 8 mg/mL para minociclina y colistina para ATCC 25922.
- Añadir 1 mL de cloruro de sodio 0,9% a un 12 x 75 mm fondo cristal cultura tubo redondo. Seleccione una o dos colonias en una placa durante la noche de ATCC 25922 y vórtice suavemente para suspender.
- Compruebe la concentración de bacterias utilizando un lector de McFarland. Ajuste según sea necesario mediante la adición de más cloruro de sodio 0,9% o más de las bacterias para lograr una lectura de turbidez 0.5 de McFarland.
- Haga una dilución de 1:300 de la suspensión McFarland 0,5 añadiendo 100 mL de la suspensión a 30 mL de caldo Mueller-Hinton ajustado por catión (CAMHB) en un tubo cónico de 50 mL a una densidad celular final de 5 x 105 UFC/mL, según lo recomendado por el CLSI27.
- Utilizando un asa de inoculación estéril, racha de aislamiento una gota de inóculo inicial en una placa de agar sangre para confirmar la pureza del inóculo e incubar a 35 ° C en el aire ambiente.
- Añadir antimicrobianos a una placa de 384 pocillos fondo plano cuadrado bien, claro, sin tratar con la D300. Realizar este paso inmediatamente después de la preparación de la suspensión bacteriana para que la suspensión se puede Agregar a las placas dentro de 15 minutos de preparación26.
- Encienda la impresora de chorro de tinta de la D300 y el equipo asociado. Abra el programa de software.
- Iniciar un nuevo archivo. Por encima de la imagen de la rejilla de placa, haga clic derecho sobre la placa 1 y elija editar la placa. Seleccione el tipo de placa adecuado (384 bien) y volumen adicional (50 mL).
- Añadir líquidos (es decir, existencias de antibióticos) en el protocolo haciendo clic en el signo más al lado de líquidos en el panel izquierdo. Añadir dos fluidos (colistina y minociclina).
- Pasa el cursor sobre el panel que apareció para líquido 1 y haga clic en el lápiz para editar. Nombre del fluido "Colistin", cambio de clase para "acuoso + Tween 20", cambiar la concentración de a 10.000 y cambiar unidades de concentración mg/ml (concentración stock es 10 mg/mL, es decir, 10.000 mg/mL). Dejar y descarga ben concentración y dejar el resto de los campos a sus valores por defecto. Haga clic en Aceptar.
- Repita el procedimiento arriba para líquido 2 (minociclina).
- Haga clic en la ficha Protocolo actual en la parte superior de la pantalla y cambiar de concentración (masa) a mg/mL para determinar las unidades utilizadas para las concentraciones de antibióticas bien finales.
- 10 pozos en la cuadrícula haciendo clic y arrastrando, seleccione titulación en la parte superior de la pantalla. Para especificar titulación usando select mayor concentración, para fluido elige colistina, para Mayor concentración entre 8 (Asegúrese de que las unidades son mg/mL) y para la distribución Seleccione 1:2 (50%). Deje el valor predeterminado valores de lugar para el resto de la ventana y haga clic en Aceptar.
- Repita el procedimiento anterior para minociclina generar la valoración de la minociclina.
- Guarde el protocolo y haga clic en el botón Ejecutar en la parte superior izquierda.
- Haga clic en el botón Inicio . Una placa de 384 pozos de carga (con la tapa quitada) en el soporte de placa y presione cargado bajo la "carga placa 1 – sinergia" pronto.
Nota: Este es elegido por el software y no indica que se está realizando pruebas de sinergia. Coloque un T8 + casete en la ranura del cassette y presiona cargado bajo carga un T8 + cassette pronto. - Cuando se le solicite, añadir antibiótico solución a los depósitos indicados en el cartucho. Siga las instrucciones en la pantalla de carga adecuada y distribuir cuidadosamente para evitar las burbujas en la solución. Después de agrega cada solución, presione el botón de llenado .
- Una vez que la impresora de inyección de tinta ha añadido acción antibiótica en volúmenes correspondientes a cada bien y el cuadro de Ejecutar completa aparece, haga clic en cerrar, quitar la placa y apague la D300.
- Añadir suspensiones bacterianas a placa de 384 pocillos e incubar la placa.
- Verter la suspensión bacteriana preparada previamente en un depósito de reactivos estériles.
- Utilice una pipeta multicanal para añadir 50 mL de suspensión bacteriana en todos los pocillos que contienen el antibiótico. Añadir 50 mL de CAMHB sin bacterias a un pozo vacío; Este será el control negativo para confirmar la esterilidad de los medios de comunicación.
- Coloque la placa en una incubadora de aire ambiente de 35 ° C e incubar durante 16-20 h26.
Nota: Una diferente duración de incubación puede ser necesaria si se prueban los organismos distintos de Enterobacteriaceae ; consultar CLSI M10025 recomendaciones específicas del organismo.
- Leer la placa en un lector de microplacas a una densidad óptica de 600 (OD600) y analizar resultados.
- Utilizando un programa de hoja de cálculo, sombrear celdas con un valor de600 OD de ≥0.07 verde, lo que indica crecimiento y las células con un valor de < 0.07 rojo, indicando que no hay crecimiento.
Nota: Estos valores se determinaron basados en la inspección visual del crecimiento vs no crecimiento y correlación con las lecturas de OD para estos experimentos; OD600 lecturas de los pozos que contienen los medios de comunicación solo eran consistentemente debajo de 0.07. Cortes apropiados pueden diferir con las bacterias y placa diferentes lectores. - Determinar la CMI por cada medicamento. La CMI es la concentración mínima de droga en el que se inhibe el crecimiento bacteriano. Si el micrófono está dentro del rango del control de calidad según el CLSI M100 documento25, la solución es apropiada para el uso.
- Utilizando un programa de hoja de cálculo, sombrear celdas con un valor de600 OD de ≥0.07 verde, lo que indica crecimiento y las células con un valor de < 0.07 rojo, indicando que no hay crecimiento.
- Preparar suspensión bacteriana.
- Preparar suspensión bacteriana para la matriz de tablero de ajedrez.
- Tomar una alícuota de cada acción antibiótica del congelador de-80 ° C para iniciar la descongelación y preparación de la suspensión bacteriana. Vórtice descongelado para asegurar antibiótico en solución.
- Añadir ~ 1 mL de cloruro de sodio 0,9% a un 12 x 75 mm fondo cristal cultura tubo redondo. Seleccione una o dos colonias en una placa durante la noche de las bacterias (en este caso, e. coli cepa 0494 FDA-CDC) y agitar suavemente para suspender en el cloruro de sodio 0.9%.
- Compruebe la concentración de bacterias utilizando un lector de McFarland. Ajuste según sea necesario mediante la adición de más cloruro de sodio 0,9% o más de las bacterias para lograr una lectura de turbidez 0.5 de McFarland.
- Haga una dilución de 1:300 de la suspensión 0,5 de McFarland mediante la adición de 100 mL de la suspensión a 30 mL de CAMHB en un tubo cónico de 50 mL a una densidad celular final de 5 x 105 UFC/mL27.
- Añadir antimicrobianos a una placa de 384 pocillos fondo plano cuadrado bien, claro, sin tratar con la D300.
Nota: realizar este paso inmediatamente después de la preparación de la suspensión bacteriana para que la suspensión se puede Agregar a las placas dentro de 15 minutos de preparación26.- Encienda la impresora de inyección de tinta, iniciar un nuevo archivo y añadir líquidos en el protocolo como en pasos 1.2.2.1-1.2.2.3.
- Generar la red de sinergia.
- Haga clic en el icono de la sinergia en la parte superior de la pantalla y seguir los pasos. Tipo seleccione dos o más líquidos incluidos juntos. Para la placa, no es necesario excluir cualquier pozos; Haga clic en siguiente en este paso sin hacer cambios.
- En la ficha de valoración , entre las concentraciones de antibióticos y la colocación.
- Para añadir la minociclina disminuir duplicación diluciones de 32 a 0,031 mg/mL, además de un pozo negativo con ningún antibiótico, por el eje y , escriba 12 niveles de titulación en el panel izquierdo. Para especificar titulación utilizando, seleccione mayor concentración; para el fluido, seleccione minociclina; para la concentración más alta, entre 32 (Asegúrese de que la unidad se encuentra en mg/mL; si no, cerrar el cuadro de diálogo de sinergia y cambiar en la ficha Protocolo actual ). Asegúrese de que está marcada la casilla de valor son 0 . Cambiar la distribución a 1:2 (50%).
- Repita estos pasos para colistina en el panel derecho, con 12 niveles de titulación y una concentración más alta de 16. Haga clic en siguiente.
- En la ficha diseño , elegir niveles de titulación de fluidos primero 2 determinan el número de filas y columnas en una cuadrícula de diseño. Haga clic en siguiente. Si la rejilla aparece como se esperaba, haga clic en Finalizar.
- Guardar el protocolo, a continuación haga clic en el botón Ejecutar en la parte superior izquierda.
- Haga clic en el botón Inicio . Carga una placa de 384 pozos (con la tapa quitada) en el soporte de placa y presione cargada debajo de la placa de carga 1 – sinergia pronto. Coloque un T8 + casete en la ranura del cassette y presiona cargado bajo carga un T8 + cassette pronto.
- Cuando se le solicite, añadir antibiótico solución a los depósitos indicados en el cartucho. Siga las instrucciones en la pantalla de carga adecuada y distribuir cuidadosamente para evitar las burbujas en la solución. Después de agrega cada solución, presione el botón de llenado .
- Una vez el dispensador de la D300 ha agregado acción antibiótica en volúmenes correspondientes a cada bien y el cuadro de Ejecutar completa aparece, haga clic en salir, retire la placa y apague la D300.
- Añadir suspensiones bacterianas a placa de 384 pocillos e incubar la placa.
- Verter la suspensión bacteriana preparada previamente en un depósito de reactivos estériles.
- Utilice una pipeta multicanal para agregar 50 mL de la suspensión en todos los pocillos de la matriz de tablero de ajedrez. Añadir 50 mL de CAMHB sin bacterias a un pozo vacío; Este será el control negativo para confirmar la esterilidad de los medios de comunicación. Incubar en una incubadora de aire ambiente de 35 ° C para 16-20 h26.
- Leer la placa en un lector de microplacas en OD600 y analizar resultados de la matriz de tablero de ajedrez.
- En primer lugar, Compruebe la placa de la pureza y asegurar que las colonias aisladas de una morfología única acorde con la morfología esperada del organismo sometido a prueba.
- Utilizando un programa de hoja de cálculo, celdas para no indicar crecimiento y como en el paso 1.2.4.1 la cortina.
- Determinar la CMI por cada medicamento. Para medicamentos que no inhiben el crecimiento bacteriano en la concentración más alta probada, el MIC se considera fuera de escala.
- Para cada pozo en el que se inhibe el crecimiento, determinar la concentración inhibitoria fraccionada (FIC) para cada antibiótico basado en MIC de ese antibiótico (ver figura 1B y figura 2B).
Nota: El CIE es el cociente de la concentración de antibiótico en un pozo en el que crecimiento se inhibe su micrófono; así para un fármaco con un MIC de 8 mg/mL, un bien que contienen 8 mg/mL de esa droga tiene un FIC de 1, mientras que un bien que contienen 4 mg/mL tiene un FIC de 0.5. - Calcular el valor del índice (FIC) concentración inhibitoria fraccional para cada pozo en el que crecimiento es inhibido como la suma de los FICs de cada una de las drogas en ese pozo.
- Determinar el menor FIC en el cual el crecimiento es inhibido (mínimo FIC). Si el mínimo FIC es £0.5, considerar la combinación sinérgica; Si 0.5-4, considerar la combinación indiferente; y si > 4, considerar la combinación de antagonistas. Si la combinación es sinérgica en algunas combinaciones de concentración pero antagónicos a otros, tenga en cuenta este resultado pero consideran la combinación general antagónicas.
2. tiempo de matar sinergia pruebas
- Hacer soluciones antimicrobianas. Si este paso se realiza antes del experimento, congelar existencias a-80 ° C hasta que esté listo para su uso.
- Determinar las concentraciones de antibiótico solución basan en la solubilidad de los antibióticos y deseado concentraciones finales en los estudios de tiempo de matar. En este ejemplo, hacer las acciones de colistina y minociclina en una concentración de 1 mg/mL. Utilice el documento CLSI M100 para determinar disolventes apropiados para cada antibiótico25. Utilice agua, ya recomendado, colistina y minociclina.
- Polvo antibiótico utilizando balanza analítica pesar y calcular el volumen de disolvente necesario para obtener la concentración de población objetivo. Si es necesario, realizar un cálculo de la potencia antes de determinar la cantidad de disolvente requerida, como se describe en el paso anterior 1.1.2.1.
- Vierta polvo antibiótico 15 mL tubos cónicos y añadir el volumen adecuado de agua. Vortex hasta que se disuelva.
- Utilizando el método de microdilución manual caldo descrito en CLSI M0726, realizar control de calidad de antimicrobianos las acciones para el uso en tiempo de matar a experimentos de sinergia. Realizar este paso al menos un día antes de la prueba para que los resultados del control de calidad pueden ser revisados antes de usar la acción de sinergia.
- Seleccione una cepa control de calidad adecuada y determinar el rango aceptable de MIC para están probando fármacos basándose en la tabla 5A-1 en el CLSI M10025. De los medicamentos aquí, utilizar e. coli ATCC 25922; los rangos de MIC para esta cepa son 0.25-1 mg/mL para minociclina y 0.25-2 mg/mL de colistina.
- Preparar caldo que contiene el antibiótico las placas de microdilución.
- Seleccione la mayor concentración de antibiótico a ensayar por lo que se puede incluir toda la gama de control de calidad. Utilizar un rango de 0.016 a 8 mg/mL para minociclina y colistina para ATCC 25922.
- Diluir el antibióticas acciones para una solución de trabajo en CAMHB en dos veces la concentración más alta (porque será diluido 1:1 con la suspensión de las bacterias). En este ejemplo, diluir ambos stocks de 10 mg/mL a 16 mg/mL.
- Usando una pipeta multicanal, añadir 100 mL de cada uno de los 2 x suspensiones de antibióticos a un pozo en la primera columna de una placa de 96 pocillos clara, fondo redondo, sin tratamiento y añadir 50 mL de caldo llano (sin antibiótico) en cada pocillo de las columnas posteriores.
- Quitar 50 mL de antibiótico que contiene caldo de cada bien en la primera columna y añadir a los pozos de la segunda columna. Pipeta de arriba y abajo varias veces para mezclar el contenido, generando una concentración de antibiótica la mitad de la concentración en la primera columna.
- Repita el paso 2.2.2.4 con cada columna, para que una serie de dos diluciones en serie, cada uno con un volumen de 50 mL, se prepara. Puntas de pipeta de cambio entre cada paso de dilución si desea eliminar la posibilidad de arrastre de antibiótico. Tenga en cuenta que las concentraciones resultantes están todas todavía 2 x las concentraciones finales, como que será posteriormente diluido 1:1 con la suspensión bacteriana.
- No agregue ningún antibiótico a las dos columnas finales, ya que serán las columnas de control negativo y el crecimiento.
- Preparar suspensión bacteriana.
- Prepare una suspensión 0.5 de McFarland de una placa durante la noche de e. coli ATCC 25922 en 0.9% de cloruro de sodio como se describe en pasos 1.2.1.5-1.2.1.6.
- Haga una dilución de 1: 150 de la suspensión 0,5 de McFarland mediante la adición de 50 mL de la suspensión a 7,5 mL de CAMHB.
Nota: La suspensión bacteriana final será 1:300 diluido una vez que se mezcla 1:1 con la solución antibiótica, llegar a la densidad recomendada por CLSI celular de 5 x 105 UFC/mL27).
- Añadir bacterias a la microplaca e incubar.
- Añadir 50 mL de la suspensión bacteriana a cada pocillo, excepto en la columna 11 demayo . Añadir 50 mL de CAMHB a la 11th columna (columna de control negativo).
- Incubar la placa a 35 ° C durante 16-20 h.
Nota: Una diferente duración de incubación puede ser necesaria si se prueban los organismos distintos de Enterobacteriaceae ; consultar CLSI M10025 recomendaciones específicas del organismo. - Lea la placa de crecimiento visualmente utilizando luz transmitida y, para cada antibiótico, determinar la concentración mínima en la cual no hay crecimiento; Este es el micrófono. Consultar el documento CLSI M07 para más detalles sobre la interpretación visual de MIC26. Si el micrófono está dentro del rango del control de calidad, la solución es apropiada para su uso.
- Inicio Cultura inicial.
- Hacer un 0,5 McFarland suspensión del microorganismo de prueba en estéril 0,9% NaCl como se describe anteriormente.
- Añadir 100 mL de 0.5 McFarland suspensión en 5 mL de CAMHB en un vaso de 25 x 150 mm redondo tubo de cultura inferior con cierre de acero inoxidable y agitar suavemente para mezclar.
- Utilizando un asa de inoculación estéril, racha de aislamiento una gota de la suspensión diluida sobre una placa de agar sangre para confirmar la pureza del inóculo e incubar a 35 ° C en el aire ambiente.
- Reemplazar el cierre en el tubo e incubar en un bastidor de tubo de ensayo en un agitador a 35 ° C en el aire ambiente durante al menos 3 h, hasta que fase logarítmica de crecimiento (ver paso 2.6.1). Continúe con el paso 2.4 mientras que la cultura está en la incubadora.
- Preparar soluciones antimicrobianas en 25 x 150 mm tubos de cultivo de cristal.
- Sacar alícuotas acción antimicrobianas del congelador de-80 ° C para descongelar. Vórtice descongelado para asegurar antibiótico en solución.
- Mientras está incubando cultura inicial, agregar 10 mL de CAMHB a cinco tubos de cultivo de vidrio esterilizado de 25 x 150 mm y añadir soluciones antimicrobianas como sigue.
Nota: Para un estudio de sinergia, debe ser por lo menos una droga en una concentración que no afecta el crecimiento de la curva individual28; se puede determinar mediante la evaluación de los efectos de concentraciones de la droga individual antes del estudio de la sinergia.- Tubo 1: Añadir la cantidad apropiada de antibiótico #1 para obtener la concentración de antibiótico final destino. En este caso, añadir 10 mL de caldo de colistina 1 mg/mL para obtener una concentración final de colistina de 1 mg/mL, ya que es una concentración que es ineficaz contra la cepa utilizada en este ejemplo.
- Tubo 2: Añadir la cantidad apropiada de antibiótico #2 para obtener la concentración final de antibiótica a ensayar. En este caso, añadir 10 mL de caldo de minociclina de 1 mg/mL para obtener una concentración final de 1 mg/mL, una concentración que es ineficaz contra la cepa que se utiliza en este ejemplo.
- Tubo 3: Agregar la misma cantidad de #1 antibiótico y antibiótico #2 como se usa en los tubos 1 y 2. En este caso, agregar 10 mL de caldo de minociclina 1 mg/mL y 10 mL de caldo de colistina 1 mg/mL.
- Tubo 4: no agregar antibióticos; Este será el tubo de control de crecimiento.
- Tubo 5: no añadir antibióticos; Este será el tubo de control negativo.
- Preparar 96 placas polipropileno pozo profundo pozos de 2 mL de diluciones seriadas al agregar 900 μl de cloruro de sodio 0,9% estéril a H B hileras de columnas 1-5 con una pipeta multicanal.
- Preparar el inóculo inicial y añadir a los tubos.
- Una vez que la cultura inicial ha llegado a fase de crecimiento logarítmico (~ 3 h para Klebsiella pneumoniae, el organismo utilizado en este ejemplo), retire el tubo de la cultura de la coctelera, vortex, transferencia ~ 1 mL de la suspensión a un tubo de cultivo de vidrio 12 x 75 mm, y Compruebe la densidad con un lector de McFarland.
- Si es inferior a 1,0 McFarland, regresar el tubo a la coctelera e incubar ya. Si es mayor que 1,0 McFarland, añadir CAMHB al tubo vortex suavemente y vuelve a probar, repitiendo el proceso hasta que la suspensión sea 1,0 McFarland.
- Añadir 100 mL de la suspensión McFarland 1,0 1-4 los tubos y agitar suavemente.
- Una vez que la cultura inicial ha llegado a fase de crecimiento logarítmico (~ 3 h para Klebsiella pneumoniae, el organismo utilizado en este ejemplo), retire el tubo de la cultura de la coctelera, vortex, transferencia ~ 1 mL de la suspensión a un tubo de cultivo de vidrio 12 x 75 mm, y Compruebe la densidad con un lector de McFarland.
- Alícuotas de la muestra de cada cultura y realizan serie diluciones diez veces.
- A tiempo 0 (inmediatamente después de la adición de bacterias en los tubos) y en 1, 2, 4, 6 y 24 h, retire una alícuota de 150 mL de cada tubo de cultivo inclinando el tubo para que solo la punta de la pipeta estéril entra en el tubo y no el eje sin esterilizar pipeta retirar alícuotas. Añadir alícuotas, respectivamente, a pozos consecutivos en la primera fila de la placa del pozo profundo 96 previamente preparado. Volver tubos a un bastidor de tubo de ensayo en una shaker en una incubadora de aire ambiente de 35 ° C inmediatamente después de retirar alícuotas en cada momento.
- Usando una pipeta multicanal, saque 100 mL de columna A, agregar a fila B (que contiene 900 mL de cloruro de sodio 0,9%) y pipetear arriba y abajo 4 - 5 veces a la mezcla, creando un 1:10 dilución. Desechar las puntas después de cada paso de dilución para evitar contaminación de bacterias, que pueden conducir a recuentos de colonias falsamente elevados.
- Repita el paso 2.7.2 para filas B-H con puntas de pipeta nueva para cada fila.
- Placa de diluir las muestras para recuentos de colonias utilizando la gota placa método29,30.
- Etiqueta de las placas de agar Mueller-Hinton con las condiciones de antibióticas y dilución a platear.
- Usando una pipeta multicanal y consejos extra largos (para asegurar que alcanzan de consejos en suspensión), quitar 10 mL de cada pozo en columna uno y distribuir cuidadosamente en una fila sobre la placa debidamente etiquetada. Si se utilizan placas pequeñas (100 mm de diámetro), dispensar 3 filas (cada uno compuesto por gotas de filas A-H de una sola columna) por placa; en grandes placas (150 mm de diámetro), dispensar 8 filas por placa.
- Permitir que las gotas se sequen completamente (~ 15 min).
- A las 24 h, coloque una gota de 10 mL tomada directamente desde el tubo de control negativo en una zona indicada de uno de los platos para probar esterilidad. Invertir las placas e incubar durante una noche a 35 ° C en el aire ambiente.
- Contar las colonias y calcular la densidad celular. Marque las colonias con un marcador permanente de punta fina en el reverso de la placa para evitar la doble contabilización o no de colonias.
- En primer lugar, Compruebe la placa de la pureza y asegurar que las colonias aisladas de una morfología única acorde con la morfología esperada del organismo sometido a prueba.
- Para cada serie de dilución, identificar gotas con colonias de 3-30 (típicamente una gota por la serie de diluciones). Contar las colonias en estas gotas y registrar la cuenta junto con el factor de dilución.
- Si no hay cae en una serie de diluciones con 3-30 colonias, contar las colonias en la última gota con > 30 colonias y la primera gota con < 3 colonias (estos deben ser gotas adyacentes).
- Para cada serie de dilución, calcular el número de colonias formando unidades por mililitro (UFC/mL) en la muestra basada en el número de colonias en la gota usando la siguiente fórmula: UFC/mL = n(1 /d) (100) donde n es el número de colonias, d es el factor de dilución (1 para la muestra sin diluir (columna A), 0,1 o 10-1 para el primer 1:10 dilución (fila B), 0.01 o 10-2 para el segundo 1:10 dilución (fila C) y así sucesivamente y las constante 100 cuentas para el hecho de que el volumen total de la gota s 10 mL, mientras que el valor final se expresa en UFC/mL, es decir, CFU/1.000 mL. Utilice una hoja de cálculo que contiene fórmulas que calculan UFC/mL de recuento de colonias a simplificar este proceso.
- Para la serie de diluciones donde más de una gota fue contable (o donde dos gotas debían contarse porque ninguna gota cayó en gama), promedio de la cantidad de UFC/mL final todos gotas contadas.
- Porque el límite inferior de detección es 300 UFC/mL (3 colonias en la gota de aceite puro), registro y parcela Colonia cuenta como £300 UFC/mL para la serie de la dilución en la que hay < 3 colonias en la gota de aceite puro.
- Inspeccione la gota de control de esterilidad del tiempo 24; Si se observa cualquier crecimiento en esta caída, los resultados del experimento no puede usarse.
- Ver y analizar los resultados.
- Trazar las curvas de crecimiento de las tres culturas que contiene el antibiótico y el control de crecimiento en el mismo gráfico. Trama de vez el UFC/mL, utilizando una escala logarítmica en el eje y y el eje x .
- Calcular la diferencia de UFC/mL entre el tubo de la combinación en tiempo 24 y el más activo agente único en el tiempo 24. Si la diferencia es ≥ 2 log10, considerar la combinación sinérgica. Luego calcular la diferencia de UFC/mL entre el tubo de la combinación en tiempo 24 y al tiempo 0. Si la diferencia es ≥ 3 log10, considerar la combinación bactericida.
Resultados
Figura 1A presenta una cuadrícula de un experimento de sinergia de matriz de tablero de ajedrez que minociclina en concentraciones de 0-32 μg/mL fue combinado con colistina en concentraciones de 0-16 μg/mL y probado contra la cepa de e. coli FDA-CDC 0494. Los valores representan las lecturas espectrofotométricas en densidad óptica 600 nm (OD600). Pozos con valores de OD600 debajo de 0.07 (que corresponde al no crecimiento por inspección visual) son sombreada rojo, mientras que wells con valores de OD600 0.07 (que corresponde al crecimiento por inspección visual) son sombra verde. Para cada medicamento, la concentración mínima inhibitoria (MIC, en negrita) es la menor concentración de droga que inhibe el crecimiento bacteriano. De minociclina, se trata de 32 μg/mL, y para la colistina, es 8 μg/mL. La sombra se mantiene en la figura 1B, pero valores dentro de los pozos en los que se inhibe el crecimiento se sustituyen por valores de índice (FIC) concentración inhibitoria fraccional. Estos se determinan como sigue: en cada pozo, el índice de concentración inhibitoria fraccionada (FIC) de cada medicamento se calcula dividiendo la concentración de antibiótico que bien por el MIC de la droga, y el FIC se calcula mediante la suma de las dos FICs. Pozos con un FIC valor de 0.5, que se considera el límite para sinergia, se indicaron con un borde de línea quebrada, y el pozo con el valor más bajo FIC (0,094) está en negrita. Porque el valor mínimo de FIC está en la gama sinérgica, la combinación se considera sinérgica.
Figura 2A y figura 2B muestran redes análogas a las de la figura 1A y figura 1B, pero en este caso la combinación no demostrar sinergia contra el aislante probado (K. pneumoniae aislado 4 BIDMC), porque la mínimo FIC en la cual se inhibe el crecimiento es 1, que es > 0.5.
La figura 3 ilustra las lecturas de densidad óptica de una red de sinergia de tablero de ajedrez en la que varios pozos se saltan ocurrieron (Enterobacter cloacae complejo aislante BIDMC 27). Se saltan los pozos son pozos en que crecimiento bacteriano es inhibido a pesar de la presencia de crecimiento bacteriano en los pozos juntos con altas concentraciones de antibiótico. Este fenómeno, que se sabe para ocurrir en la prueba estándar del MIC así, es probablemente debido a la variabilidad biológica en las características del crecimiento bacteriano de bien a bien y a la sensibilidad de algunos antibióticos a pequeñas diferencias en el inóculo bacteriano23 , 31 , 32. Si más de uno saltó bien ocurrió en una matriz de tablero de ajedrez, descartan los resultados y repetir el ensayo.
Figura 4 presenta ejemplos de resultados de matar tiempo sinergia de tres combinaciones con K. pneumoniae aislamiento BIDMC 32. Recuentos de colonias que se indican en una escala logarítmica en y-eje y el tiempo, en horas, en el x-eje. La diferencia entre el inóculo inicial en el tubo que contiene la combinación de drogas y la concentración de bacterias en ese tubo a las 24 h es ilustrada por la barra roja y el número, mientras que la diferencia entre la concentración de bacterias en 24 horas entre el tubo que contiene la combinación y el tubo que contiene al agente único más activo solo es ilustrado por la barra azul y el número. Figura 4A muestra el resultado de la combinación de colistina y minociclina; Esta combinación es sinérgica (diferencia entre las concentraciones de bacterias expuestas a combinación y más activo agente solo ≥ 2 log10 UFC/mL a las 24 h) y bactericida (disminución partir de inóculo a concentración a las 24 h ≥ 3 log10 CFU/mL). Figura 4B muestra el resultado de la combinación de colistina y clindamicina, una combinación que era sinérgica pero no bactericida. Esta combinación inhibe el crecimiento de las bacterias, que ni droga lo hizo solo, pero no les mataron. Figura 4 muestra los resultados de la combinación de colistina y la eritromicina, que es bactericida ni sinérgica.
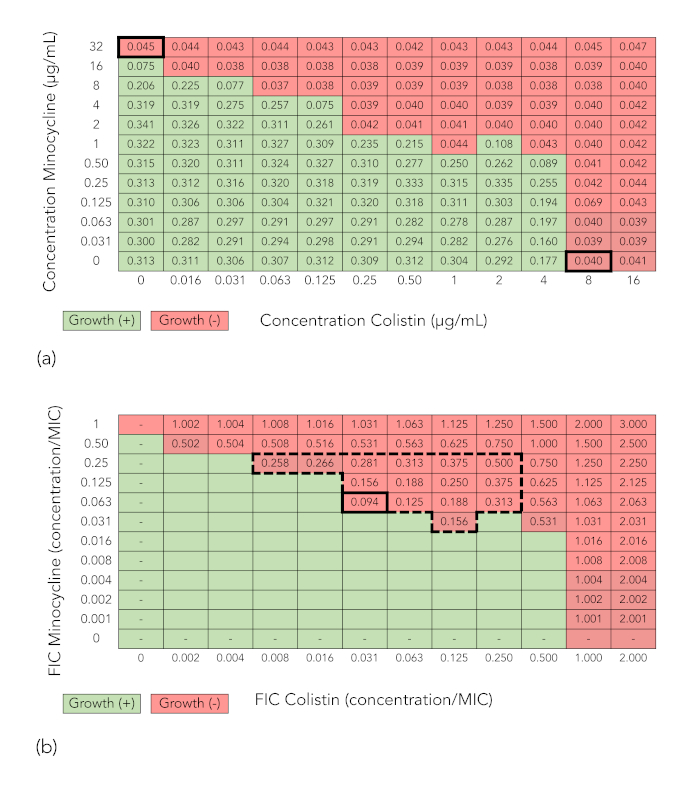
Figura 1: Matriz de tablero de ajedrez resultados que demuestran sinergia (minociclina + colistina probado contra e. coli cepa 0494 FDA-CDC). (A) interpretación espectrofotométrica de lectura y crecimiento de una matriz de tablero de ajedrez. Valores de las celdas son lecturas de densidad óptica a 600 nm (OD600). Las células con valores de OD600 debajo de 0.07 (correspondiente al no crecimiento por inspección visual) son de color rojo sombra, mientras que las células con valores de OD600 0.07 (correspondiente al crecimiento por inspección visual) son sombra verde. (B) cálculo de índice (FIC) concentración inhibitoria fraccional. Sombreado que indica crecimiento o no crecimiento se ha mantenido. Valores de colistina y minociclina a lo largo de xe y-ejes, respectivamente, representan ahora la concentración inhibitoria fraccionada (FIC), o el cociente de la concentración de la droga en esa columna o fila a la concentración mínima inhibitoria ( MIC) de ese fármaco solo. El valor de cada celda es el FIC, o la suma de los FICs de los dos fármacos en ese pozo. La caja de línea de borde rota grande incluye pozos con un FIC de 0.5. La célula gruesa bordeada indica el pozo con la menor FIC en el que se inhibe el crecimiento o la mínima FICyo. Porque el mínimo FIC es de 0,5, la combinación se considera sinérgica. Haga clic aquí para ver una versión más grande de esta figura.
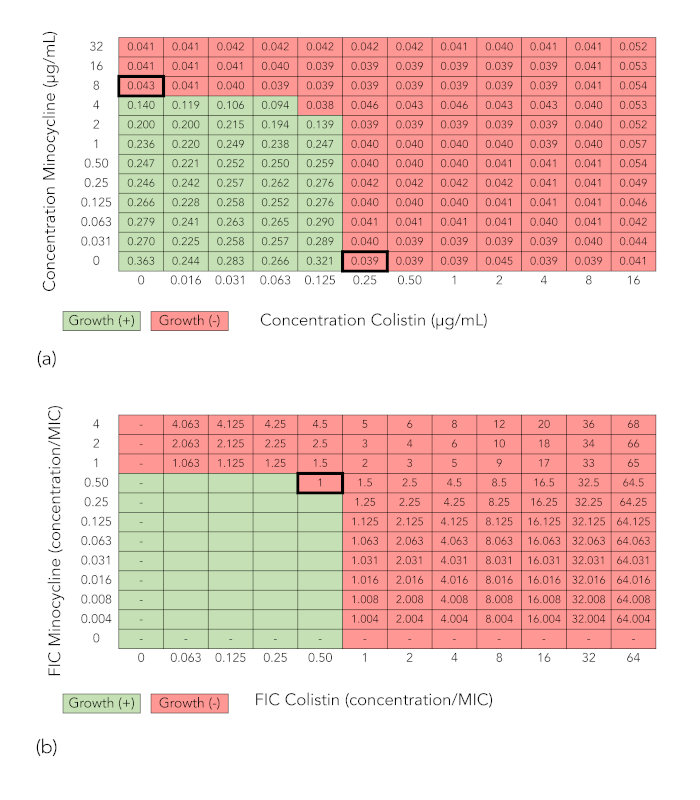
Figura 2: Tablero matriz los resultados de una combinación que no demuestran sinergia (minociclina + colistina con K. pneumoniae aislar BIDMC 4). Valores de densidad óptica (A) a 600 nm y crecimiento la interpretación de los resultados de la matriz de tablero de ajedrez como descrito en la figura 1A. (B) concentración inhibitoria fraccional índice (FIC) el cálculo como se describe para la figura 1A. Porque el mínimo FIC es > 0.5, la combinación no se considera sinérgica. Haga clic aquí para ver una versión más grande de esta figura.
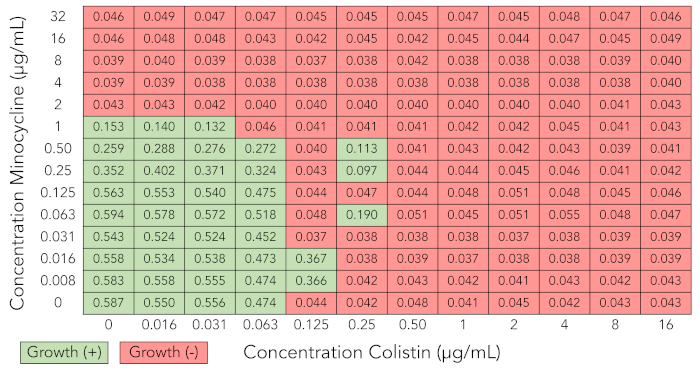
Figura 3: Resultados de matriz de tablero de ajedrez que son interpretables debido a saltan pozos (minociclina + colistina probado contra Enterobacter cloacae complejo aislar BIDMC 27). Valores de densidad óptica a 600 nm y crecimiento la interpretación de los resultados de la matriz de tablero de ajedrez como descrito en la figura 1A. Varios pozos se omitió, en el que crecimiento bacteriano es inhibido a pesar de la presencia de crecimiento en los pozos juntos con altas concentraciones de antibióticos, se han demostrado. Resultados no son interpretables y el experimentan debe ser repetido. Haga clic aquí para ver una versión más grande de esta figura.
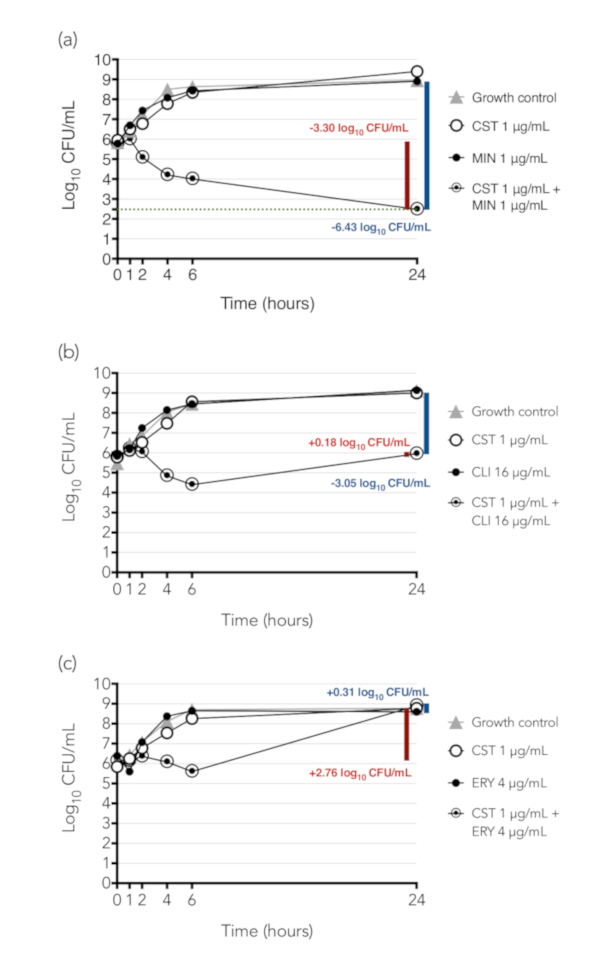
Figura 4: Muerte de tiempo resultados de sinergia de tres combinaciones con K. pneumoniae aislamiento BIDMC 32. Recuentos de colonias que se indican en una escala logarítmica en y-eje y el tiempo, en horas, en el x-eje. La diferencia entre la concentración de bacterias en la combinación a las 24 h y el inóculo inicial en el tubo es ilustrada por la barra roja y el número. Si la caída de a partir de inóculo a concentración a las 24 h es ≥ 3 log10 UFC/mL, la combinación se considera bactericida. Se ilustra la diferencia entre la concentración de bacterias en 24 horas entre el tubo que contiene la combinación y el tubo que contiene al agente único más activo solo por la barra azul y número; Si hay ≥ 2 log10 reducción de UFC/mL, la combinación se considera sinérgica. (A) Colistin (CST) + minociclina (MIN), una combinación que es sinérgica y bactericida. Colistina (B) + clindamicina (CLI), una combinación sinérgica, pero no bactericida. Colistina (C) + eritromicina (ERY), una combinación que es bactericida ni sinérgica. Estos resultados fueron publicados inicialmente como parte de un estudio de la actividad sinérgica de colistina-contener combinaciones contra colistin-resistentes Enterobacteriaceae, en el que demostramos que la colistina fue sinérgica con un número de antibióticos que son activos individualmente sólo (p. ej., clindamicina) o sobre todo (p. ej. eritromicina) contra bacterias Gram-positivas16. (Nota que eritromicina era sinérgica por matriz de tablero de ajedrez contra la cepa que se muestra, pero no por matar tiempo, así que ha sido seleccionada como un ejemplo de una combinación no sinérgica.) Presumimos que la colistina, que es conocida por actuar por permeabilización de la membrana externa de bacterias gram negativa, ejerce un efecto permeabilizing subinhibitorias sobre bacterias Gram-negativas resistentes a la colistina, permitiendo el ingreso de drogas como la clindamicina que normalmente no puede entrar en la célula gram-negativa. Panel (A) de esta figura se ha modificado de Brennan-Krohn, Pironti y Kirby 201816, derechos de autor © American sociedad para la microbiología, antimicrobianos y quimioterapia, 62(10), 2018, pii: e00873-18, doi: 10.1128/AAC.00873-18. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los dos métodos descritos aquí ambos proporcionan información sobre la actividad de los antimicrobianos utilizados en combinación, en comparación con su actividad individual. Automatizado, digital asistida por la impresora de inyección de tinta método es una adaptación del método descrito en el manual de procedimientos de microbiología clínica33, mientras que el método de matar tiempo sigue más de cerca el protocolo correspondiente de la misma referencia34.
En el método de la matriz de tablero de ajedrez, cálculos para determinar el volumen necesario de acción antimicrobiana para agregar a cada pozo, así como la distribución de estos volúmenes está automatizado, eliminando algunas de las principales fuentes potenciales de error encontrado en un manual matriz de tablero de ajedrez. Sin embargo, es todavía esencial que el investigador determina que las poblaciones originales se hacen en la concentración prevista y que concentraciones finales objetivo se introducen en el software de la D300 correctamente. Agregar la suspensión antimicrobiana en los pocillos de una placa de 384 pozos puede ser difícil al principio y requiere cuidado para asegurar pipeta consejos entrar en los pocillos adecuados y ese líquido no salpique hasta los bordes de los pozos. Un controlador automático de líquido puede usarse en lugar de una pipeta multicanal portátil para aumentar la velocidad y la precisión con que la suspensión bacteriana se agrega a los pozos. Como se describe en el protocolo, la D300 requiere el agregado de surfactante, polisorbato 20 (P-20), para el adecuado manejo de líquidos. Un surfactante diferentes, polisorbato 80, en una concentración de 0.002%, se ha observado para bajar micrófonos de colistina para organismos con colistina MICs de < 2 μg/mL en caldo estándar microdilución ensayos. 35 , 36 nuestro laboratorio demostrado previamente que P-20 en concentraciones hasta 0.0015% no tuvo ningún efecto en los resultados MIC D300-asistida en comparación con DMO14de referencia. En el ejemplo de análisis presentado aquí, P-20 máxima es concentración es 0,0014%.
Un problema que nos encontramos con algunos ensayos de la matriz de tablero de ajedrez fue un gran número de pozos se saltan. Esto se debía a una tasa desproporcionada con ciertos antibióticos. En concreto, en una pantalla de combinaciones contra una colección de carbapenem-resistentes Enterobacteriaceae, encontramos que mientras 49 de 521 ensayos (9,4%) eran inutilizables debido a los múltiples pozos saltadas, 2 de los 12 antibióticos probados (fosfomicina y cefepime) representaron 46 de estos ensayos (94%). Tal aumento de las tasas puede ser más probable en los medicamentos que son particularmente susceptibles a los efectos de inóculo31,32,37. De nota, CLSI no recomienda pruebas de fosfomicina en caldo dilución25 debido a las preocupaciones sobre la confiabilidad de los resultados con este método, que puede explicar los resultados poco fiables considerados esta droga. Pueden hacerse algunas modificaciones al método de tablero automatizado según las preferencias del investigador. Antimicrobianos pueden dispensar en placas ya que contiene la suspensión bacteriana, más que en los pocillos vacíos, si es preferible por razones de flujo de trabajo dentro del laboratorio. Mientras que aquí se utilizaron placas de 384 pocillos, el método puede también llevarse a cabo en los ensayos de placa de 96 pocillos con modificación apropiada del volumen bien. El uso de un formato de placa de 96 pocillos puede ayudar a reducir pozos omitidas para los antibióticos que son particularmente sensibles a pequeños cambios en el inóculo. Cálculo de FIC, puede haber situaciones donde el micrófono está fuera de escala (es decir, más que probado), incluyendo situaciones donde la droga ensayada no tiene actividad individualmente contra el tipo de organismo sometido a prueba. En estos casos, el FIC puede ser calculado en suponiendo que el MIC es una dilución más alta que la concentración más alta probada. Esta es la estrategia más conservadora, como asume el máximo valor posible de la FIC para cualquier dilución donde se observa inhibición durante la prueba de sinergia. Por ejemplo, si el micrófono real en lugar de otro fueron dos diluciones de doblaje anteriores la concentración más alta prueba, entonces el FICs correspondientes dos veces inferior a las asignaciones de conservadoras y así sucesivamente.
Para evaluar con precisión la actividad bactericida de las drogas en un análisis de tiempo de matar, es fundamental que las culturas en fase logarítmica de crecimiento, particularmente cuando antibióticos activos de la pared celular están siendo probados28. Para las bacterias de rápido crecimiento utilizadas en este ejemplo (K. pneumoniae), 3 horas de incubación con agitación era apropiado para llegar a esta fase de crecimiento, pero diferentes cantidades de tiempo pueden ser necesarios para diversos organismos. En general, la cultura debe aparecer visiblemente pero no muy turbia. La cantidad de tiempo apropiada se puede determinar mediante la construcción de una curva de crecimiento con recuentos de colonias en tiempo serial puntos (por ejemplo, cada 30 minutos durante 4-6 h)38. El inóculo inicial previsto en el estudio de la muerte de tiempo también es importante. La concentración objetivo del inóculo inicial es aproximadamente de 5 x 105 a 1 x 106 UFC/mL. La dilución que se describe aquí (100 μL de una suspensión de McFarland 1,0 en 10 mL de medio) genera este inóculo para Klebsiella pneumoniae y otras especies de Enterobacteriaceae en que nosotros lo hemos probado. Si la densidad del inóculo inicial en un experimento utilizando diferentes organismos es significativamente mayor o menor que esto, puede necesitarse una dilución diferentes. (La dilución necesaria para una determinada especie puede determinarse mediante la realización de un conteo de placa de suspensión McFarland 0.5 o 1.0 para determinar cuántos organismos esta turbidez representa, entonces, calcular el importe por el cual debe ser la suspensión inicial diluido para alcanzar la concentración final adecuada). Si en la revisión de cuentas de la placa desde el estudio de sinergia, el inóculo a partir de cualquiera de los tubos que contienen el antibiótico se encuentra haber sido perceptiblemente más bajo que el inóculo a partir del control de crecimiento, esto puede indicar que cualquier remanente de antibiótico o muy matanza rápida de bacterias en el breve tiempo entre la adición de bacterias en el tubo que contiene el antibiótico y la eliminación de la alícuota para la galjanoplastia. Si el número de colonias en la gota de aceite puro en una serie es menor que el número de colonias en las diluciones subsecuentes, esto sugiere efecto arrastre antibiótico. Se han descrito diferentes opciones para prevenir este efecto, como separar una alícuota única sobre una placa entera38 o girar hacia abajo la muestra, retirar el sobrenadante y vuelva a suspender en solución salina estéril antes de platear39. En cada momento en el método de tiempo de matar, también es fundamental para el investigador eficaz pero precisa extraer una alícuota de cada tubo de cultivo y realizar diluciones seriadas. Retrasos durante este proceso, particularmente durante los primeros momentos que se producen en estrecha sucesión, pueden conducir a períodos prolongados durante los cuales las culturas no son incubados y agitado, mientras que dispensar descuidado y diluciones seriadas pueden llevar a placa incorrecta cuenta. En comparación con el método de placa extensión de conteo de placa, en la que 100 μL de cada dilución se extiende sobre una placa de agar todo, el método de placa gota descrito es mucho más rápido, requiere un número mucho menor de placas de agar y permite contar más rápido, como máximo contable número de colonias por cada gota es 30, mientras que normalmente se puede contar hasta 300 colonias de una placa de expansión. Sin embargo, el método de placa de propagación también es una opción si los investigadores son más cómodos con esta técnica. Si gotas diseminado entre sí después de la dosificación con una pipeta multicanal, aplicación individual de más ampliamente espaciadas gotas con una pipeta monocanal puede realizarse en su lugar. En nuestra experiencia, enfriamiento placas a 4 ° C antes de dispensar las gotas parecía reducir propagación excesiva.
Una limitación de las técnicas descritas aquí es que los resultados de los dos tipos de ensayo de sinergia (matriz de tablero de ajedrez y tiempo de matar) no siempre son concordantes, y puesto que más publicaciones sinergia utilizan un método o el otro en lugar de ambos juntos, puede es difícil saber cómo integrar datos procedentes de los dos tipos de ensayos. Porque el método de la matriz de tablero automatizado que hemos desarrollado es sencillo y alto rendimiento, hemos utilizado lo en efecto como una especie de pantalla para probar combinaciones contra un mayor número de aislamientos y determinar qué combinaciones de concentración fueron sinérgicos. Luego realizamos un número menor de estudios de tiempo de matar, la selección de combinaciones y concentraciones que habían sido eficaces en la matriz de tablero de ajedrez. De nota, porque el ensayo de tablero de ajedrez se realiza típicamente en una escala de dilución microbroth, mientras que el tiempo matar emplea grandes volúmenes (similares a una dilución de macrobroth), encontramos que los FICs a veces eran diferentes entre los dos métodos, con mayor concentraciones generalmente requeridas en el ensayo de matar tiempo para demostrar la actividad. Este fenómeno se ha observado anteriormente cuando se comparan resultados de ensayo MIC de dilución de macrobroth y microbroth para bacilos Gram-negativos26 y cuando inóculos más grandes (como los utilizados en los estudios de tiempo de matar) son comparados con el inóculo estándar utilizado en microbroth dilución y tablero matriz ensayos de32. Una limitación específica de la matriz de tablero de ajedrez es la variabilidad inherente en dilución de microbroth MIC prueba22. Mientras CIE cortes de cuenta de sinergia para esta variabilidad matemáticamente6 tal variabilidad inevitablemente plantea preocupación acerca de la fiabilidad y consistencia de los resultados de la matriz de tablero de ajedrez.
Debido a las limitaciones inherentes a todo in vitro synergy (incluyendo el cultivo de bacterias en un medio artificial de crecimiento, concentraciones de antibióticas estáticas y un curso de tiempo limitado) los métodos de prueba, deben confirmarse los resultados obtenidos por estos métodos y más evaluado mediante técnicas suplementarias. Tales métodos incluyen estudios en vitro farmacocinéticos/farmacodinámicos (PK/PD) (por ejemplo, la fibra hueca infección modelo40), los modelos animales y, en definitiva, los estudios PK/PD y la eficacia en humanos. El método de la matriz de tablero automatizado descrito aquí, proporcionando un método rápido con el que a las combinaciones de pantalla para la actividad sinérgica potencial, permite más objetivo la utilización de estas técnicas. Más automatización de todos estos métodos, como investigación sistemática así como más de la relación entre los parámetros in vitro y los resultados clínicos, serán importante en escala hasta el uso de la sinergia de prueba y aumentar su aplicabilidad clínica.
Divulgaciones
El dispensador Digital D300 y consumibles asociados fueron proporcionados por Tecan (Morrisville, NC). TECAN no tuvo ningún papel en el diseño del estudio, colección e interpretación de datos, preparación de manuscrito o publicación.
Agradecimientos
Thea Brennan-Krohn fue apoyado por un Eunice Kennedy Shriver Instituto Nacional de salud infantil y de enfermedades infecciosas pediátricas desarrollo humano investigación beca de formación (T32HD055148), Instituto Nacional de alergias y enfermedades infecciosas () beca formación T32AI007061), beca de Hospital oficina de Facultad Facultad carrera desarrollo infantil Boston y un Instituto Nacional de alergias y enfermedades infecciosas desarrollo concesión de la carrera (1K08AI132716). J.E.K. fue apoyado por el Instituto Nacional de alergias y enfermedades infecciosas de los institutos nacionales de salud con el número de concesión AI119114 R33. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente las opiniones oficiales de los institutos nacionales de salud.
Materiales
| Name | Company | Catalog Number | Comments |
| Escherichia coli strain ATCC 25922 | ATCC | 25922 | QC strain |
| 0.5 mL microcentrifuge tubes | USA Scientific | 1605-0000 | |
| 1 L 0.22 µm bottle-top filter | Thermo Scientific Nalgene | 597-4520 | |
| 12 mm x 75 mm borosilicate glass round bottom culture tubes | Fisherbrand | 14-961-26 | |
| 15 mL conical tubes | Phenix | SS-PH15 | |
| 15 x 100 mm or 15 x 150 mm Mueller Hinton agar plates | Thermo Scientific | R01620 or R04050 | |
| 25 mm stainless steel closures for 25 x 150 mm glass culture tubes | Bellco | 2005-02512 | |
| 25 x 150 mm borosilicate glass round bottom culture tubes | Bellco | 2011-25150 | |
| 348-well sterile clear, flat-bottom, untreated microplates with lids | Greiner Bio-One | 781186 | |
| 50 mL conical tubes | Phenix | SS-PH50 | |
| 50 mL sterile reagent reservoirs | Corning | 4870 | |
| 96 deep well polypropylene microplate with 2 mL wells | Fisherbrand | 12-566-612 | |
| 96-well sterile clear, round-bottom, untreated microplates with lids | Evergreen | 222-8032-01R | |
| Cation adjusted Mueller Hinton broth | BD Diagnostics | 212322 | |
| Colistin sulfate | Alfa Aesar | J60915 | |
| D300e Control Software | HP/Tecan | ||
| DensiCHEK Plus McFarland reader | bioMérieux | 21250 | |
| Excel spreadsheet software | Microsoft | ||
| Extra long SHARP 10 µL Precision Barrier Tips | Denville Scientific | P1096-FR | |
| HP D300 digital dispenser | HP/Tecan | ||
| HP D300 T8+ cassettes | HP/Tecan | 30097370 | |
| Minocycline hydrochloride | Chem-Impex | 14302 | |
| Picus 12-channel 10-300 µL pipette | Sartorius | 735461 | |
| Polysorbate 20 | Fisher Bioreagents | BP-337 | Brand name: Tween 20 |
| Sodium chloride | Fisher Chemical | S271 | |
| Spectrophotometer | Tecan | Infinite M1000 PRO | |
| Xplorer 12-channel 50-1200 µL pipette | Eppendorf | 2231000328 |
Referencias
- Temkin, E., Adler, A., Lerner, A., Carmeli, Y. Carbapenem-resistant Enterobacteriaceae: Biology, epidemiology, and management. Annals of the New York Academy of Sciences. 1323 (1), 22-42 (2014).
- Spellberg, B. The future of antibiotics. Critical Care. 18 (3), (2014).
- Spellberg, B., et al. The epidemic of antibiotic-resistant infections: a call to action for the medical community from the Infectious Diseases Society of America. Clinical infectious diseases an official publication of the Infectious Diseases Society of America. 46 (2), 155-164 (2008).
- Elemam, A., Rahimian, J., Doymaz, M. In vitro evaluation of antibiotic synergy for polymyxin B-resistant carbapenemase-producing Klebsiella pneumoniae. Journal of Clinical Microbiology. 48 (10), 3558-3562 (2010).
- Poirel, L., Kieffer, N., Nordmann, P. In vitro evaluation of dual carbapenem combinations against carbapenemase-producing Enterobacteriaceae. Journal of Antimicrobial Chemotherapy. 71 (1), 156-161 (2016).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. Journal of Antimicrobial Chemotherapy. 52, (2003).
- Zusman, O., et al. Systematic review and meta-analysis of in vitro synergy of polymyxins and carbapenems. Antimicrobial Agents and Chemotherapy. 57 (10), 5104-5111 (2013).
- Clock, S. A., et al. In vitro activity of doripenem alone and in multi-agent combinations against extensively drug-resistant Acinetobacter baumannii and Klebsiella pneumoniae. Diagnostic Microbiology and Infectious Disease. 76 (3), 343-346 (2013).
- Hirsch, E. B., et al. Assessment of antimicrobial combinations for Klebsiella pneumoniae carbapenemase-producing K. pneumoniae. Journal of Infectious Diseases. 207 (5), 786-793 (2013).
- Tängdén, T., et al. Evaluation of double- and triple-antibiotic combinations for VIM- and NDM-producing klebsiella pneumoniae by in vitro time-kill experiments. Antimicrobial Agents and Chemotherapy. 58 (3), 1757-1762 (2014).
- Tascini, C., et al. Synergistic activity of colistin plus rifampin against colistin-resistant kpc-producing klebsiella pneumoniae. Antimicrobial Agents and Chemotherapy. 57 (8), 3990-3993 (2013).
- Paul, M., et al. Combination therapy for carbapenem-resistant Gram-negative bacteria. Journal of Antimicrobial Chemotherapy. 69 (9), 2305-2309 (2014).
- Rafailidis, P. I., Falagas, M. E. Options for treating carbapenem-resistant Enterobacteriaceae. Current Opinion in Infectious Diseases. 27 (6), 479-483 (2014).
- Smith, K. P., Kirby, J. E. Verification of an automated, digital dispensing platform for at-will broth microdilution-based antimicrobial susceptibility testing. Journal of Clinical Microbiology. 54 (9), 2288-2293 (2016).
- Brennan-Krohn, T., Truelson, K., Smith, K. P., Kirby, J. E. Screening for Synergistic Activity of Antimicrobial Combinations Against Carbapenem-Resistant Enterobacteriaceae Using Inkjet Printer-Based Technology. J Antimicrob Chemother. 72 (10), 2775-2781 (2017).
- Brennan-Krohn, T., Pironti, A., Kirby, J. E. Synergistic Activity of Colistin-Containing Combinations against Colistin-Resistant Enterobacteriaceae. Antimicrobial Agents and Chemotherapy. , (2018).
- Falagas, M. E., Kasiakou, S. K., Saravolatz, L. D. Colistin: The Revival of Polymyxins for the Management of Multidrug-Resistant Gram-Negative Bacterial Infections. Clinical Infectious Diseases. 40 (9), 1333-1341 (2005).
- Nation, R. L., Li, J. Colistin in the 21st century. Current Opinion in Infectious Diseases. 22 (6), 535-543 (2009).
- Ah, Y. -. M., Kim, A. -. J., Lee, J. -. Y. Colistin resistance in Klebsiella pneumoniae. International Journal of Antimicrobial Agents. 44 (1), 8-15 (2014).
- Bratu, S., et al. Carbapenemase-producing Klebsiella pneumoniae in Brooklyn, NY: Molecular epidemiology and in vitro activity of polymyxin B and other agents. Journal of Antimicrobial Chemotherapy. 56 (1), 128-132 (2005).
- Barth, N., Ribeiro, V. B., Zavasckid, A. P. In vitro activity of polymyxin B plus imipenem, meropenem, or tigecycline against KPC-2-producing Enterobacteriaceae with high MICs for these antimicrobials. Antimicrobial Agents and Chemotherapy. 59 (6), 3596-3597 (2015).
- MacLowry, J., Jaqua, M., Selepak, S. Detailed methodology and implementation of a semiautomated serial dilution microtechnique for antimicrobial susceptibility testing. Appl Microbiol. 20 (1), 46-53 (1970).
- Brennan-Krohn, T., Smith, K. P., Kirby, J. E. The poisoned well: Enhancing the predictive value of antimicrobial susceptibility testing in the era of multidrug resistance. Journal of Clinical Microbiology. 55 (8), 2304-2308 (2017).
- Doern, C. D. When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12), 4124-4128 (2014).
- CLSI. . Performance Standards for Antimicrobial Susceptibility Testing. 28th ed. CLSI supplement M100. , (2018).
- CLSI. . Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard - Tenth Edition. CLSI document M07-A10. , (2015).
- Clinical and Laboratory Standards Institute. . M07: Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically, 11th Edition. , (2018).
- Clinical and Laboratory Standards Institute. . Methods for determining bactericidal activity of antimicrobial agents; approved guideline M26-A. 19 (18), 7 (1999).
- Naghili, H., Tajik, H., Mardani, K., Razavi Rouhani, S. M., Ehsani, A., Zare, P. Validation of drop plate technique for bacterial enumeration by parametric and nonparametric tests. Veterinary research forum. 4 (3), 179-183 (2013).
- Chen, C. Y., Nace, G. W., Irwin, P. L. A 6x6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, Listeria monocytogenes, and Escherichia coli. Journal of Microbiological Methods. 55 (2), 475-479 (2003).
- Queenan, A. M., Foleno, B., Gownley, C., Wira, E., Bush, K. Effects of Inoculum and Activity in AmpC- and Extended-Spectrum (ESBL)-Producing Escherichia coli and Klebsiella pneumoniae Clinical Isolates Tested by Using NCCLS ESBL Methodology. Journal of Clinical Microbiology. 42 (1), 269-275 (2004).
- Smith, K. P., Kirby, J. E. The Inoculum Effect in the Era of Multidrug Resistance: Minor Differences in Inoculum Have Dramatic Effect on Minimal Inhibitory Concentration Determination. Antimicrobial Agents and Chemotherapy. , (2018).
- Leber, A. L. Synergism Testing: Broth Microdilution Checkerboard and Broth Macrodilution Methods. Clinical Microbiology Procedures Handbook, Fourth Edition. , (2016).
- Leber, A. L. Time-Kill Assay for Determining Synergy. Clinical Microbiology Procedures Handbook, Fourth Edition. , (2016).
- Hindler, J. A., Humphries, R. M. Colistin MIC variability by method for contemporary clinical isolates of multidrug-resistant gram-negative bacilli. Journal of Clinical Microbiology. 51 (6), 1678-1684 (2013).
- Sutherland, C. A., Nicolau, D. P. To add or not to add Polysorbate 80: Impact on colistin MICs for clinical strains of Enterobacteriaceae and Pseudomonas aeruginosa and quality controls. Journal of Clinical Microbiology. 52 (10), 3810 (2014).
- Fuchs, P. C., Barry, a. L., Brown, S. D. Susceptibility testing quality control studies with fosfomycin tromethamine. European journal of clinical microbiology & infectious diseases official publication of the European Society of Clinical Microbiology. 16 (7), 538-540 (1997).
- Leber, A. L. Minimum Bactericidal Concentration Testing. Clinical Microbiology Procedures Handbook, Fourth Edition. 5.14.1.11. , (2016).
- Cai, Y., et al. In vitro activity of polymyxin B in combination with various antibiotics against extensively drug-resistant Enterobacter cloacae with decreased susceptibility to polymyxin B. Antimicrobial Agents and Chemotherapy. 60 (9), 5238-5246 (2016).
- Bulman, Z. P., et al. Polymyxin combinations combat Escherichia coli harboring mcr-1 and blaNDM-5: Preparation for a postantibiotic Era. mBio. 8 (4), (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados