Method Article
Utilizando el protozoo Paramecium caudatum como un vehículo para las infecciones transmitidas por los alimentos en las larvas de pez cebra
En este artículo
Resumen
Pez cebra (Danio rerio) se están convirtiendo en un modelo animal vertebrado usados para la colonización microbiana y la patogenesia. Este protocolo describe el uso del protozoo Paramecium caudatum como vehículo de infección transmitidas por los alimentos en las larvas de pez cebra. P. caudatum internaliza las bacterias y haz tomado por larval pez cebra a través el comportamiento natural de aprovecharme.
Resumen
Debido a su transparencia, maleabilidad genética y facilidad de mantenimiento, el pez cebra (Danio rerio) se han convertido en un modelo vertebrado utilizado para enfermedades infecciosas. Pez cebra larvas alimentan naturalmente el protozoo unicelular Paramecium caudatum. Este protocolo describe el uso de p. caudatum como vehículo de infección transmitidas por los alimentos en el pez cebra larval. P. caudatum interiorizar una amplia gama de bacterias y células bacterianas permanecen viables por varias horas. Pez cebra entonces presa de p. caudatum, se libera la carga bacteriana en el foregut en digestión del vehículo paramecium y las bacterias colonizan el tracto intestinal. El protocolo incluye una descripción detallada del mantenimiento de paramecio, cargando con las bacterias, determinación de la degradación bacteriana y dosis, así como infección de pez cebra por alimentación con paramecio. La ventaja de utilizar este método de infección transmitidas por los alimentos es que estrechamente imita el modo de la infección observada en enfermedad humana, conduce a la colonización más robusta comparada con protocolos de inmersión y permite el estudio de una amplia gama de patógenos. Infección transmitidas por los alimentos en el modelo de pez cebra puede utilizarse para investigar la expresión del gen bacteriano dentro del anfitrión, interacciones huésped-patógeno y señas de identidad de patogenicidad como morbilidad, localización, difusión y carga bacteriana.
Introducción
Cuota de pez cebra morfológicamente y funcionalmente conservado características con los mamíferos, incluyendo granulocytic linajes (p. ej., neutrófilos), monocito/macrófago-como las células, los receptores Toll-like, citoquinas proinflamatorias y péptidos antimicrobianos1 . El tracto intestinal en el pez cebra es completamente desarrollado en 6 días post fertilización (dpf) y muestra conservación morfológica y funcional con el tracto gastrointestinal de mamífero, como conservado regulación transcripcional en células epiteliales intestinales 2. lo pez cebra un excelente modelo de colonización microbiana intestinal y patogénesis. Una amplia gama de microbios entéricos se ha estudiado en el modelo de pez cebra, incluyendo enterohemorrágica Escherichia coli3, Vibrio cholerae4,5, Salmonella enterica6, la pez cebra microbiota7,8y el papel de los probióticos en la inmunidad intestinal9. Una clara ventaja del modelo de pez cebra es que es colonizado por muchos microbios sin alterar la microbiota endógena, que permite la investigación del comportamiento microbiano en el contexto de poblaciones microbianas mezcladas3, 6. Actualmente, la mayoría modelos de pez cebra de colonización gastrointestinal y enfermedad dependen de la administración de los microbios por inmersión en baño, donde el pez cebra se incuban en una suspensión bacteriana para una cantidad específica de tiempo de10. Sin embargo, esto hace difícil determinar la dosis exacta de bacterias administradas y conduce a la colonización limitada con algunos microbios, particularmente con bacterias no patógenas. Alternativamente, se administra una suspensión bacteriana a pescar vía oral por sonda nasogástrica11, pero esto es técnicamente difícil y limitado a las larvas mayores y peces adultos.
Este protocolo describe el uso del protozoario unicelular Paramecium caudatum como vehículo de entrega transmitidas por los alimentos de microbios en el tracto gastrointestinal de las larvas de pez cebra. Paramecia es fáciles y baratos de mantener y es capaces de alimentarse de una gran variedad de microbios, incluyendo algas, hongos y bacterias, que interiorizan a través de un surco oral ciliadas12,13,14. Una vez interiorizado, las bacterias se encuentran en las vacuolas, que eventualmente acidificar y contenido son degradados en un marco de tiempo de varias horas15. Pez cebra larvas capturar paramecio como presas naturales pronto después de la eclosión, alrededor PD de 3 a 4 dependiendo de la temperatura16y asumir con eficacia alta. El proceso de captura de la presa tiene en promedio 1.2 s de detección para capturar17y paramecio capturado es digerido rápidamente en el foregut del pez cebra, que bacterias viables interiorizadas son liberadas en el tracto intestinal3. Como resultado, paramecio puede utilizarse como un método rápido y fácil para entregar una dosis alta y consistente de bacterias en el tracto gastrointestinal del pez cebra. La bacteria entregada puede transformarse ya sea para expresar una proteína fluorescente, como mCherry como se describe aquí, o, en el caso de bacterias genéticamente intratables, pueden ser previamente teñidos con un colorante fluorescente para permitir una visualización dentro de la tracto gastrointestinal.
Este protocolo describe la entrega de alimentos de enteropatógeno e. coli (enterohemorrágica e. coli [EHEC] y adherente invasoras de e. coli [AIEC]) y SSP. enterica de las salmonelas Typhimurium. Patógenas de e. coli y S. typhimurium son transmitidas vía la ruta fecal-oral18,19y pueden ser adquirida a través contaminado alimentos, como carne, verduras y productos lácteos. Utiliza como un vehículo de p. caudatum , e. coli y S. typhimurium colonizan con éxito las larvas de pez cebra dentro de 30 a 60 min de incubación conjunta con el vehículo de paramecium. La carga bacteriana alcanzada es suficientemente robusta como para visualizar la colonización y determinar carga de homogenados de tejido de la galjanoplastia.
Protocolo
Cuidado de pez cebra, cría y experimentos descritos aquí están de acuerdo con la guía para el cuidado y uso de animales de laboratorio y han sido aprobados por el Comité institucional de Bienestar Animal del Universidad de Texas Health Science Center, protocolo número AWC-16-0127.
1. crecimiento y mantenimiento de paramecio
- Obtener paramecio en culturas de fuentes como el centro de recursos internacional de pez cebra (ZIRC).
- De una cultura cada vez más vivo, añadir 1 mL del cultivo de paramecio, 1 mL de una cultura de MG1655 de e. coli (densidad óptica OD600 1.0 – 2.0) resuspendió en 1 x E3 (0,29 G/l NaCl, 13 mg/L de KCl, 44 mg/L de CaCl2, 81 mg/L de MgSO4 0,48 g/L HEPES, pH 7.0, estéril) y 8 mL de 1 x E3 a un matraz de 10 mL cultivo de tejidos. Agitar ligeramente y luego se almacenan a 22 ° C.
- Para mantener una cultura, de cada dos semanas, paso 1 mL de un cultivo de paramecio en un matraz de cultivo de tejidos de 10 mL con 9 mL de medio x E3 1 fresco contiene 108 UFC/mL de e. coli MG1655 resuspendió en 1 x E3.
2. determinación de dosis bacteriana administrada al pez cebra
-
Determinar la vida media bacteriana en Paramecium
Nota: La vida media de bacterias en el paramecio está determinada por la galjanoplastia viables e. coli recuperadas de paramecium, como se describe a continuación.- Después de una incubación de 2 h de bacterias (OD600 de 1.0) con paramecio a 22 ° C, combinar el paramecio y la cultura Co bacteriana en un tubo cónico de 50 mL, lavar el paramecio con 1 x E3 y cuenta el número de paramecio por mililitro (como se describe abajo en los pasos 3.2.7 y 3.2.8).
- Después de contar el número de paramecio, quitar 50 μl de la paramecio y cultivo bacteriano Co cada hora (para la exposición después de 6 h) y añadir a cada muestra en un nuevo tubo 1,5 mL.
- Lugar 950 μl de surfactante no iónico 1% (véase Tabla de materiales) en fosfato tampón salino (PBS) en cada uno de los tubos de 1.5 mL y vortex por 1 min a lisar el paramecio. Realizar 1:10 diluciones de cada muestra utilizando PBS estéril como diluyente (es decir, 100 μL en 900 μL).
- Placa de 100 μl de cada dilución en placas de selectivo (medio LB TTE: 1 G/l triptona, extracto de levadura 0.5 g/L, 1 g/L de NaCl, tetraciclina 30 de μg/mL) e incubar a 37 ° C por 16 h. Al día siguiente, contar y registrar el número de colonias bacterianas en la placa (unidades formadoras de colonias, UFC) contando sólo las colonias individuales aisladas y distintas. Identificar un plato con una dilución que da 30-300 UFC.
- Determinar la dilución de factor utilizado. Por ejemplo, si 1 μl de cultivo bacteriano se mezcla con 99 mL de PBS estéril, se trata de una dilución 1: 100 (0.01). Este número será el número de UFC en la dilución. Realizar el cálculo por debajo, para cada punto del tiempo, para determinar la UFC en la muestra original:
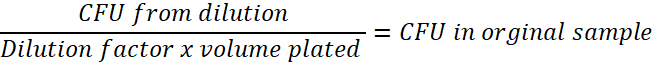
- Calcular y ver el número de viables e. coliy paramecium correspondiente a las horas post exposición la concentración de paramecio calculado en el paso 3.3.1 determinar el período dentro de la paramecio (figura 1).
- Con la UFC número calculado para cada punto del tiempo, calcular y ver el número de viables e. coli por cada paramecio en el eje y frente a la incubación de horas puesto en el eje x, utilizando la concentración de paramecio calculada en el paso 3.3.1. Determinar la vida media en el paramecio.
-
Determinar la tasa de dosificación de Half-Life bacteriana bacteriana y cazando.
Nota: Para determinar la dosis bacteriana, la vida media de las bacterias dentro del paramecio y la tasa de aprovecharme del pez cebra en paramecio (ver paso 3.4) tiene que tenerse en cuenta.- Utilice la siguiente fórmula para determinar el decaimiento bacteriano dentro de paramecio:
(1)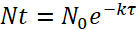
Cuando N0 es la cantidad inicial de bacterias por paramecio después de la incubación de 2 h, Nt es la cantidad restante después de tiempo t τ es el tiempo después de lo cual ha reducido el número de bacterias viables y k es la constante de decaimiento. - Desde el experimento de degradación, determinar el decaimiento constante k con la media de vida bacteriana (es decir, el tiempo después de lo cual ha reducido la cantidad de bacterias viable/paramecio).
(2)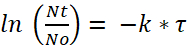
Para la determinación de Half-Life, el término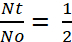 y
y
(3)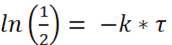 o
o
(4)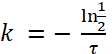
Nota: Basado en la figura 1, la vida media de e. coli en paramecio es aproximadamente de 2,3 horas. Así, usando la fórmula (4), la tasa de decaimiento, k, para e. coli es:
(5)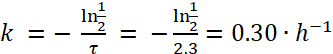
- Determinar la velocidad de descomposición (k) del experimento de Half-Life para encontrar la dosis de bacterias viables (Nt) de las larvas de pez cebra después del tiempo aprovecharme (t), donde (P) es la tasa de aprovecharme o el número de paramecio comido por un pez por hora:
(6)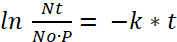 o
o
(7)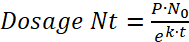
Nota: Según la figura 1, la cantidad inicial de bacterias por paramecio (N0) después de una incubación de 2 h (t) es UFC 790. Por película 1 y figura 2, la tasa de aprovecharme (P) es 1539. - Usando estos valores para sustituir en la ecuación (7), calcule la dosificación bacteriana consumida por un pez cebra después de una incubación de 2 h como:
(8)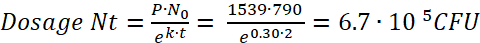
- Utilice la siguiente fórmula para determinar el decaimiento bacteriano dentro de paramecio:
3. transmitidas por los alimentos infección del pez cebra
- Incubar las bacterias con el paramecio.
- Preparar un cocultivo de paramecio y e. coli MG1655 la noche antes de la infección. Mezclar 8 mL de medio de E3, 1 mL de un cultivo de paramecio curso y 1 mL de un cultivo de e. coli MG1655 (OD600 = 1.0) resuspendió en 1 x E3 en frascos de cultivo de tejidos T25. Incubar durante una noche los frascos a temperatura ambiente (RT). Para cada condición de tratamiento, preparar dos frascos de paramecio.
- Inocular los medios de crecimiento bacteriano (LB: 1 G/l triptona, extracto de levadura 0.5 g/L, 1 g/L de NaCl) con cepa infecciosa bacteriana, escogiendo una colonia bacteriana individual de una placa usando un asa de inoculación estéril. Incubar el cultivo líquido a 37 ° C y dejar temblando en 110 revoluciones por minuto (rpm) durante la noche.
Nota: Se debe usar equipo de protección personal (guantes y un abrigo de laboratorio) y centros de nivel 2 de bioseguridad deben utilizarse al manipular a agentes infecciosos. - Al día siguiente, medir OD600 de la cultura durante la noche. Calcular el volumen de la cultura necesaria para lograr un OD600 de 1 cuando se resuspendió en 11 mL de los medios de comunicación.
- El volumen de las bacterias del paso 3.1.2 mediante centrifugación a 6.000 g durante 5 min, un volumen para cada frasco de paramecio de la cosecha. Deseche el sobrenadante y resuspender el precipitado bacteriano en 1 mL de medio de E3.
- Opcionalmente, la tinción las bacterias con un colorante fluorescente.
- Añadir 1 μl de mancha bacteriana de FM 4-64FX (5 mg/mL de solución stock). Cubrir el tubo con papel de aluminio para proteger de fotoblanqueo e incubar giratorio sobre fin a TA durante 15 minutos.
- Retirar el exceso de tinte lavando con 1 x E3: de la pelotilla de las bacterias mediante centrifugación a 6.000 x g durante 1,5 min., luego Resuspender el precipitado en 1 mL de medio de E3. Repita el paso de lavado dos veces.
- Cosecha de bacterias teñidas mediante centrifugación a 6.000 x g durante 5 min., descartar el sobrenadante y resuspender el precipitado bacteriano en 1 mL de medio de E3.
- Añadir 1 mL de la suspensión bacteriana a cada uno de los dos matraces de paramecio fresco. Incubar a temperatura ambiente durante 2 h.
Nota: Si trabaja con bacterias manchadas, incubar en la oscuridad a temperatura ambiente por 2 h.
- Lavado de las bacterias/paramecio co-cultivo.
- Combinar el contenido de dos frascos de co-cultura de la paramecio bacterias en un tubo cónico de 50 mL. Centrifugar las muestras a 300 x g a 15 ° C durante 10 minutos Asegúrese de que la centrífuga esté previamente enfriada antes de este paso.
- Retire aproximadamente 10 mL del sobrenadante de E3 con una pipeta serológica y añadir aproximadamente 10 mL de fresco 1 x E3 en el tubo cónico.
Nota: Durante todos los pasos de lavado, es esencial ser muy rápida al retirar el sobrenadante, como el paramecio comenzará a nadar fuera de la pelotilla. Spin y eliminar sobrenadante de un tubo en un tiempo para garantizar una gestión bastante rápida en este paso y evitar la pérdida de paramecio en el sobrenadante. - Centrifugado de muestras por centrifugación a 300 x g a 15 ° C para 5 minutos Retire aproximadamente 10 mL del sobrenadante de E3 con una pipeta serológica y añadir aproximadamente 10 mL de fresco 1 x E3 en el tubo cónico. Repita este paso dos veces.
- Centrifugar las muestras a 300 x g a 15 ° C por 5 min quitar aproximadamente 10 mL del sobrenadante E3, teniendo cuidado de no para perturbar el sedimento.
- Resuspender el precipitado en los 10 mL restantes de E3 media y transferir 500 μl de la suspensión a un tubo nuevo de microcentrífuga de 1,5 mL. De pellets 500 μl de paramecio por centrifugación a 300 x g durante 5 minutos contar el número de la paramecio.
- Retire 400 μL de la E3 sobrenadante de la muestra de 500 μl. Añadir 20 μl de solución de formaldehído 36.5% a los restantes 100 μl de paramecio y resuspender suavemente e incubar durante 5 minutos a 22 ° C.
Nota: Este paso elimina el paramecio para contar. - Medir el volumen total real utilizando la pipeta y registro. Diluir la suspensión 1:1 v/v del paramecio con solución de azul de tripano 0.4%.
- Utilice un contador celular o hemocitómetro para contar el número de muertos paramecio/mL.
Nota: Por el paso de fijación previa, paramecio la mayoría estarán muerto en este momento, pero este número refleja el número de paramecio vivo para el experimento de incubación conjunta. Los autores no han encontrado muerte paramecio significativa debido a bacteriano incubación Co, por lo que esto puede tomarse como un factor aquí.
- Co incubar larvas de paramecio y pez cebra.
- Calcular la concentración de paramecio:
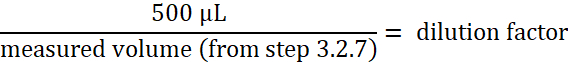

Nota: Este cálculo da la concentración de paramecio en el tubo cónico de 50 mL del paso 3.2.5. - Calcular el volumen de paramecio lavado necesaria para una concentración de 2 x 105 paramecia/mL en un volumen final de 3 mL de E3.
Nota: La concentración de paramecio puede ajustarse en base a la dosis deseada de la bacteriana, que sea objeto de optimización. - Anestesiar el pez cebra agregando Metanosulfonato en 100 mM Tris, pH 8.0 a una concentración final del pez cebra transferencia 10 de 100 mg/L. en cada pocillo de una placa de 6 pozos en un volumen total de 3 mL de E3 frescos que contienen la concentración adecuada de paramecio (calculado en el paso 3.3.2). Asegúrese de transferir las larvas en una cantidad mínima de líquido, para que se recuperen de la anestesia en el pozo receptor.
- Incubar a 30 ° C por 2 h en una incubadora diurna en condiciones de luz del día, para garantizar unas condiciones de iluminación óptima para cazar.
- Lavar pez cebra al menos 5 veces por la transferencia de peces en un nuevo bien que contiene 3 mL de E3 fresco que contiene Metanosulfonato de 100 mg/L cada vez.
Nota: No trate de omitir el Metanosulfonato durante la etapa de lavado. Transferencia de larvas móviles sin anestesia aumenta el riesgo de daño y sufrimiento a los animales. - Opcionalmente, preparar pez cebra para la proyección de imagen por incrustación de pez cebra en 3 mL de 1% agarosa de baja fusión en una placa de 6 pozos paredes negro: agarosa de la bajo-derretir se compone en 1xE3 y calientan en un microondas. Una vez fundido, añadir tricaine a una concentración final de 160 mg/mL. Pescados de posición bajo un estereomicroscopio, utilizando un gel recortado de carga punta, asegurándose de que la cabeza esté a la izquierda y la cola está a la derecha (figura 3). Espere 5 minutos para la agarosa configurar, luego superponer el pescado integrado con 1 Metanosulfonato de x E3 que contiene 160 mg/mL para la proyección de imagen.
- Calcular la concentración de paramecio:
- Determinar la tasa de aprovecharme.
Nota: No experimento separado debe ser establecido para determinar la tasa de aprovecharme. Por el contrario, esto puede hacerse durante el paso 3.3.4, como se describe a continuación.- Paso 3.3.4, ver pez cebra aprovecharme de un estereomicroscopio y captura videos de la captura de presas.
- Puntuación de las secuencias de video. Captura de la presa se caracteriza por pulso de pez cebra hacia la presa. Contar cada huelga como evento de captura de una presa, aunque esto es sólo una aproximación (ver discusión).
- Calcular el número promedio de presa captura eventos por hora de varios videos clips, cada uno representando a una larva de pez cebra diferentes (figura 2).
Resultados
Paramecium caudatum internaliza fácilmente una amplia gama de bacterias en las vacuolas de almacenamiento. La densidad bacteriana intracelular depende de la densidad de bacterias y paramecio en la cultura de cooperación, así como las especies bacterianas usadas. Con el tiempo, las vacuolas acidifican y sobreviene la degradación bacteriana. La tasa de degradación debe ser determinada individualmente para todas las cepas utilizadas. Para patógenos de e. coli, la densidad bacteriana inicial es 790 bacterias /paramecioy las bacterias se degradan con una vida media de aproximadamente 2,3 h (figura 1).
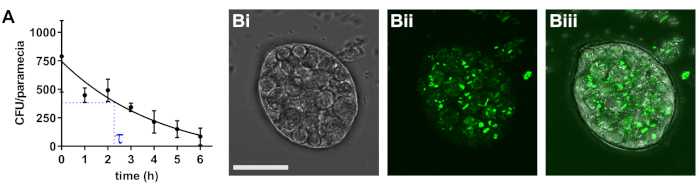
Figura 1: determinación de la vida bacteriana en paramecio. (A) siguientes 2 h de incubación conjunta con infecciosas e. coli, p. caudatum fue lavada y trasladado a medio sin bacterias. En los puntos de tiempo indicado, los números de viables e. coli las células se determinaron por la galjanoplastia de dilución en agar selectivo. Resultados son medios ± error estándar de la media (SEM; n = 3). (B) imagen típica de paramecium llevar interiorizado las bacterias, con campo brillante (Bi), las bacterias fluorescentes (Bii) y combinó canales (Biii). Barra de escala = 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
Además, el pez cebra cazando tasa, es decir, la tasa a la cual pez cebra internalizar paramecio cargado de bacterias en la incubación, se estudió. Pez cebra larvas comienzan a cazar y capturar presas vivas de 5 PD20, aunque se constató que, cuando se levanta a 30 ° C, se acelera el desarrollo larvario y animales mostrar comportamiento aprovecharme de dpf 4. Depredar es acompañado por una característica sorprendente comportamiento20 (figura 2A), y la determinación de la tasa de aprovecharme se basa en la suposición de que cada huelga conduce a la internalización de un paramecium, aunque esto puede considerarse sólo un aproximación (ver discusión). Partiendo de las observaciones aquí descritas de depredando larvas de pez cebra, la tasa de absorción de paramecio es aproximadamente 1.539 por h (figura 2B).
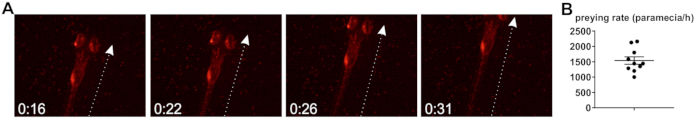
Figura 2: determinación de la tasa de aprovecharme del pez cebra. (A) imágenes fijas de un video depredando, que muestra un pez cebra larvas (5 PD) atacando a paramecio con bacterias fluorescentes. Tiempo en [segundos]. La flecha indica el principal eje de movimiento durante el pulso. (B) cuantificación de la tasa de aprovecharme (ingesta de paramecio por hora), partiendo de n = 10 videos tomados durante el tiempo de exposición completo 2 h. Haga clic aquí para ver una versión más grande de esta figura.
Después de la internalización de paramecio, el pez cebra degrada eficientemente la presa en el foregut, liberación de bacterias infecciosas en el aparato digestivo. Como se describe en este documento, degradación de paramecio procede rápidamente, y las bacterias libres pueden detectarse en el tracto intestinal dentro de 30 minutos de aprovecharse. Libre de bacterias y luego mover del foregut en el intestino medio y posterior, donde se detectan aproximadamente 1 – 2 h después del inicio de aprovecharme (figura 3). Persistencia bacteriana en el intestino depende de la especie y dosis pero gamas de varios h a varios días en el caso de e. coli y S. enterica. S. enterica se localiza principalmente en la mucosa intestinal, con alguna invasión epitelial (figura 3D), llevando a la infiltración de neutrófilos en el epitelio (figura 3).
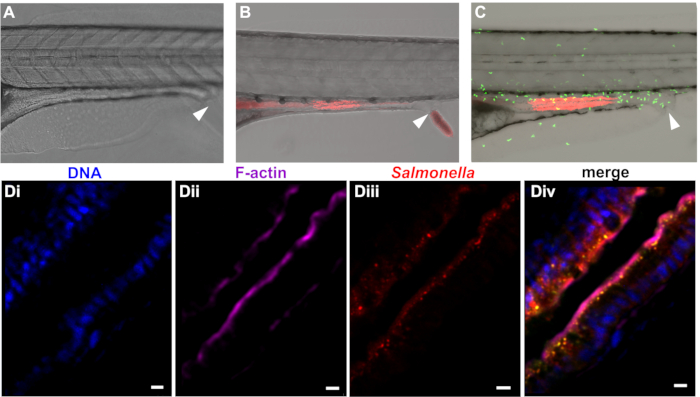
Figura 3: colonización de pez cebra con bacterias. Pez cebra en dpf 5 no infectado (A) a la izquierda o colonizadas con mCherry expresando (B) e. coli o (C) S. enterica. Experimentos de infección pueden realizarse en el tipo salvaje (A y B) pescado o líneas transgénicas (por ejemplo, la línea de Tg (MPO::EGFP) i114 expresando neutrófilos fluorescentes verdes se muestra en (C). La abertura rectal está marcada por una flecha. (D) aumento mayor de la sección intestinal de larvas incrustadas todo Monte infectado con la infección de Salmonella enterica . Azul (Di) = núcleos, púrpura (Dii) de la marca Hoechst = phalloidin marca F-actina, (Diii) rojo = Salmonella, merge (Div). Barra de escala = 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
1 de la película: imágenes del Video de la captura de presas. Haga clic aquí para descargar este video.
Discusión
El protocolo básico descrito aquí ha sido optimizado para patógenos de e. coliy ha sido exitosamente adaptado para otras especies bacterianas, incluyendo Salmonella enterica y Vibrio cholerae. Para algunas especies que no colonizan el intestino del pez cebra tras inmersión baño, incluyendo algunas cepas de Salmonella enterica y algunos anaerobios, infecciones transmitidas por los alimentos como se describe aquí pueden utilizarse para establecer con éxito la colonización. Comparado con el microgavage, que también se utiliza para establecer altas cargas bacterianas en el tracto intestinal larvas, infecciones transmitidas por los alimentos es técnicamente menos difíciles y requiere equipo menos especializado. Sin embargo, los parámetros críticos deben optimizarse para que la especie bacteriana y las cepas para ser utilizado. Tales factores incluyen la densidad bacteriana y paramecium para el paso de cocultivo de paramecio bacterias: si números bacterianos dentro paramecia son bajos, esto podría mejorarse mediante el aumento de la densidad bacteriana en el paso de la cultura. Algunas especies bacterianas pueden dañar al anfitrión paramecium, y esto debería ser evaluado por microscopía.
Otro factor importante en el presente Protocolo es presa de captura de pez cebra. La tasa de aprovecharme como se describe aquí se basa en la suposición de que cada captura presas huelga resultados en la ingestión de un paramecium. Altas densidades de paramecio por peces son utilizadas en el protocolo para asegurar altas tasas de aprovecharme. Sin embargo, captura de presa depende de la densidad de paramecio en el sistema, y en cultivos de paramecium muy diluida, depredando las tasas pueden ser tan bajas como paramecio de 13 a 15 por hora21,22. Una limitación es que las tasas de captura de presas también son fuertemente dependientes de las condiciones de iluminación y en la oscuridad, las tasas de captura son 80% más bajo que en condiciones de luz21 y esto deben tenerse en cuenta al establecer experimentos. Si tiempos de exposición a la presa tienen que ampliarse para optimizar la colonización, consideración ha de ser entregado a la exposición secundaria a bacterias a través de las heces. En las condiciones descritas arriba – 2 h de la exposición de la presa, esta exposición es insignificante, puesto que tiempo del paso intestinal de bacterias es más de 1 h y la concentración de bacterias en el vehículo es mucho mayor que en las heces. Sin embargo, si el tiempo de exposición de la presa se incrementa significativamente, esto puede convertirse en un factor importante.
Los controles adecuados deben incluirse en este protocolo, incluyendo colonización del pez cebra después de alimentar con paramecio que contiene no patógenas e. coli MG1655. Si se comparan varias cepas bacterianas por su capacidad para colonizar el host de pez cebra, es importante comprobar si su vida media en el paramecio es comparable. Las mutaciones bacterianas, los comprometer la integridad de la pared celular o la detección de ácido, incluidos pueden comprometer la estabilidad bacteriana dentro de paramecio. En tales casos, pez cebra de alimentación debe ser ajustada para tener en cuenta las diferencias en la dosificación.
El protocolo descrito aquí puede utilizarse para investigar la colonización bacteriana y sus consecuencias, incluyendo imágenes de colonización bacteriana del pez cebra como se describe anteriormente, así como mediante la determinación de UFC por pez cebra de homogeneizado de tejido3, o investigando la mortalidad y la morbilidad asociada a la infección. Idealmente, para la visualización de bacteria, se recomienda las cepas bacterianas que expresan proteínas fluorescentes como mCherry o proteína fluorescente roja (RFP). Esto permitirá que la visualización del crecimiento de las poblaciones bacterianas. Si la cepa bacteriana no es genéticamente manejable o el uso de la expresión de la proteína fluorescente está impedido por otras razones, las bacterias pueden teñirse con un colorante fluorescente, como FM 4-64FX, antes de cultura conjuntamente con el paramecio. Cuando se utiliza el protocolo descrito aquí, cocultivo con paramecio no disminuyen el brillo del tinte y bacterias teñidas son claramente visibles en el intestino del pez cebra. Sin embargo, el tinte se diluirá en el tiempo significativa proliferación bacteriana ocurre en el host de pez cebra. En cualquier caso, las bacterias fluorescentes rojo son preferibles sobre las bacterias verde fluorescente, desde tejido autofluorescencia puede ser superior en el verde que en el canal rojo.
Se ha encontrado que este protocolo puede ser adaptado para aerobios y microaerofílicos especies bacterianas. Es posible adaptarlo para la alimentación de las esporas y especies de hongos, aunque esto queda por probarse experimentalmente.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a los miembros del grupo Krachler para la lectura crítica y comentarios del manuscrito. Este trabajo fue financiado por un UT sistemas STAR award, el BBSRC y el NIH (R01AI132354).
Materiales
| Name | Company | Catalog Number | Comments |
| Paramecium caudatum, live | Carolina | 131554 | no not store growing cultures below room temperature |
| 0.4% Trypan Blue Solution | Sigma | T8154-20ML | liquid, sterile-filtered, suitable for cell culture; prepared in 0.81% sodium chloride and 0.06% potassium phosphate, dibasic |
| Dimethyl sulfoxide (DMSO) | Sigma | 276855-100ML | store in a solvent safety cabinet |
| Escherichia coli, MG1655 | ATCC | ATCC 700926 | can be replaced by any other non-pathogenic E. coli strain |
| FM 4-64FX stain | Thermo Fisher | F34653 | aliquot and store frozen |
| Formaldehyde | Sigma | F8775-4X25ML | |
| LB Broth | Sigma | L3397-1KG | |
| Phosphate buffered saline tablets | Thermo Fisher | 18912014 | |
| Tetracycline | Sigma | 87128-25G | toxic, irritant |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma | E10521-10G | |
| Triton X-100 | Sigma | X100-100ML | |
| Trypan Blue Solution, 0.4% | Sigma | 93595-50ML | |
| UltraPure Low Melting Point Agarose | Thermo Fisher | 16520050 | |
| hemocytometer or cell counter | any | ||
| stereomicroscope | any | ||
| table-top centrifuge | |||
| microwave | |||
| rotator wheel | |||
| heated shaking incubator | |||
| aquatics facilities | |||
| breeding tanks |
Referencias
- Broz, P., Ohlson, M. B., Monack, D. M. Innate immune response to Salmonella Typhimurium, a model enteric pathogen. Gut Microbes. 3 (2), 62-70 (2012).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), e2002054 (2017).
- Stones, D. H., et al. Zebrafish (Danio rerio) as a Vertebrate Model Host To Study Colonization, Pathogenesis, and Transmission of Foodborne Escherichia coli O157. mSphere. 2 (5), (2017).
- Mitchell, K. C., Breen, P., Britton, S., Neely, M. N., Withey, J. H. Quantifying Vibrio cholerae enterotoxicity in a zebrafish infection model. Applied and Environmental Microbiology. , 00783 (2017).
- Logan, S. L., et al. The Vibrio cholerae type VI secretion system can modulate host intestinal mechanics to displace gut bacterial symbionts. Proceedings of the National Academy of Sciences of the United States of America. 115 (16), E3779-E3787 (2018).
- Howlader, D. R., et al. Zebrafish as a novel model for non-typhoidal Salmonella pathogenesis, transmission and vaccine efficacy. Vaccine. 34 (42), 5099-5106 (2016).
- Troll, J. V., et al. Microbiota promote secretory cell determination in the intestinal epithelium by modulating host Notch signaling. Development. 145 (4), (2018).
- Wiles, T. J., et al. Host Gut Motility Promotes Competitive Exclusion within a Model Intestinal Microbiota. PLoS Biology. 14 (7), e1002517 (2016).
- Rendueles, O., et al. A new zebrafish model of oro-intestinal pathogen colonization reveals a key role for adhesion in protection by probiotic bacteria. PLoS Pathogens. 8 (7), e1002815 (2012).
- Varas, M., et al. Salmonella Typhimurium induces cloacitis-like symptomsin zebrafish larvae. Microbial Pathogenesis. 107, 317-320 (2017).
- Runft, D. L., et al. Zebrafish as a natural host model for Vibrio cholerae colonization and transmission. Applied and Environmental Microbiology. 80 (5), 1710-1717 (2014).
- Meier, R., Wiessner, W. Infection of algae-free Paramecium bursaria with symbiotic Chlorella sp. Isolated from green paramecia: I. Effect of the incubation period. European Journal of Protistology. 24 (1), 69-74 (1988).
- Miura, T., Moriya, H., Iwai, S. Assessing phagotrophy in the mixotrophic ciliate Paramecium bursaria using GFP-expressing yeast cells. FEMS Microbiology Letters. 364 (12), (2017).
- Watanabe, K., et al. Ciliate Paramecium is a natural reservoir of Legionella pneumophila. Scientific Reports. 6, 24322 (2016).
- Bragg, A. N., Hulpieu, H. A Method of Demonstrating Acidity of Food Vacuoles in Paramecium. Science. 61 (1580), 392 (1925).
- Borla, M. A., Palecek, B., Budick, S., O'Malley, D. M. Prey capture by larval zebrafish: evidence for fine axial motor control. Brain, Behavior and Evolution. 60 (4), 207-229 (2002).
- Patterson, B. W., Abraham, A. O., MacIver, M. A., McLean, D. L. Visually guided gradation of prey capture movements in larval zebrafish. Journal of Experimental Biology. 216 (Pt 16), 3071-3083 (2013).
- Megraud, F. Transmission of Helicobacter pylori: faecal-oral versus oral-oral route. Alimentary Pharmacology & Therapeutics. 9 Suppl 2, 85-91 (1995).
- Spears, K. J., Roe, A. J., Gally, D. L. A comparison of enteropathogenic and enterohaemorrhagic Escherichia coli pathogenesis. FEMS Microbiology Letters. 255 (2), 187-202 (2006).
- Bianco, I. H., Kampff, A. R., Engert, F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Frontiers in Systems Neuroscience. 5, 101 (2011).
- Gahtan, E., Tanger, P., Baier, H. Visual prey capture in larval zebrafish is controlled by identified reticulospinal neurons downstream of the tectum. Journal of Neuroscience. 25 (40), 9294-9303 (2005).
- Westphal, R. E., O'Malley, D. M. Fusion of locomotor maneuvers, and improving sensory capabilities, give rise to the flexible homing strikes of juvenile zebrafish. Frontiers in Neural Circuits. 7, 108 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados