Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mejora de extrusión de alta viscosidad de microcristales para Cristalografía de femtosegundo Serial tiempo resuelto en láseres de rayos x
En este artículo
Resumen
El éxito de un experimento de Cristalografía de femtosegundo serial tiempo resuelto es dependiente en la entrega de la muestra eficiente. Aquí, describimos protocolos para optimizar la extrusión de bacteriorhodopsin microcristales de un inyector micro-extrusión de alta viscosidad. La metodología se basa en la homogeneización de la muestra con un nuevo acoplador de tres vías y la visualización con una cámara de alta velocidad.
Resumen
Alta viscosidad micro-protuberancia inyectores han reducido dramáticamente el consumo muestra en serie femtosecond experimentos cristalográficos (SFX) en láseres de electrones libres de rayos x (XFELs). Una serie de experimentos utilizando el bacteriorhodopsin de bomba de protones impulsada por la luz más han establecido estos inyectores como una opción preferente para entregar cristales para Cristalografía de femtosegundo serial tiempo resuelto (TR-SFX) resolver los cambios estructurales de proteínas después de la fotoactivación. Para obtener múltiples copias instantáneas estructurales de alta calidad, es esencial para recoger grandes cantidades de datos y garantizar la separación de cristales entre cada pulso de láser de bomba. Aquí, describimos en detalle cómo hemos optimizado la extrusión de bacteriorhodopsin microcristales para nuestros experimentos recientes de TR-SFX en la fuente de luz coherente Linac (LCLS). El objetivo del método es optimizar la extrusión de un flujo estable y continuo manteniendo una alta densidad de cristales para aumentar la velocidad en que los datos pueden recogerse en un TR-SFX experimentar. Logramos este objetivo mediante la preparación de la fase cúbica lipídica con una distribución homogénea de cristales utilizando una jeringa de tres vías novedosa dispositivo seguido ajustando la composición de la muestra basada en medidas de la estabilidad de la protuberancia con una alta velocidad de enganche configuración de la cámara. La metodología puede adaptarse para optimizar el flujo de otros microcristales. La instalación estará disponible para los usuarios de las nuevas instalaciones de láser de electrón libre suizo.
Introducción
Femtosegundo serial Cristalografía (SFX) es una técnica de biología estructural que explota las propiedades únicas de láseres de electrones libres de rayos x (XFEL) para determinar estructuras de temperatura de miles de cristales de tamaño micrométrico y vencer la mayoría de el daño de la radiación por la "difracción antes de destrucción" principio1,2,3.
En una extensión de tiempo-resolved de SFX (TR-SFX), los pulsos de femtosegundo del XFEL se utilizan para estudiar cambios estructurales en las proteínas4,5. La proteína de interés se activa con un láser óptico (u otro disparador de la actividad) justo antes de ser baleado por el XFEL en una configuración de prueba de bomba. Precisamente controlando el retardo entre pulsos de bomba y sonda, la proteína diana puede ser capturada en diferentes Estados. Películas moleculares de cambios estructurales sobre once órdenes de magnitud en tiempo de demuestran el poder de las nuevas fuentes XFEL para estudiar la dinámica de varias proteínas objetivos6,7,8,9, 10,11,12,13. Principalmente, el método se une a las técnicas estructurales espectroscópicas y estáticas dinámicas en uno, proporcionando un vistazo en la dinámica de la proteína en cerca de resolución atómica.
Sistemas simples para TR-SFX pueden contener un activador endógeno de activación con un componente fotosensible como retina de bacteriorhodopsin (bR)9,10, cromóforos en fotosistema II12,13, proteínas fotoactivas amarillo (PEP)6,7 reversible fotoconmutables proteína fluorescente11, o el monóxido de carbono de un photolyzable en mioglobina8. Interesantes variaciones de la técnica todavía en desarrollo dependen de la mezcla e inyectan esquemas14,15 para estudiar reacciones enzimáticas o un campo eléctrico que se utiliza para inducir cambios estructurales16. Teniendo en cuenta que fuentes XFEL sólo han estado disponibles desde hace unos años y extrapolando más allá de los éxitos en el futuro, el método muestra potencial como un cambio real con respecto a nuestra comprensión de cómo función de las proteínas.
Porque las muestras biológicas se destruyen por una única exposición a una alta energía de pulso XFEL, nuevos enfoques a la cristalografía de proteínas fueron necesarios. Entre estos procedimientos, la capacidad de cultivar grandes cantidades de microcristales uniforme debían ser desarrollados17,18,19. Para habilitar la recopilación de datos en un XFEL, estos cristales deben ser entregados descarta y entonces renovados por cada pulso XFEL. Dado que XFELs fuego utilizables pulsos de 10-120 Hz, entrega de la muestra debe ser rápido, estable y confiable, manteniendo también a los cristales intacto y limitando el consumo. Entre las soluciones más exitosas es un inyector de micro-extrusión de alta viscosidad, que entrega un contínuamente streaming columna de temperatura ambiente cargado de cristal lipídica cúbico fase (LCP) en todo el pulsado de haz de rayos x20. Cristales orientados al azar, incrustados en la secuencia de la LCP, que son interceptados por la dispersión de pulsos XFEL rayos x en un detector donde se registra un patrón de difracción. LCP fue una elección natural para un medio de entrega de muestra como se utiliza con frecuencia como un medio de crecimiento de membrana proteína cristales17,21,22,23, otros medios de alta viscosidad del portador 24,25,26,27,28,29,30 y31 de proteínas solubles se han utilizado también en el inyector. SFX con el inyector de alta viscosidad ha sido exitosa durante la determinación de la estructura de la membrana proteínas13,32 incluyendo G proteína-juntó los receptores (GPCRs)33,34, 35,36,37, con la calidad de los datos suficiente para nativos fase38,39 mientras que tiempo y muestra eficiente. Actualmente, estos inyectores se utilizan más habitualmente para la medición de temperatura en sincrotrón fuentes28,30,40,41 , así como durante la más técnicamente exigiendo experimentos TR-SFX en XFELs9,10,13,42.
Experimentos de TR-SFX comparables se han realizado con otros tipos de inyector como fase líquida entrega un flujo enfocado boquilla6,7,12, sin embargo, este método requiere cantidades de proteínas no está disponibles para muchos objetivos biológicamente interesantes. Para la determinación de estructuras estáticas usando extrusión viscoso un consumo medio de 0,072 mg de proteína por patrones de difracción indexadas 10.000 en comparación con mg 9,35 para el chorro de líquido han divulgado los inyectores (es decir, alrededor de 130 veces más muestra eficiente)20. El inyector de alta viscosidad ha demostrado ser un dispositivo de entrega de muestra viable para TR-SFX mientras sólo sacrificar algunas de esta muestra eficacia43. En Nogly et al (2018)10, por ejemplo, consumo de muestra era alrededor de 1,5 mg por 10.000 patrones indexados, que compara favorable a experimentos similares de TR-SFX con el PEP que consumo de media de la muestra fue mucho mayor con 74 mg de proteína por cada 10.000 patrones indexadas6. Inyectores de alta viscosidad así tienen claras ventajas cuando es la limitación de la cantidad de proteína disponible o cristales se cultivan directamente en LCP.
Para TR-SFX con alta viscosidad inyectores para obtener los datos más confiables varias cuestiones técnicas deben abordarse: la velocidad de flujo debe permanecer por encima del valor crítico mínimo; la tasa de éxito debe mantenerse a un nivel que no recopilación de datos lenta (por ejemplo, más de 5%); y la muestra tiene que ser entregado sin interrupciones excesivas. Idealmente, estas condiciones se cumplen ya mucho antes de que un experimento de TR-SFX programado con tiempo disponible XFEL tan eficientemente como sea posible. Pricipally, una desaceleración en el flujo LCP puede permitir cristales que se activan con más de un pulso de láser óptico y resultar en Estados activos mixtos de sondeo o sondeo material bombeado cuando umpumped material se espera que en la viga. Un beneficio adicional de la prueba de inyección es que se reduce al mínimo tiempo de inactividad durante la recogida de datos en un XFEL tiempo relegado a sustitución de inyectores obstruidos, cambio de muestras no-extrudado, y otras tareas de mantenimiento se reduce.
Aquí, presentamos un método para optimizar la entrega de la muestra para la recolección de datos TR-SFX con un inyector micro-extrusión de alta viscosidad. Para simplificar, los métodos descritos no dependen del acceso a una fuente de rayos x, aunque trabajo en un sincrotrón línea29 ofrecerá más información sobre expectativas de tasa de éxitos y de difracción del cristal. Nuestros protocolos fueron desarrollados para optimizar los experimentos para capturar isomerización retiniana en la bomba de protones bacteriorhodopsin10 y se llevan a cabo en dos fases a partir de preparación de muestras de cristal para extrusión seguido de control de la extrusión usando una configuración de la cámara de alta velocidad. En primera fase, el LCP cargados de cristal se mezcla con LCP adicional, transición baja temperatura lípidos u otros aditivos para asegurar que la mezcla final es conveniente para la entrega en el entorno de muestra sin obstrucción o reducción. Un nuevo acoplador de la jeringuilla de tres vías fue desarrollado para mejorar la homogeneidad mezcla de rendimiento y de la muestra. La segunda fase consiste en una prueba de extrusión grabada por una cámara de alta velocidad para medir directamente la estabilidad de la velocidad de extrusión. Tras el análisis de los datos de vídeo, pueden hacer ajustes en el protocolo de preparación de muestra para mejorar los resultados experimentales. Estos procedimientos pueden ser adaptados para preparar otras proteínas para la recogida de datos TR-SFX, con modificaciones mínimas y contribuirán al uso eficiente del limitado XFEL beamtime. Con nuevas instalaciones XFEL, empezando su funcionamiento44,45 y la transferencia de métodos de recolección de datos en serie basado en el inyector a sincrotrones28,30,40,41 , los próximos años seguramente continuará brindando emocionantes nuevas penetraciones en la dinámica estructural de una gama cada vez más amplio de objetivos de proteína.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. preparación de la muestra de cristal de proteína
- 30 minutos antes de que la muestra va a ser inyectado, carga 50 μl de monoolein cargados de cristal base LCP en jeringa de 100 μl.
- Para la inyección a presión atmosférica: carga 10 μl de parafina líquida en la parte posterior de una segunda jeringa. Sosteniendo la jeringa verticalmente, expulsar las burbujas de aire de la jeringa.
- Para inyección en vacío ambiente: carga 5 μl de MAG 7.9 y 5 μl de parafina líquida en la parte posterior de una segunda jeringa. Sosteniendo la jeringa verticalmente, expulsar las burbujas de aire de la jeringa.
- Conectar la jeringa con parafina/MAG 7.9 a un acoplador de jeringa estándar, purgar el aire desde el acoplador presionando suavemente el émbolo hasta un pequeño volumen (< 1 μl) de parafina/lípidos es visible en la punta de la aguja del acoplador.
- Conecte la jeringa de muestra al acoplador de la jeringa, teniendo cuidado de no introducir aire en la muestra. Mezclar en el lípido/parafina pasando la muestra del material a través del acoplador varias veces.
- Carga 20 μl de premezclado LCP (27% PEG, 100 mM pH de Sorensen 5.6 + MO) en la otra jeringa de μl 100. Elimine las burbujas de aire en caso necesario.
- Retire la jeringa vacía desde el acoplador y coloque el LCP premezclado en el cristal que contiene la jeringa con un acoplador de jeringa estándar. Pasar la muestra por el acoplador 100 veces.
Nota: Muestra de mezcla puede calentarse la muestra levemente46. Mezcla debe realizarse a un ritmo lento donde la temperatura de la muestra puede ser considerada razonablemente constante. - Inspeccionar la muestra de transparencia contra una fuente de luz. Si se ha formado un LCP claro homogéneo, vaya al paso 1.9.
- Para traer la muestra en la fase cúbica, agregar 3 μl de monoolein y mezclar 50 veces (como se describe anteriormente). Repita este procedimiento hasta que se ha formado una fase transparente para evitar un exceso de monoolein.
Nota: La formación de la LCP es temperatura dependiente47 y se consiguen mejores resultados un poco por encima de 20 ° C. La cantidad de monoolein adicional necesarios dependerá del volumen de la solución precipitante residual de la cristalización. - Como paso preliminar prueba de rigidez de la muestra (como era de esperar de la fase LCP) y la capacidad de sacar, separar la jeringa vacía desde el acoplador de la jeringa y, sosteniendo la jeringa vertical, apriete una pequeña cantidad de muestra (< 2 μL) a través del acoplador. Si la muestra sacada forma un cilindro vertical, la muestra está lista para las pruebas de extrusión.
- Ajustar el volumen total de la muestra 100 μl añadiendo más premezclado LCP (como en el paso 1.5).
- Conecte la jeringa de muestra y dos jeringas de vacías para el acoplador de la jeringuilla de tres vías (purgar el aire desde el acoplador como antes). Mezcle por lo menos 50 veces (o hasta homogénea) pasando la mitad de la muestra en la segunda jeringa y luego presionando ambas mitades de la muestra en la tercera jeringa simultáneamente.
- Coloque la jeringa que contiene la mezcla muestra bajo un microscopio estéreo para verificar una distribución homogénea de cristales.
2. prueba de muestra de extrusión usando una configuración de la cámara de alta velocidad
- Determinación de parámetros experimentales.
- Seleccione el tamaño de la boquilla para la prueba.
Nota: Los tamaños de boquilla son típicamente 50 o 75 μm de diámetro interno (ID), pero cualquier tamaño de aproximadamente de 30-100 μm ID puede ser considerado. Selección se basa en un equilibrio entre tiempo de obstrucción media, dispersión de fondo, muestra consumo y tasa de éxito. - Calcular velocidad de flujo óptima basado en el tamaño del punto láser experimental (1/e2 de diámetro) y el esquema de la colección de datos (por ejemplo, intercalada luz y oscuridad) que se utilizarán en el XFEL.
- Calcular el índice de flujo deseado (
 ) de la muestra de la velocidad de flujo óptima (
) de la muestra de la velocidad de flujo óptima (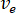 ) y el diámetro de la boquilla seleccionada (
) y el diámetro de la boquilla seleccionada (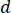 ):
):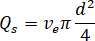
Determinar la tasa de flujo (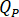 ) que deben introducirse en la bomba HPLC basada en el factor de amplificación (
) que deben introducirse en la bomba HPLC basada en el factor de amplificación (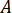 ) del inyector.
) del inyector.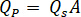
Calcular la presión máxima (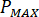 ) de la presión nominal de los accesorios de boquilla (
) de la presión nominal de los accesorios de boquilla (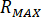 ) y el factor de amplificación del inyector (
) y el factor de amplificación del inyector (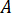 ):
):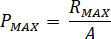
- Seleccione el tamaño de la boquilla para la prueba.
- Instalación del inyector de extrusión de alta viscosidad para uso sin conexión como se muestra en la figura 1.
Nota: Las funciones del inyector mediante extrusión hidráulica accionado por una bomba HPLC y utiliza una envoltura de gas helio Co flujo controlada por un regulador de gas. La instalación de la bomba y el regulador no se discuten en el presente Protocolo. Ver capítulo cuatro de James (2015)48 para un manual detallado.- Purgar la bomba y todas las líneas de agua para que el caudal de agua sean precisos. Purgar el escenario hidráulico del inyector.
- Montar el inyector (o la cámara) en una etapa de tres ejes para facilitar el encuadre y el enfoque de los vídeos de alta velocidad. Deje espacio alrededor del punto de inyección para la lente del objetivo, iluminación, pantalla y un vaso pequeño para coger la muestra gastada.
- Construir un "inyector simulado" (un embalse vacío con una boquilla de conexión) y lo instalamos en el inyector para facilitar el posicionamiento, enfoque y la iluminación.
- Montaje de la cámara de alta velocidad con la punta de la boquilla cerca del punto focal del objetivo.
- Coloque la pantalla reflectante detrás del inyector y ajustar la iluminación para luz delantera la boquilla.
- Encender y conectar a la cámara con el software suministrado. Con un video en vivo para la retroalimentación visual, coloque la punta de la boquilla en el centro del marco y ponerla en foco con la etapa de tres ejes.
- Ajuste la iluminación hasta que la boquilla es claramente visible y el fondo está iluminado uniformemente.
- Configuración de la cámara al grabar vídeo Time-lapse de alta velocidad.
- Set imágenes por segundo a 1000 fps. Establece la resolución a 512 x 512 píxeles.
- Con el tiempo de exposición fijado ahora por la velocidad de fotograma, ajustar el nivel de iluminación hasta que la boquilla es visible (es decir, no bajo- o sobreexpuestas). Vuelva a colocar la punta de la boquilla que está centrado de izquierda a derecha y se encuentra en el tercio superior del marco.
- Ejecutar cualquier corrección de fondo o las operaciones de balance de blancos.
- Configurar la cámara en el modo time-lapse. Intervalo de 30 s y repite 40 veces, ajuste el modo de disparo al azar (o reinicio al azar) y escriba el número de fotogramas para grabar a 1000.
- Cargar el tanque con 20 μl de la muestra y conecte la boquilla capilar.
- Coloque el depósito lleno al inyector. Conectar la tubería de gas en el puerto de la boquilla y empezar el flujo de gas.
- Avanzar manualmente el pistón de apertura de la válvula en línea y presionando la jeringa. Cierre la válvula cuando el pistón hace contacto sólido con la muestra en el depósito.
- Programa de la bomba con el caudal calculado y la presión máxima en el valor calculado (ver paso 2.1.3).
- Al mismo tiempo iniciar la bomba y la grabación de la cámara.
- Como comienza la extrusión, ajuste la presión de gas para aumentar la estabilidad. Aumentar la presión del gas si el líquido forma una gota en la punta de la boquilla en lugar de una columna. Disminución de la presión si la protuberancia se rompe debido a la excesiva del esquileo del flujo del gas, o es oscilante rápidamente (azotes).
- Supervisar la extrusión (10 minutos suele ser suficiente para reconocer una condición de flujo homogéneo) y, cuando la presión de la bomba rampas bruscamente hacia arriba cerca de la hora prevista, detener la grabación, apague la bomba y ventilar la presión del sistema abriendo la válvula de alivio.
- Análisis de los archivos de vídeo
Nota: Extrusión de muestra que es claramente insuficiente no requiere un análisis detallado. Sin embargo, es todavía útil para identificar el modo de falla para que la muestra puede ser optimizada.- Abra el archivo de vídeo con el software de análisis (por ejemplo, Fiji49) y calibrar las herramientas de medición.
- Calibrar las mediciones seleccionando una línea de longitud conocida en la imagen con la herramienta de selección de línea. Abrir la ventana Configurar escala via analizar | Establecer la escala e introduzca la distancia conocida y las unidades de medida.
Nota: El diámetro conocido de la boquilla proporciona una longitud de calibración adecuada para estas mediciones. - Encontrar un marco en el video donde hay una función de servicio visible (por ejemplo, un cristal) en la extrusión. Anotar el número de bastidor.
- Adelantar el video a un marco donde la misma característica es visible pero se ha movido desde su posición en el paso anterior. Anotar el número de bastidor.
- Utilizando la herramienta de medición de la línea recta, mida la distancia desde el principio de función y extremo por analizar | Medida.
Nota: Más larga es la distancia objeto de control, menos errores en la medida afectará los cálculos - Calcular la velocidad del jet de la distancia medida y el tiempo transcurrido (el número de fotogramas transcurridos dividido por la velocidad de fotogramas).
- Repita los pasos 2.11.3-2.11.6 un par de veces para cada segmento del video.
- Trama de la serie de datos como en la figura 2.
Access restricted. Please log in or start a trial to view this content.
Resultados
El material partido ideal para los procedimientos descritos aquí (figura 3) son altas densidades de microcristales incorporados en medio viscoso portador para el inyector. El procedimiento requiere aproximadamente 50 μl de portador cargado de cristal para cada preparación. Estos se puede cultivar directamente en LCP como con el bR9,10 utilizado aquí como ejemplo (figura 4
Access restricted. Please log in or start a trial to view this content.
Discusión
El método TR-SFX con el inyector de extrusión viscoso ha demostrado para ser una técnica viable para los estudios de la dinámica estructural de bacteriorhodopsin9,10 y fotosistema II13 y ahora parece dispuesto a estudiar las proteínas conduce a otro procesos biológicos de la foto transporte iónico basados en luz como percepción sensorial5,50. Los protocolos descritos anteri...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no declaran conflicto de intereses.
Agradecimientos
Reconocemos Gebhard Schertler, Rafael Abela y Chris Milne para apoyar el uso de inyectores de alta viscosidad a la PSI. Richard Neutze y su equipo son reconocidos por las discusiones sobre Cristalografía tiempo resuelto y entrega de la muestra utilizando inyectores de alta viscosidad. Apoyo financiero, reconocemos la Swiss National Science Foundation para becas de 31003A_141235, 31003A_159558 (a J.S.) y PZ00P3_174169 (a p). Este proyecto ha recibido financiación del programa de innovación bajo la concesión de Marie Sklodowska-Curie acuerdo No 701646 e investigación de horizonte 2020 de la Unión Europea.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Mosquito LCP Syringe Coupling | TTP labtech store | 3072-01050 | |
| Hamilton Syringe 1710 RNR, 100 µl | Hamilton | HA-81065 | |
| Hamilton Syringe 1750 RNR, 500 µl | Hamilton | HA-81265 | |
| Monoolein | Nu-Chek Prep, Inc. | M-239 | |
| 7.9 MAG | Avanti Polar Lipids Inc. | 850534O | |
| 50% w/v PEG 2000 | Molecular Dimensions | MD2-250-7 | |
| Paraffin (liquid) | Sigma-Aldrich | 1.07162 | |
| High speed camera | Photron | Photron Mini AX | |
| High magnification lens | Navitar | 12X Zoom Lens System | |
| Three axis stage | ThorLabs | PT3/M | |
| Fiber light | Thorlabs | OSL2 | |
| Fused silica fiber | Molex/Polymicro | TSP-505375 | |
| Lite touch ferrule | IDEX | LT-100 | |
| ASU high viscosity injector | Arizona State University | Purchasable from Uwe Weierstall (weier@asu.edu) | |
| HPLC pump | Shimadzu | LC-20AD | |
| Electronic gas regulator | Proportion Air | GP1 |
Referencias
- Neutze, R., Wouts, R., van der Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Barty, A., et al. Self-terminating diffraction gates femtosecond X-ray nanocrystallography measurements. Nature photonics. 6 (December), 35-40 (2012).
- Aquila, A., et al. Time-resolved protein nanocrystallography using an X-ray free-electron laser. Optics express. 20 (3), 2706-2716 (2012).
- Panneels, V., et al. Time-resolved structural studies with serial crystallography: A new light on retinal proteins. Structural Dynamics. 2 (4), 041718(2015).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Pande, K., et al. Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein. Science (New York, N.Y.). 352 (6286), 725-729 (2016).
- Barends, T. R. M., et al. Direct observation of ultrafast collective motions in CO myoglobin upon ligand dissociation. Science (New York, N.Y.). 350 (6259), 445-450 (2015).
- Nango, E., et al. A three-dimensional movie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Nogly, P., et al. Retinal isomerization in bacteriorhodopsin captured by a femtosecond x-ray laser. Science. 0094 (June), eaat0094 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2017).
- Kupitz, C., et al. Serial time-resolved crystallography of photosystem II using a femtosecond X-ray laser. Nature. , (2014).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Stagno, J. R., et al. Structures of riboswitch RNA reaction states by mix-and-inject XFEL serial crystallography. Nature. 541 (7636), 242-246 (2017).
- Wang, D., Weierstall, U., Pollack, L., Spence, J. C. H. Liquid Mixing Jet for XFEL Study of Chemical Kinetics. Journal of synchrotron radiation. , In submiss 1364-1366 (2014).
- Hekstra, D. R., White, K. I., Socolich, M. A., Henning, R. W., Šrajer, V., Ranganathan, R. Electric-field-stimulated protein mechanics. Nature. 540 (7633), 400-405 (2016).
- Liu, W., Ishchenko, A., Cherezov, V. Preparation of microcrystals in lipidic cubic phase for serial femtosecond crystallography. Nature. 9 (9), 2123-2134 (2014).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 369 (1647), (2014).
- Falkner, J. C., et al. Generation of Size-Controlled, Submicrometer Protein Crystals. Chemistry of Materials. 17 (10), 2679-2686 (2005).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature communications. 5, 3309(2014).
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: a novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (December), 14532-14535 (1996).
- Caffrey, M. A comprehensive review of the lipid cubic phase or in meso method for crystallizing membrane and soluble proteins and complexes. Acta Crystallographica Section F Structural Biology Communications. 71 (1), 3-18 (2015).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Current Opinion in Structural Biology. 21 (4), 559-566 (2011).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (4), 421-430 (2015).
- Sugahara, M., et al. Hydroxyethyl cellulose matrix applied to serial crystallography. Scientific Reports. 7 (1), 703(2017).
- Sugahara, M., et al. Grease matrix as a versatile carrier of proteins for serial crystallography. Nature Methods. 12 (1), 61-63 (2014).
- Sugahara, M., et al. Oil-free hyaluronic acid matrix for serial femtosecond crystallography. Scientific Reports. 6 (1), 24484(2016).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Kovácsová, G., et al. Viscous hydrophilic injection matrices for serial crystallography. IUCrJ. 4 (4), 400-410 (2017).
- Martin-Garcia, J. M., et al. Serial millisecond crystallography of membrane and soluble protein microcrystals using synchrotron radiation. IUCrJ. 4 (4), 439-454 (2017).
- Fromme, R., et al. Serial femtosecond crystallography of soluble proteins in lipidic cubic phase. IUCrJ. 2, 545-551 (2015).
- Caffrey, M., Li, D., Howe, N., Shah, S. T. A. "Hit and run" serial femtosecond crystallography of a membrane kinase in the lipid cubic phase. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130621(2014).
- Liu, W., et al. Serial femtosecond crystallography of G protein-coupled receptors. Science (New York, N.Y.). 342 (6165), 1521-1524 (2013).
- Zhang, H., et al. Structure of the Angiotensin Receptor Revealed by Serial Femtosecond Crystallography. Cell. 161 (4), 833-844 (2015).
- Fenalti, G., et al. Structural basis for bifunctional peptide recognition at human δ-opioid receptor. Nature Structural & Molecular Biology. (February), (2015).
- Kang, Y., et al. Crystal structure of rhodopsin bound to arrestin by femtosecond X-ray laser. Nature. 523 (7562), 561-567 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and Delivery of Protein Microcrystals in Lipidic Cubic Phase for Serial Femtosecond Crystallography. Journal of Visualized Experiments. 9 (115), 2123-2134 (2016).
- Batyuk, A., et al. Native phasing of x-ray free-electron laser data for a G protein-coupled receptor. Science Advances. 2 (9), e1600292(2016).
- Nakane, T., et al. Native sulfur/chlorine SAD phasing for serial femtosecond crystallography. Acta Crystallographica Section D Biological Crystallography. 71 (12), 2519-2525 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542(2017).
- Tosha, T., et al. Capturing an initial intermediate during the P450nor enzymatic reaction using time-resolved XFEL crystallography and caged-substrate. Nature Communications. 8 (1), 1585(2017).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314(2016).
- Abela, R., et al. Perspective: Opportunities for ultrafast science at SwissFEL. Structural Dynamics. 4 (6), 061602(2017).
- Marx, V. Structural biology: doors open at the European XFEL. Nature Methods. 14 (9), 843-846 (2017).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chemistry and Physics of Lipids. 95 (1), 11-21 (1998).
- Qiu, H., Caffrey, M. The phase diagram of the monoolein/water system: Metastability and equilibrium aspects. Biomaterials. 21 (3), 223-234 (2000).
- James, D. Injection Methods and Instrumentation for Serial X-ray Free Electron Laser Experiments. , (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Moffat, K. Femtosecond structural photobiology. Science (New York, N.Y.). 361 (6398), 127-128 (2018).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados