Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método paso a paso para detectar anticuerpos neutralizantes contra AAV utilizando un ensayo colorimétrico basado en células
En este artículo
Resumen
Se describe un protocolo de laboratorio completo y un flujo de trabajo de análisis para un ensayo basado en células colorimétricas rápidas, rentables y sencillas para detectar elementos neutralizantes contra AAV6.
Resumen
Los virus adenoasociados recombinantes (rAAV) han demostrado ser un vector seguro y exitoso para transferir material genético para tratar diversas afecciones de salud tanto en el laboratorio como en la clínica. Sin embargo, los anticuerpos neutralizantes preexistentes (NAbs) contra las cápsides AAV plantean un desafío continuo para la administración exitosa de terapias génicas tanto en modelos experimentales de animales grandes como en poblaciones humanas. El cribado preliminar de la inmunidad del huésped contra el AAV es necesario para garantizar la eficacia de las terapias génicas basadas en el AAV como herramienta de investigación y como agente terapéutico clínicamente viable. Este protocolo describe un ensayo colorimétrico in vitro para detectar factores neutralizantes frente al serotipo 6 de AAV (AAV6). El ensayo utiliza la reacción entre un AAV que codifica un gen reportero de fosfatasa alcalina (AP) y su sustrato NBT / BCIP, que genera una mancha púrpura cuantificable insoluble al combinarse.
En este protocolo, las muestras de suero se combinan con un AAV que expresa AP y se incuban para permitir que ocurra una posible actividad neutralizante. La mezcla de suero de virus se agrega posteriormente a las células para permitir la transducción viral de cualquier AAV que no haya sido neutralizado. Se añade el sustrato NBT/BCIP y sufre una reacción cromogénica, correspondiente a la transducción viral y a la actividad neutralizante. La proporción de área coloreada se cuantifica utilizando una herramienta de software libre para generar títulos neutralizantes. Este ensayo muestra una fuerte correlación positiva entre la coloración y la concentración viral. La evaluación de muestras de suero de ovejas antes y después de la administración de un AAV6 recombinante condujo a un aumento dramático en la actividad neutralizante (aumento de 125 a >10,000 veces). El ensayo mostró una sensibilidad adecuada para detectar actividad neutralizante en diluciones séricas > 1:32.000. Este ensayo proporciona un método simple, rápido y rentable para detectar NAbs contra AAV.
Introducción
Los virus adenoasociados (AAV) se utilizan cada vez más como vectores para la administración de terapias génicas para probar tratamientos para diversas afecciones de salud que afectan los sistemas cardiovascular, pulmonar, circulatorio, ocular y nervioso central1,2,3,4,5. La popularidad de los vectores AAV como plataforma líder de terapia génica se deriva de su perfil de seguridad positivo, la expresión transgénica a largo plazo y los tropismos específicos de tejidos de amplio alcance1,6. Los resultados exitosos en estudios con animales han allanado el camino para más de cincuenta ensayos clínicos de terapia génica AAV que han alcanzado con éxito sus criterios de valoración de eficacia7, así como el lanzamiento del primer medicamento de terapia génica AAV disponible comercialmente aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos8. Tras los éxitos iniciales, AAV ha seguido ganando terreno en los sectores de investigación básica y clínica como vector de elección y actualmente es la única terapia génica in vivo aprobada para uso clínico en los Estados Unidos y Europa9. No obstante, la presencia de anticuerpos neutralizantes preexistentes (NAbs) contra las cápsides del vector AAV sigue siendo un obstáculo tanto para la investigación preclínica como para la eficacia de los ensayos clínicos. Los NAbs están presentes tanto en poblaciones humanas como animales ingenuas e inhiben la transducción de genes después de la administración in vivo de un vector AAV1. La seropositividad al AAV es un criterio de exclusión para la mayoría de los ensayos de terapia génica y, por lo tanto, la detección preliminar de la inmunidad del huésped es crucial tanto en el laboratorio como en la clínica. Establecer un ensayo que pueda detectar la presencia de NAbs contra AAV es un paso esencial en la tubería de cualquier proyecto de investigación basado en la terapia génica AAV. Este informe se centra en el AAV6 que ha sido de interés para los investigadores debido a su transducción eficiente y selectiva en el músculo estriado (corazón y músculo esquelético)1,10,11,12. La terapia génica se considera una estrategia prometedora para dirigirse al corazón porque es difícil dirigirse específicamente al corazón sin procedimientos invasivos a corazón abierto.
La actividad neutralizante generalmente se determina utilizando un ensayo de inhibición de la transducción in vitro o in vivo basado en células. In vivo Los ensayos de NAb generalmente implican la administración de suero de un sujeto de prueba (por ejemplo, humano o animal grande) en ratones, seguido de un AAV con un gen reportero, seguido de pruebas para la expresión del gen reportero o antígeno correspondiente. Los ensayos in vitro determinan los títulos de NAb incubando suero o plasma de un humano o animal grande en diluciones seriadas con un AAV recombinante (rAAV) que expresa un gen reportero. Las células están infectadas con la mezcla de suero /virus, y se evalúa el grado en que se inhibe la expresión génica del informador en comparación con los controles. Los ensayos in vitro son ampliamente utilizados para el cribado de NAb debido a su costo comparativamente menor, rapidez en las pruebas y mayor capacidad de estandarización y validación13,14 en comparación con los ensayos in vivo. A menudo se ha informado que los ensayos in vivo tienen mayor sensibilidad15,16, pero lo mismo se ha hecho con respecto a los ensayos in vitro14,17.
Hasta la fecha, los ensayos in vitro de NAb han utilizado principalmente la luminiscencia (luciferasa) como gen reportero para detectar la neutralización. Aunque un método basado en la luz tiene mérito en muchos contextos, un ensayo de NAb colorimétrico / cromogénico puede ser ventajoso en algunas circunstancias. Los ensayos colorimétricos para evaluar la neutralización se han empleado con éxito para otros virus como la influenza y el adenovirus18,19. Su atractivo se deriva de su simplicidad, menor costo y la necesidad de solo aparatos y herramientas de laboratorio cotidianos20. Los ensayos de NAb que utilizan un gen reportero basado en luminiscencia requieren costosos kits de sustrato, un luminómetro y el software correspondiente para el análisis21. Este ensayo colorimétrico tiene la ventaja de que solo requiere un microscopio de luz y un sustrato muy barato. El informe de la sensibilidad de los ensayos colorimétricos frente a los luminiscentes ha arrojado resultados contradictorios. Un estudio sugirió que los ensayos ELISA basados en luminiscencia muestran una mayor sensibilidad y reproducibilidad comparable a los ensayos colorimétricos22, mientras que otro encontró que los ensayos ELISA basados en colorimetría confieren una mayor sensibilidad23. Aquí, se proporciona un protocolo detallado para un ensayo in vitro de NAb contra AAV que utiliza la reacción cromogénica entre un AAV que codifica un gen reportero de fosfatasa alcalina (AP) y un sustrato de tetrazolio azul nitro / 5-bromo-4-cloro-3-fosfato de indolilo (NBT / BCIP). Este protocolo paso a paso se desarrolló en base a un informe anterior que utilizó un gen reportero hPLAP (fosfatasa alcalina placentaria humana) (AAV6-hPLAP) para detectar la actividad neutralizante contra AAV24. Este ensayo es rentable, eficiente en el tiempo, fácil de configurar y requiere habilidades técnicas mínimas, equipos de laboratorio y reactivos. Además, la simplicidad de este ensayo le da el potencial de ser optimizado para aplicaciones amplias en diferentes tipos de células, tejidos o serotipos virales.
Protocolo
Todos los aspectos del cuidado y la experimentación de animales se llevaron a cabo siguiendo las directrices del Instituto Florey de Neurociencia y Salud Mental y el Código Australiano para el Cuidado y Uso de Animales con Fines Científicos siguiendo la Referencia25. Para el estudio se utilizaron ovejas Merino de 1,5 a 3 años. En la Figura 1 se proporciona una descripción general esquemática del protocolo de ensayo.
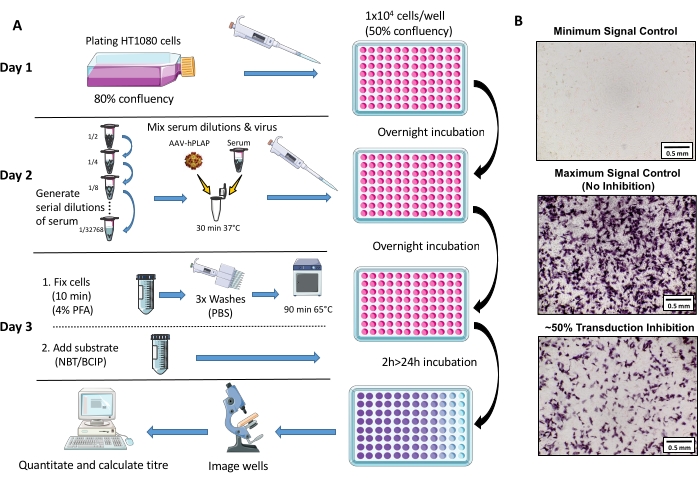
Figura 1: Diagrama esquemático del protocolo de ensayo NAb. (A) Representación visual del ensayo NAb que ilustra los pasos principales involucrados en el protocolo de tres días. Brevemente, las células se cultivan y se enchapan durante la noche. Al día siguiente, se preparan diluciones seriadas de suero, se incuban con AAV y luego se incuban con las células durante la noche. Al día siguiente, las células se fijan, se lavan, se incuban, se combinan con el sustrato y se incuban nuevamente, seguidas de imágenes y cuantificación. (B) Imágenes representativas de un control mínimo de la señal (inhibición completa de AAV), un control máximo de la señal (sin inhibición) y una muestra de suero ovino con ~ 50% de inhibición de la señal. Barra de escala = 0.5 mm. Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación inicial
- Para la evaluación en ovejas: recolectar sangre en tubos activadores de coágulos separadores de suero de 8 ml (ver Tabla de materiales), dejar la muestra de sangre a temperatura ambiente (RT) durante 20-30 min, y posteriormente girar hacia abajo a 2.100 x g durante 15 min. El sobrenadante transparente que se forma en la parte superior de los tubos es el suero. Alícuota la fase acuosa clara en tubos de microcentrífuga y guárdela a -80 °C.
NOTA: El suero a -80 °C permanece estable durante ~5 años. La sangre se recogió de la vena carotídea utilizando una aguja de 16 G (corte de punta) y una jeringa de animales conscientes. - Inactive con calor el suero fetal bovino (FBS) colocándolo en un baño de agua a 56 °C durante 30 min y girando intermitentemente. Para mayor precisión, coloque un termómetro en una segunda botella que contenga un volumen equivalente de agua y agréguelo al baño de calor al mismo tiempo que la botella FBS. Comience a cronometrar cuando el termómetro alcance los 56 °C.
- Emplear la técnica aséptica adecuada y la práctica del cultivo celular para todos los pasos posteriores realizados en la campana de cultivo celular26,27. Rocíe etanol al 70% en todos los objetos y la campana antes de usarlo y limpie con hipoclorito de sodio al 1% al finalizar.
- Complete el Medio Águila Modificada (DMEM) de Dulbecco combinando DMEM alto en glucosa (4.5 g / L) (89%) con FBS inactivado por calor (10%) y Estreptomicina de Penicilina (1%). Combine y filtre utilizando un sistema de filtración al vacío estéril (tamaño de poro de 0,22 μm, membrana de polietersulfona) (consulte la Tabla de materiales). Guarde el DMEM completo envuelto en papel de aluminio a 4 °C.
- Establecer celdas HT1080 (ver Tabla de Materiales) y pasaje en un matraz cuadrado de 75 cm2 como se describe en la Referencia28. Cree múltiples existencias congeladas de células. No use células después de 20 pasajes, ya que un pasaje adicional puede influir en los resultados del ensayo.
2. Día 1 - Chapado de células
- Pasa las células HT1080 cuando alcanzan ~80% de confluencia.
- DMEM completo precalentado (preparado en el paso 1.4), tripsina-EDTA al 0,05% y solución salina tamponada con fosfato (PBS) a 37 °C en un baño de agua. Retire el medio de crecimiento de las células pasajeras utilizando un sistema de aspiración.
NOTA: Toda aspiración en este protocolo utiliza un sistema de vacío con un tubo conectado a una pipeta serológica estéril de 5 ml. - Lave las células en 10 ml de PBS precalentado (37 °C) 1x y tripsinize las células durante 3-4 min en 4 ml de tripsina-EDTA al 0,05% precalentado para separar las células del matraz.
- Inactive la tripsina agregando 6 ml de DMEM completo precalentado y pipetee las células en un tubo de 50 ml. Calcular el número y la concentración de células viables utilizando un hemocitómetro y el método de exclusión del azul tripano29.
- Diluya las células a una concentración de 1 x 105 células/ml en DMEM completo precalentado. Sembrar 100 μL de células/pozo en placas transparentes de fondo plano de 96 pocillos (1 x 104 células por pozo). Incubar la placa a 37 °C, 5% de dióxido de carbono (CO2) durante la noche durante 16-22 h.
3. Día 2 - Infectar las células
- Retire la placa / s de la incubadora y use un microscopio de luz para confirmar que las células están dispersas uniformemente dentro de los pozos y que la confluencia es de ~ 50%. Si las células no están dentro de un rango de confluencia del 45% al 55%, repita el protocolo 'Día 1' y ajuste la concentración celular inicial en consecuencia.
- Generar diluciones seriadas de las muestras de suero de interés en tubos de microcentrífuga de 1,5 mL utilizando DMEM completo precalentado como diluyente. La Tabla 1 muestra la generación de una cascada de dilución para muestras triplicadas.
- Para realizar el ensayo por triplicado, preparar un 7,5 x 106 genomas vectoriales (vg)/μL de solución de trabajo de AAV6-hPLAP (ver Tabla de Materiales) diluyendo una solución madre de virus en 1x PBS.
- Añadir 66 μL de la solución de trabajo del virus 7,5 x 106 vg/μL a cada tubo que contenga 264 μL de dilución sérica/media (330 μL de volumen total/dilución, véase la Tabla 1).
NOTA: Este es un ensayo robusto que no requiere condiciones de cultivo perfectas. Sin embargo, para cuantificar con precisión y garantizar que cada ejecución de ensayo sea confiable, es necesario incluir lo siguiente: (1) un control solo de virus y medios, (2) un control solo de medios y (3) una muestra de control positivo de NAb en todas las placas bajo las mismas condiciones experimentales. El volumen descrito (330 μL) representa muestras triplicadas +10% de la mezcla de suero y virus. La realización de réplicas es muy recomendable para la determinación precisa de la actividad neutralizante.
- Mezcle las diluciones de virus/ suero mediante pipeteo y coloque los tubos que contienen las mezclas de virus / suero en una incubadora a 37 ° C, 5% de CO2 durante 30 minutos para permitir que se produzca una posible neutralización.
- Pipetear 100 μL de la mezcla virus/suero a cada pocillo en la placa de 96 pocillos que contiene 1 x 104 células/pocillo para cada dilución.
NOTA: Esto generará una concentración viral final de 15k virus/multiplicidad celular de infección (MOI) en cada pozo. La Tabla 2 proporciona un ejemplo de diseño de placa de muestra de 96 pocillos para evaluar muestras a una dilución de 1/512. - Envuelva la placa de 96 pocillos que contiene células, suero y AAV-hPLAP en papel de aluminio y colóquela en una incubadora a 37 ° C, 5% de CO2 durante la noche durante 16-24 h para permitir la entrada de AAV en las células.
| Etiqueta en cascada de dilución | Dilución | 3 x muestra (240 μL) + 10% de volumen tampón (24 μL) | Relación de suero:medios |
| Dilución 1 (D1) | 1/2 | 264 μL séricos 264 μL medios | 50:50 |
| Dilución 2 (D2) | 1/4 | 264 μL D1 + 264 μL de medios | 25:75 |
| Dilución 3 (D3) | 1/8 | Medios de 264 μL D2 +264μL | 12.5:87.5 |
| Dilución 4 (D4) | 1/16 | 264 μL D3 +264 μL medios | 6.25:93.75 |
| Dilución 5 (D5) | 1/32 | 264 μL D4 +264 μL medios | 3.13:96.87 |
| Dilución 6 (D6) | 1/64 | 264 μL D5 +264 μL medios | 1.56:98.44 |
| Dilución 7 (D7) | 1/128 | 264 μL D5 +264 μL medios | 0.78:99.22 |
| Dilución 8 (D8) | 1/256 | 264 μL D5 +264 μL medios | 0.39:99.61 |
| Dilución 9 (D9) | 1/512 | 264 μL D7 + 264 μL de medios | 0.2:99.8 |
| Dilución 10 (D10) | 1/2048 | 132 μL D8 + 396 μL de medios | 0.05:99.95 |
| Dilución 11 (D11) | 1/8192 | 132 μL D9 + 396 μL de medios | 0.01:99.99 |
| Dilución 12 (D12) | 1/32768 | 132 μL D10 + 396 μL de medios | 0.003:99.997 |
Tabla 1: Volúmenes de suero y diluyente necesarios para generar diluciones seriadas de suero por triplicado.
| Muestra de suero #1 | Muestra de suero #2 | Muestra de suero #3 | Mono AB (mAB), controles y muestras adicionales | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Un | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 ng MAb | 50 ng MAb | 50 ng MAb |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 ng MAb | 5 ng MAb | 5 ng MAb |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0,5 ng MAb | 0,5 ng MAb | 0,5 ng MAb |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | Muestra #1 1/512 | Muestra #1 1/512 | Muestra #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | Muestra #2 1/512 | Muestra #2 1/512 | Muestra #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | Muestra #3 1/512 | Muestra #3 1/512 | Muestra #3 1/512 |
Tabla 2: Ejemplo de diseño de placa de 96 pocillos para evaluar muestras de suero naïve en diluciones que van de 1/2 a 1/512. Las diluciones más altas se incorporan al ensayo si se evalúa una muestra que se sabe que es positiva para AAV NAbs (muestras posteriores a la administración) o si se requiere un título más alto. MO (-C): Control solo de medios. VO (+C): Control exclusivo de virus y medios. mAb: Anticuerpo monoclonal contra AAV (NAb positive control).
4. Día 3 - Fijación y adición de sustrato a las células
- Precaliente una alícuota de 1x PBS a 37 °C (~25 mL/placa de 96 pocillos). Enfríe las alícuotas separadas de PBS (placa de ~25 mL/96-pocillos) y H2O de doble destilación (DDW, ~25 mL/96-well plate) a 4 °C. Disolver un pellet de BCIP/NBT (ver Tabla de Materiales) en 10 mL de DDW en un tubo de centrífuga cónica de 50 mL por vórtice (10 mL es suficiente para 2 x 96 placas de pozo).
- Aspire los medios de los pocillos de la placa de 96 pocillos utilizando una pipeta serológica o similar unida a un sistema de aspiración basado en succión o al vacío de campana de humos. Coloque suavemente la punta de la pipeta serológica en el pozo y retire los medios teniendo cuidado de no interrumpir las células adheridas.
- Añadir 50 μL de RT 4% PFA a cada pocillo usando una pipeta. Envuelva la placa en papel de aluminio y déjela en RT durante 10 minutos para fijar las células.
PRECAUCIÓN: El paraformaldehído (PFA) es un probable carcinógeno y es tóxico por contacto con la piel o los ojos o por inhalación. Manipule en una campana extractora de humos con el equipo de protección personal adecuado, así como una máscara facial. Haga PFA fresco al 4% diluido en PBS (~ 7 ml requeridos por placa de 96 pocillos).
- Añadir 50 μL de RT 4% PFA a cada pocillo usando una pipeta. Envuelva la placa en papel de aluminio y déjela en RT durante 10 minutos para fijar las células.
- Lavar y aspirar las células con 200 μL de RT 1x PBS. Repita este paso dos veces.
NOTA: Una pipeta multicanal es una opción eficiente para los pasos de pipeteo. - Pipetear 200 μL de PBS precalentado en cada pozo, envolver la placa en papel de aluminio e incubar a 65 °C durante 90 min para desnaturalizar la actividad de la fosfatasa alcalina endógena30.
- Aspirar pocillos y lavar celdas con 200 μL de PBS frío (4 °C). Aspire de nuevo, lave en 200 μl de DDW frío y aspire de nuevo.
- Pipetear 50 μL del BCIP/NBT disuelto (preparado en la etapa 4.1) en cada pozo.
- Envuelva la placa en papel de aluminio e incube en RT durante 2-24 h.
NOTA: Sea consistente con el tiempo de incubación entre carreras; la flexibilidad horaria permite a los usuarios fotografiar pozos el día 3 o al día siguiente. - Usando una cámara de microscopio de luz, tome fotos de cada pozo usando una lente de objetivo 4x, asegurando que la misma exposición, equilibrio de blancos y configuraciones de luz se usen de manera consistente para todos los ensayos realizados.
- Coloque cada pozo de manera idéntica y asegúrese de que los bordes del pozo no sean visibles en las fotos. Guarde fotos en formato TIF o similar.
NOTA: Los ajustes específicos variarán entre los microscopios, pero la cuantificación será más efectiva si la iluminación de fondo es alta y consistente en todos los pozos (Figura 1B).
- Coloque cada pozo de manera idéntica y asegúrese de que los bordes del pozo no sean visibles en las fotos. Guarde fotos en formato TIF o similar.
5. Cuantificación para determinar la actividad neutralizante utilizando ImageJ
- Descargue e instale el software disponible gratuitamente "ImageJ" (consulte la Tabla de materiales).
- Abra la imagen que se va a analizar en ImageJ seleccionando Archivo > Abrir (Figura 2).
- Si utiliza imágenes de color, conviértalas a escala de grises seleccionando > Tipo de imagen > 8 bits.
- Haga clic en Imagen > Ajustar > umbral. Ajuste el umbral hasta que todas las áreas de color estén coloreadas en rojo, pero el fondo no lo esté. Al agregar NBT / BCIP, el producto coloreado se depositará en el área alrededor de las células que expresan hPLAP.
NOTA: Se recomienda utilizar la misma configuración de umbral para todas las imágenes capturadas en la misma placa. - Haga clic en Analizar > Establecer medidas y marque las casillas de verificación Área, Límite a umbral, Fracción de área y Etiqueta de pantalla y haga clic en Aceptar.
- Para determinar la lectura de la señal (porcentaje de coloración) de un pozo determinado, haga clic en Analizar > medir. La columna '% Área' de la ventana emergente muestra la lectura de la señal.
- Realice la cuantificación de todas las réplicas de muestra. Excluya cualquier pozo contaminado, pozos que muestren una distribución celular desigual o pozos que varíen en densidad celular o iluminación.
NOTA: Consulte la Figura suplementaria 1 para ver ejemplos de pozos que deben considerarse para la exclusión. Por lo general, 3-4 pozos pueden requerir la exclusión de una placa de 96 pocillos. La Figura 2 proporciona una representación visual del proceso de cuantificación utilizando ImageJ.
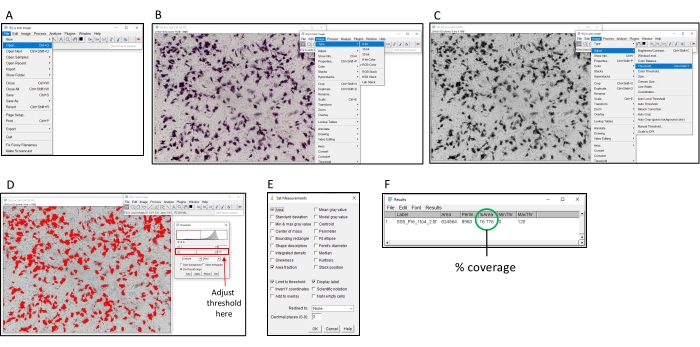
Figura 2: Pasos para determinar el porcentaje de coloración utilizando el software ImageJ. (A) Abra la imagen a analizar con el software ImageJ. (B) Convierta la imagen a escala de grises de 8 bits. (C) Abra la ventana de umbral. (D) Ajuste el umbral máximo para que todas las áreas de color estén cubiertas, pero el área de fondo no lo esté (este umbral debe ser consistente en toda una placa). (E) Seleccione el dropbox 'Analizar', haga clic en 'Establecer mediciones' y marque 'Área', 'Fracción de área', 'Umbral de límite' y 'Mostrar etiqueta', y haga clic en 'Aceptar'. (F) Haga clic en "Medir" para medir el área cubierta. El área % indica la proporción de la imagen que se coloreó. Esto se puede utilizar con las muestras de control para determinar el título TI50 . Haga clic aquí para ver una versión más grande de esta figura.
6. Determinación del título de inhibición de la transducción (TI50)
- Determine la lectura promedio de las réplicas (mediante los pasos descritos en el paso 5) para lo siguiente: (1) Control solo de medios (lectura de señal de línea de base). (2) Virus + control solo de medios (lectura máxima de la señal). (3) Virus + muestras de suero de interés.
- Calcule el porcentaje de inhibición utilizando la siguiente fórmula:
100 - [(Lectura de la señal de la muestra de prueba (virus + muestra sérica de interés) - lectura de la señal basal (control solo de medios)) / (lectura máxima de la señal (solo medios y virus) - lectura de la señal basal) x 100] = % Inhibición de la transducción13. - Calcule el % de inhibición de la transducción de todas las réplicas de cada dilución para todas las muestras utilizando la fórmula de 6.2. Determinar la inhibición media de la transducción entre las réplicas técnicas para cada dilución para todas las muestras y controles.
- Calcule el título de inhibición de la transducción del 50% (título TI50 ) de una muestra de interés determinando la dilución más baja de la muestra que produce una inhibición de la transducción del 50% o más de la actividad hPLAP. por ejemplo, si una dilución de 1/8 de una muestra tiene una inhibición de la transducción superior al 50% basada en el cálculo realizado en 6.2 (y una dilución de 1/4 no), informe el título TI50 como 1/8.
7. Determinación de partículas AAV neutralizadas
- Calcule el número de partículas AAV neutralizadas por μL de suero para una muestra dada empleando la siguiente fórmula:
((MOI x recuento de células/pozo) / (volumen de suero / factor de dilución del título TI50 )) / 2 = partículas AAV neutralizadas / μL de suero9.
NOTA: Dividiendo por 2 se contabiliza el TI50 midiendo el 50% de las partículas neutralizadas. Para una muestra que da un título TI50 de 1/4 (25% sérico, 75% diluyente) en el que el ensayo utilizó 80 μL de suero sin diluir y un MOI de 15k chapado en 1 x 104 células, se utilizaría el siguiente cálculo: ((15000 x 10000) / (80/4)) / 2 = 3.75x106d partículas neutralizadas / μL de suero.
Resultados
Ensayo de transducción para establecer la dosis viral óptima para la cobertura de la placa
Las células HT1080, una línea celular de fibrosarcoma bien establecida, fueron seleccionadas para este ensayo. Una concentración de 1 x 104 células/pozo HT1080 proporcionó ~50% de confluencia celular en cada pocillo de una placa de 96 pocillos. Para determinar la concentración viral óptima para el ensayo, se agregó un rAAV que codifica un gen reportero hPLAP (fosfatasa alcalina placentaria h...
Discusión
Este informe describe un ensayo colorimétrico que evalúa el grado de neutralización de AAV en una muestra de suero dada mediante la evaluación de una reacción cromogénica correspondiente al grado de transducción viral in vitro. El desarrollo del protocolo se basó en la conocida reacción cromogénica entre la enzima fosfatasa alcalina y NBT/BCIP, que ha sido ampliamente utilizada como herramienta de tinción para la detección de dianas proteicas en aplicaciones como la inmunohistoquímica y como herrami...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue financiado por una subvención del Proyecto del Consejo Nacional de Salud e Investigación Médica a JRM y CJT (ID 1163732) y en parte por el Programa de Apoyo de Infraestructura Operativa del Gobierno de Victoria. SB cuenta con el apoyo de una beca doctoral conjunta baker heart and diabetes Institute-La Trobe University. KLW cuenta con el apoyo de The Shine On Foundation y una beca Future Leader Fellowship de la National Heart Foundation of Australia (ID 102539). JRM cuenta con el apoyo de una beca de investigación sénior del Consejo Nacional de Salud e Investigación Médica (ID 1078985).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
Referencias
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados