Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación de la eficacia de los peroxiácidos orgánicos para la erradicación de biofilms lácteos utilizando un enfoque que combina métodos estáticos y dinámicos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un enfoque que combina métodos estáticos y dinámicos para evaluar la eficacia de los peroxiácidos orgánicos para erradicar las biopelículas en la industria láctea. Este enfoque también se puede utilizar para probar la eficacia de nuevas formulaciones biológicas o químicas para controlar las biopelículas.
Resumen
La presencia de biopelículas en la industria láctea es motivo de gran preocupación, ya que pueden conducir a la producción de productos lácteos inseguros y alterados debido a su alta resistencia a la mayoría de los procedimientos de limpieza in situ (CIP) utilizados con frecuencia en las plantas de procesamiento. Por lo tanto, es imperativo desarrollar nuevas estrategias de control de biopelículas para la industria láctea. Este protocolo tiene como objetivo evaluar la eficacia de los peroxiácidos orgánicos (ácidos peracético, perpropiónico y perláctico y un desinfectante comercial a base de ácido peracético) para erradicar las biopelículas lácteas utilizando una combinación de métodos estáticos y dinámicos. Todos los desinfectantes se probaron en las bacterias productoras de biopelícula más fuertes, ya sea en una biopelícula única o mixta, utilizando el ensayo de concentración mínima de erradicación de biopelícula (MBEC), un método estático de detección de alto rendimiento. Un tiempo de contacto de 5 min con los desinfectantes a las concentraciones recomendadas erradicó con éxito tanto las biopelículas simples como las mixtas. Actualmente se están realizando estudios para confirmar estas observaciones utilizando el reactor de biopelícula del Centro para el Control de Enfermedades (CDC), un método dinámico para imitar las condiciones in situ . Este tipo de biorreactor permite el uso de una superficie de acero inoxidable, que constituye la mayoría de los equipos y superficies industriales. Los resultados preliminares del reactor parecen confirmar la eficacia de los peroxiácidos orgánicos contra las biopelículas. El enfoque combinado descrito en este estudio se puede utilizar para desarrollar y probar nuevas formulaciones biológicas o químicas para controlar biopelículas y erradicar microorganismos.
Introducción
La industria láctea es un sector industrial importante en todo el mundo, incluso en Canadá, donde hay más de 10,500 granjas lecheras que producen casi 90 millones de hL de leche cada año1. A pesar de los estrictos requisitos de higiene impuestos en la industria láctea, incluso en las plantas de procesamiento, la leche constituye un gran medio de cultivo para microorganismos y, por lo tanto, es probable que los productos lácteos contengan microorganismos, incluido el deterioro o microorganismos patógenos. Estos patógenos pueden causar diversas enfermedades; por ejemplo, Salmonella sp. y Listeria monocytogenes pueden causar gastroenteritis y meningitis, respectivamente2. Los microorganismos de deterioro pueden afectar la calidad y las propiedades organolépticas de los productos lácteos mediante la producción de gases, enzimas extracelulares o ácidos3. La apariencia y el color de la leche también pueden verse alterados, por ejemplo, por Pseudomonas spp.4.
Algunos de estos microorganismos pueden formar biopelículas en diferentes superficies, incluido el acero inoxidable. Tales biopelículas permiten la persistencia y multiplicación de microorganismos en la superficie del equipo y, por lo tanto, la contaminación de los productos lácteos5. Los biofilms también son problemáticos debido a su capacidad para impedir la transferencia de calor y acelerar la corrosión del equipo, lo que lleva a la sustitución prematura del equipo y, por lo tanto, a pérdidas económicas6.
Los procedimientos de limpieza in situ (CIP) permiten a la industria alimentaria controlar el crecimiento de microorganismos. Estos procedimientos implican el uso secuencial de hidróxido de sodio, ácido nítrico y, a veces, desinfectantes que contienen ácido hipocloroso y ácido peracético 7,8. Aunque el ácido hipocloroso es altamente efectivo contra microorganismos, también reacciona con la materia orgánica natural, causando la formación de subproductos tóxicos9. El ácido peracético no genera subproductos nocivos10; Sin embargo, su efectividad frente a los biofilms en la industria alimentaria es muy variable10,11. Recientemente, otros peroxiácidos, incluyendo los ácidos perpropiónico y perláctico, han sido estudiados por su actividad antimicrobiana, y parecen ser una buena alternativa para el control del crecimiento microbiano en biofilms12,13.
Por lo tanto, este estudio tuvo como objetivo evaluar la eficacia de los peroxiácidos orgánicos (ácidos peracético, perpropiónico y perláctico y un desinfectante a base de ácido peracético) para erradicar las biopelículas lácteas utilizando un enfoque que combina el ensayo de concentración mínima de erradicación de biopelícula (MBEC), un método estático de detección de alto rendimiento y el reactor de biopelícula del Centro para el Control de Enfermedades (CDC), un método dinámico que imita in situ . condiciones. El ensayo MBEC se denominará en lo sucesivo "placas de título de microfilm de biopelícula" en el protocolo. El protocolo presentado aquí y los resultados representativos demuestran la eficacia de los peroxiácidos orgánicos y su aplicación potencial para controlar biopelículas microbianas en la industria láctea.
Protocolo
El trabajo contenido en este artículo requiere un laboratorio de nivel 2 de bioseguridad y fue aprobado previamente (Proyecto número 119689) por el comité institucional de bioseguridad de la Universidad Laval.
NOTA: El diagrama de flujo de la Figura 1 representa un resumen de la metodología que combina enfoques estáticos y dinámicos que se utilizó para evaluar la eficacia de los peroxiácidos orgánicos para erradicar las biopelículas.
1. Preparación de materiales
- Aislamientos microbianos
- Encienda el gabinete de seguridad biológica (BSC) 15 minutos antes de usarlo y límpielo con una solución de alcohol al 70% (v / v).
- Una vez que el BSC sea estéril, coloque un vial del aislado microbiano a analizar (Pseudomonas azotoformans o Brevundimonas vesicularis en este estudio), un bucle de inoculación, un tubo de 15 ml lleno de 10 ml de caldo de soja tríptico estéril (TSB) y un mezclador de vórtice. Antes de colocarlo en el BSC, desinfecte todos los materiales con alcohol.
- Vortex el vial de aislado microbiano para homogeneizar el cultivo.
- Transfiera asépticamente 20 μL del aislado microbiano a 10 ml de TSB estéril contenido en un tubo de 15 ml e incube a 30 °C durante 16-24 h con agitación a 160 rpm.
PRECAUCIÓN: B. vesicularis debe utilizarse en un laboratorio de contención de nivel 2 de acuerdo con las directrices requeridas para la manipulación de organismos patógenos. El manipulador debe estar debidamente capacitado y debe usar gafas de seguridad, guantes y un abrigo.
- Desinfectantes
- Para preparar la solución de peroxiácido orgánico (60 ml), añadir 24 ml de peróxido de hidrógeno y 36 ml de ácido (ácido acético, propiónico o láctico) en un erlenmeyer de 250 ml. Luego, agregue un volumen predefinido de ácido sulfúrico 10 M (655 μL para ácido peracético, 635 μL para ácido perpropiónico o 715 μL para ácido perláctico). Agitar suavemente el matraz para mezclar y poner el matraz en un baño de agua a 30 °C instalado dentro de la campana química. Incubar el matraz durante 2 días, mezclando suavemente cada mañana.
NOTA: El desinfectante comercial a base de ácido peracético (consulte la Tabla de materiales) fue proporcionado directamente por el fabricante.
PRECAUCIÓN: Los desinfectantes deben usarse debajo de una campana química. Se deben usar gafas y guantes de seguridad durante la duración del experimento. Para obtener más información sobre los desinfectantes, consulte la hoja de datos de seguridad de materiales correspondiente. - Realice la titulación del peróxido de hidrógeno como se describe a continuación.
- Coloque un vaso de precipitados vacío de 300 ml en una balanza analítica (consulte la Tabla de materiales) y cubra la báscula. Pese aproximadamente 0,23 g de desinfectante en el vaso de precipitados y observe el peso exacto añadido. Agregue 100 g de solución fría de ácido sulfúrico 1 N en el vaso de precipitados, agregue una barra de agitación magnética en el vaso de precipitados y colóquela en una placa de agitación.
- Deje que la solución se agite hasta la homogeneización completa. Luego, agregue tres gotas de una solución indicadora de ferroína (0.1% en peso enH2O) en el vaso de precipitados y titule con una solución de sulfato de cerio 0.1 N hasta que la solución cambie de un color rosa salmón a un color azul claro. Tenga en cuenta el volumen de solución de sulfato de cerio añadido.
- Calcule el porcentaje de peróxido de hidrógeno utilizando la siguiente fórmula:
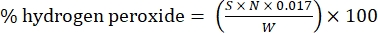 Ec. (1)
Ec. (1)
donde S es el volumen de solución de sulfato de cerio añadido, N es la normalidad de la solución de sulfato de cerio (0,1 N), W es el peso de la muestra (~0,2300 g) y 0,017 = (1 mol H 2 O 2/2 mol Ce) × (34,0147 g H 2 O 2 /1 mol H 2 O)2×(1 L/1.000 ml)
- Realice la titulación de los peroxiácidos orgánicos como se describe a continuación.
- Agregue 20 ml de solución de yoduro de potasio al 7,5% (p/v) en un vaso de precipitados. Valorar lentamente con solución de tiosulfato de sodio 0.1 N hasta que el color azul de la solución comience a volverse marrón pálido/naranja.
- Añadir 2 ml de solución de almidón (1 % en peso enH2O) al vaso de precipitados y valorar con 0,1 N de solución de tiosulfato de sodio hasta que la solución cambie de negro a naranja. Tenga en cuenta el volumen de solución de tiosulfato de sodio utilizado.
- Calcule el porcentaje de peroxiácido orgánico con la siguiente fórmula:
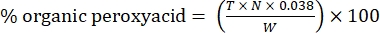 Ec. (2)
Ec. (2)
donde T es el volumen de solución de tiosulfato de sodio utilizado, N es la normalidad de la solución de tiosulfato de sodio (0,1 N), W es el peso de la muestra (~0,2300 g) y 0,038 = (1 mol CH 3 COOOH/1 mol I 2) × (1 mol I 2/2 mol S2 O 3) × (76,06 g/1 mol CH3 COOOH) × (1 L/1.000 ml)
NOTA: Repita los pasos 1.2.2 y 1.2.3 con dos muestras más para realizar cada prueba por triplicado.
- Para preparar la solución de peroxiácido orgánico (60 ml), añadir 24 ml de peróxido de hidrógeno y 36 ml de ácido (ácido acético, propiónico o láctico) en un erlenmeyer de 250 ml. Luego, agregue un volumen predefinido de ácido sulfúrico 10 M (655 μL para ácido peracético, 635 μL para ácido perpropiónico o 715 μL para ácido perláctico). Agitar suavemente el matraz para mezclar y poner el matraz en un baño de agua a 30 °C instalado dentro de la campana química. Incubar el matraz durante 2 días, mezclando suavemente cada mañana.
2. Formación de biofilms simples y mixtos
- Placas de microtitulación de biofilm
- Vórtice el tubo que contiene el cultivo bacteriano (20 μL de la cepa + 10 ml de medio TSB, preparado en la etapa 1.1.4). Realice la dilución en serie y el recubrimiento en agar tríptico de soja (TSA) para determinar el recuento de células bacterianas (ufc) del cultivo nocturno. Luego, transfiera asépticamente 100 μL del cultivo a 10 ml de medio TSB estéril (para una concentración final de aproximadamente 2 x 107 ufc/ml).
NOTA: Para el ensayo con el biorreactor, un volumen de 100 μL del aislado microbiano se transfiere a 100 ml de TSB estéril. - Vórtice el tubo. Para cada bacteria, transferir el cultivo bacteriano diluido a la placa de microtitulación del biofilm (150 μL por pocillo) por triplicado utilizando una pipeta multicanal. Cargue 150 μL de medio TSB en tres pocillos nuevos para que sirvan como controles. Incubar la placa de microtitulación del biofilm (ver Tabla de materiales) a 30 °C durante 24 h sin agitación.
NOTA: Para ensayos mixtos de biofilm, añadir 75 μL de cada suspensión para un volumen total de 150 μL. La placa de microtitulación de biofilm contiene clavijas en sus tapas, en las que se forman las biopelículas.
- Vórtice el tubo que contiene el cultivo bacteriano (20 μL de la cepa + 10 ml de medio TSB, preparado en la etapa 1.1.4). Realice la dilución en serie y el recubrimiento en agar tríptico de soja (TSA) para determinar el recuento de células bacterianas (ufc) del cultivo nocturno. Luego, transfiera asépticamente 100 μL del cultivo a 10 ml de medio TSB estéril (para una concentración final de aproximadamente 2 x 107 ufc/ml).
- Biorreactor
- Limpie y seque al aire las partes del biorreactor (ver Tabla de materiales) siguiendo las instrucciones del fabricante, y proceda a preparar el reactor como se describe a continuación.
- Primero, coloque la hoja plana dentro del vaso de precipitados de vidrio de 1 L (biorreactor), que está unido a su soporte por una barra magnética, y mantenga la configuración en posición vertical por medio de la barra de plástico unida en el lado interior de la tapa del biorreactor.
- Coloque los cupones o guías de acero inoxidable (consulte la Tabla de materiales) en sus varillas de polipropileno con el destornillador e insértelos en los orificios de la tapa, sin colocar sus pasadores de alineación en las muescas, para permitir que el vapor escape durante la esterilización.
- Cubra todas las rejillas de ventilación del biorreactor con papel de aluminio y envuelva el resto del equipo, a saber, el tubo L / S 18 (ID = 7.9 mm) y L / S 16 (ID = 3.1 mm), la rotura de flujo de vidrio, las tapas del contenedor, los destornilladores, las pinzas y los filtros de 0.2 μm, con papel de aluminio.
NOTA: Inserte el tubo de silicona (consulte la Tabla de materiales) en la púa ubicada en la superficie interna de la tapa del recipiente mediano. - Autoclave el biorreactor configurado en un ciclo seco a 121 °C durante 20 min.
- Realizar la formación de biofilm en el biorreactor en modo discontinuo (primer paso).
- En un BSC, conecte un extremo del tubo L/S 18 al pico de salida del biorreactor y mantenga el otro extremo envuelto en papel de aluminio para preservar la esterilidad.
- Retire un cupón o portaportaobjetos de la tapa del biorreactor y colóquelo en un tubo estéril de 50 ml. Después, llene el vaso de precipitados del biorreactor con 340 mL de medio de 300 mg/L TSB a través del orificio que estaba ocupado por la varilla utilizando una pipeta serológica de 50 mL.
- Inocular el medio de cultivo en el biorreactor con 1 ml de la solución bacteriana (~108 ufc/ml de P. azotoformans) utilizando una pipeta de 5 ml a través del mismo orificio utilizado anteriormente, y luego colocar la varilla de nuevo en su posición original. Coloque las varillas que ya están colocadas en los orificios de la tapa para que los pasadores encajen en sus respectivas muescas.
- Coloque un filtro de purga de aire bacteriano de 0,2 μm en el extremo del tubo con el diámetro más pequeño, que se encuentra en la tapa del biorreactor. El otro tubo del mismo diámetro permanece permanentemente tapado con un tapón de rosca de metal o un tapón de silicona que se cierra herméticamente.
- Colocar el biorreactor durante 24 h sobre la placa calefactora fijada a 30 °C y agitar a 130 rpm.
NOTA: Para la formación de biofilm multiespecie, utilice un volumen igual de los diferentes cultivos bacterianos para obtener un volumen total de 1 ml para el inóculo.
- Realizar la formación de biofilm en el biorreactor en modo de flujo continuo (segundo paso).
- Colocar una garrafa que contenga 18 L de agua destilada estéril en el BSC, y añadir 2 L de medio de cultivo de 1.000 mg/L de TSB para obtener una concentración final de 100 mg/L.
- Cubra el recipiente con su tapa estéril, a la que están conectados dos tubos. El primero es un tubo de silicona fijado en la cara interna de la tapa y se utiliza para bombear el medio. El segundo tubo (L/S 16) está conectado al puerto externo para permitir que el líquido fluya hacia el biorreactor. Coloque un filtro de 0,2 μm en el segundo tubo de la tapa del recipiente mediano.
- Conecte este segundo tubo a la bomba peristáltica y una el otro extremo a la ruptura de flujo de vidrio, que luego se inserta en el tubo más grande en la tapa del biorreactor.
- Utilice otra garrafa de 20 L para recoger el efluente del biorreactor. Fije el extremo del tubo conectado al pico de salida del biorreactor a la tapa del contenedor de residuos. Inserte un filtro de 0,2 μm en el tubo disponible en la tapa de este recipiente.
- Arranque la bomba peristáltica a un caudal de 11,3 mL/min, y deje el sistema funcionando durante 24 h.
NOTA: El caudal (11,3 mL/min) del medio de cultivo o leche utilizado durante la formación del biofilm en el biorreactor se determinó dividiendo 340 mL (que corresponde al volumen del líquido dentro del reactor) por el tiempo de residencia de 30 min.
- Recuperar el biofilm bacteriano.
- Apague la bomba peristáltica y deje de agitar y calentar el biorreactor.
- Retire cuidadosamente cada varilla del biorreactor y enjuague los cupones o portaobjetos 3 veces en 40 ml de PBS para eliminar las bacterias planctónicas. Después, suelte los cupones o portaobjetos en tubos cónicos estériles de 50 ml que contengan 40 ml de PBS con un destornillador apropiado. Vortex los tubos durante 30 s, transfiéralos a un bastidor colocado en un baño sonicador y sonicar los tubos a 40 kHz durante 30 s (lo que requiere 110 W de potencia). Repita esta operación 3 veces.
- Recoja las suspensiones de biopelícula de 40 ml en tubos cónicos estériles de 50 ml y luego enjuague los cupones o portaobjetos con 2 ml de solución estéril de PBS. Recupere este líquido de enjuague y agréguelo a la suspensión de biofilm ya recolectada.
- Enumere las bacterias viables en la biopelícula: Con la suspensión de biopelícula obtenida, realice diluciones seriadas de 10 veces y luego coloque 100 μL de las diluciones 10-5 y 10-6 en TSA por triplicado. Incubar las placas a 30 °C durante 24 h. Cuente el número de colonias presentes en las placas de agar y calcule la densidad bacteriana en los cupones y portaobjetos (bacterias sésiles viables) de acuerdo con ASTM E2562-1714 utilizando la siguiente fórmula:
 Ec. (3)
Ec. (3)
donde X es el número de unidades formadoras de colonias (UFC), B es el volumen chapado (0,1 ml), V es el volumen en el que se suspende la biopelícula (la solución madre), A es la superficie del cupón o portaobjetos cubierto por la biopelícula y D es el factor de dilución.
- Limpie y seque al aire las partes del biorreactor (ver Tabla de materiales) siguiendo las instrucciones del fabricante, y proceda a preparar el reactor como se describe a continuación.
3. Evaluación cuantitativa de la eficacia de los peroxiácidos orgánicos para erradicar los biofilms
- Placas de microtitulación de biofilm
- Agregue 200 μL de solución salina tamponada con fosfato (1x PBS) en tres pocillos de una microplaca de 96 pocillos.
- Transfiera la tapa de la microplaca de biopelícula, con biopelículas que se han formado en las clavijas, a la microplaca de 96 pocillos que contiene el PBS durante 10 s para lavar las biopelículas y eliminar las bacterias planctónicas.
- Prepare los desinfectantes en las concentraciones requeridas (por ejemplo, 25 ppm, 50 ppm, 500 ppm, 1,000 ppm, 5,000 ppm, 10,000 ppm y 25,000 ppm de sustancia activa).
NOTA: Todas las diluciones se realizan asépticamente utilizando agua destilada estéril. - Añadir 200 μL de cada concentración de desinfectante en los pocillos de una nueva placa de microtitulación de 96 pocillos por triplicado. Transfiera la tapa de la placa de microtitulación de biopelícula a esta placa de microtitulación de 96 pocillos que contiene los desinfectantes e incube la placa a temperatura ambiente durante el tiempo de exposición deseado.
- Agregue 200 μL de caldo neutralizante Dey-Engley a los pocillos de una nueva placa de microtitulación de 96 pocillos. Transfiera la tapa de la placa de microtitulación de biopelícula a la placa de microtitulación de 96 pocillos que contiene el caldo neutralizante. Selle la placa de microtitulación con parafilm y colóquela en el sonicador de baño a 40 kHz durante 30 min.
- Después de 30 minutos, retire la placa de microtitulación del sonicador y retire la parapelícula. Transfiera 100 μL desde la primera columna de la placa de 96 pocillos que contiene las biopelículas separadas después de la sonicación a la primera fila de una nueva placa de microtitulación de 96 pocillos.
- Añadir 180 μL de 1x PBS estéril a los pocillos de la nueva microplaca de 96 pocillos (preparada en el paso 3.1.6), excepto la primera fila. Transfiera 20 μL de la solución de biofilm de la primera fila a los pocillos de la segunda fila que contienen 180 μL de 1x PBS (fila 2, dilución: 10−1). Luego, transfiera 20 μL del líquido contenido en la segunda fila a los pocillos de la siguiente fila que contienen 180 μL de 1x PBS (Fila 3, dilución: 10−2). Repita el mismo procedimiento para obtener diluciones entre 10−5 y 10−7.
- Inocular 100 μL de las diluciones en TSA, e incubar las placas de acuerdo con los parámetros requeridos para el crecimiento de cada bacteria.
- Después de la incubación, cuente las cuf y calcule la densidad logarítmica 10 para cada clavija y la reducción logarítmica10 en cada concentración de desinfectante con las siguientes ecuaciones:
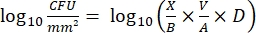 Ec. (4)
Ec. (4)
donde X son las unidades formadoras de colonias contadas en el lugar, B es el volumen chapado (0,01 ml), V es el volumen del pozo (0,20 ml), A es el área de superficie de la clavija (46,63 mm2) y D es la dilución.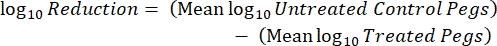 Ec. (5)
Ec. (5) - Repita cada experimento 3 veces en días independientes.
NOTA: La "concentración mínima de desinfectante que erradica el biofilm", o MBEC, corresponde a la concentración más baja de desinfectante que no muestra crecimiento bacteriano.
- Biorreactor
NOTA: Se sigue el procedimiento de la norma ASTM E2871-1915 para realizar esta prueba con P. azotoformans PFlA1.- Comience formando las biopelículas en los cupones en el biorreactor, como se describe en el paso 2.2. Luego, retire la varilla que contiene los cupones y enjuáguela dentro de un tubo cónico que contenga 30 ml de PBS.
- Coloque cada cupón en un tubo cónico estéril de 50 ml con un destornillador y luego agregue 4 ml de la solución orgánica de peroxiácido o PBS apropiada para el control. Incubar durante 5 min, y luego añadir 36 mL de caldo neutralizante Dey-Engley. Vórtice durante 30 s, y luego sonicar a 40 kHz durante 30 s usando un baño sonicador. Repita el proceso 3 veces para obtener la suspensión de biopelícula.
- Del mismo modo, enjuague todas las otras varillas y recupere las biopelículas de los cupones. Realizar diluciones seriadas de la suspensión de biofilm y placa 0.1 mL en medio TSA. Incubar las placas a 30 °C durante 24 h.
- Después de la incubación, cuente las ufc y luego calcule la densidad de biopelícula para cada cupón (Ec. 6), la densidad logarítmica media (LD) para cada conjunto de tres cupones de la misma varilla, incluidos el tratamiento y el control (Ec. 7), y la reducción logarítmica para el desinfectante (Ec. 8) utilizando las siguientes ecuaciones:
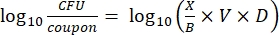 Ec. (6)
Ec. (6)
donde X es la media de las unidades formadoras de colonias contadas/cupón, B es el volumen chapado (0,1 ml), V es el volumen de desinfectante o PBS más neutralizador (40 ml) y D es la dilución.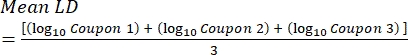 Ec. (7)
Ec. (7)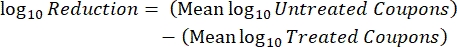 Ec. (8)
Ec. (8)
4. Evaluación cualitativa de la eficacia de los peroxiácidos orgánicos para la erradicación de biofilms
NOTA: Después de ser tratados con los desinfectantes (paso 3.1.1 a paso 3.1.5), las biopelículas de P. azotoformans que se formaron en las clavijas de la placa de microtitulación de biopelícula en el método estático se prepararon y analizaron mediante observación en microscopios electrónicos y confocales de barrido.
- Microscopía electrónica de barrido (SEM)
- Agregue 200 μL de 1x PBS a tres pocillos de una microplaca de 96 pocillos. Transfiera la tapa de la placa de título de microfilm de biofilm (paso 3.1.5) a la microplaca de 96 pocillos que contiene PBS, y déjela a temperatura ambiente durante 10 s para eliminar el caldo neutralizante Dey-Engley.
- Retire las clavijas de la placa de titulación de microfilm de biofilm utilizando alicates de punta de aguja esterilizados. Coloque cada clavija en un vial vacío debajo de una campana y agregue fijador primario (glutaraldehído al 5% en tampón de cacodilato de 0,1 M Na pH 7,5) a cada vial. Tapar cada vial e incubar a 4 °C durante 24 h.
- Después de la incubación, decantar el fijador con una pipeta y desechar todos los residuos líquidos en un recipiente apropiado. Retire las tapas de cada vial y colóquelas en una campana para secar al aire durante 72 h.
- Monte las muestras en talones de aluminio (consulte la Tabla de materiales) aplicando resina epoxi (consulte la Tabla de materiales) a la superficie superior plana de cada talón. Luego, fije cuidadosamente las clavijas a los talones con fórceps.
- Metalice las muestras con un sputter de oro EMS950x + 350s (consulte la Tabla de materiales) durante 4 min a una presión de argón de 2 x 10−1 bar y una corriente de 20 mA. Realice una conexión a tierra adecuada pintando el lado de la clavija no expuesto al oro con pintura plateada (consulte la Tabla de materiales).
- Adquiera imágenes en un microscopio electrónico de barrido utilizando la versión 6.28 de la interfaz de usuario del control SEM (consulte la Tabla de materiales). El voltaje de aceleración utilizado en este estudio fue de 15 kV, y los aumentos fueron 300x y 2.000x.
- Microscopía confocal
- Agregue 200 μL de 1x PBS a tres pocillos de una placa de microtitulación de 96 pocillos. Transfiera la tapa de la microplaca de biopelícula a la placa de 96 pocillos que contiene el PBS y déjela durante 10 segundos para eliminar el caldo neutralizante Dey-Engley.
- Prepare soluciones de tinciones fluorescentes agregando 3 μL de tinción fluorescente verde y 3 μL de tinción fluorescente roja (ver Tabla de materiales) a 1 ml de agua estéril.
- Agregue 200 μL de solución de tinción en un pocillo de una placa de microtitulación de 96 pocillos. Transfiera la tapa de la placa de microtitulación de biopelícula a la placa de 96 pocillos que contiene la solución de tinción. Cubra la placa de microtitulación de biofilm con papel de aluminio e incube la muestra durante 20-30 minutos a temperatura ambiente.
- Agregue 200 μL de agua esterilizada en los pocillos de una microplaca de 96 pocillos. Luego, transfiera la tapa de la microplaca de biopelícula a la microplaca de 96 pocillos que contiene el agua y déjela hasta la observación.
- Visualice las biopelículas formadas en las clavijas utilizando un microscopio de barrido láser confocal (consulte la Tabla de materiales) con un objetivo DIC de aceite 63x/1.40. Adquiera las imágenes utilizando el software asociado (consulte la Tabla de materiales). Las longitudes de onda de excitación de fluorescencia utilizadas para las tinciones fluorescentes verde y roja fueron 482 nm y 490 nm, respectivamente.
NOTA: Para obtener los mejores resultados, corte y coloque la clavija en una placa de Petri de 60 mm y llene el plato con agua estéril.
Resultados
El análisis SEM muestra la presencia de biofilms producidos por P. azotoformans PFl1A en las clavijas de microplacas del biofilm (Figura 2A). Se puede observar una estructura tridimensional de biofilm. El P. azotoformans PFl1A fue identificado previamente como un fuerte productor de biofilm (A570 > 1.5) utilizando placas de microtitulación de 96 pocillos12.
Además, la biopelícula PFl1A de P. azotoformans...
Discusión
El ensayo MBEC (ensayo de microplaca de biopelícula) fue el primer método reconocido como una prueba estándar de erradicación de biopelícula por la ASTM17. Nuestro estudio y otros han demostrado que hay dos pasos críticos cuando se utiliza este ensayo: el paso de sonicación (tiempo y potencia) y el tiempo de tratamiento del desinfectante18. Stewart y Parker también sugirieron otros parámetros que podrían influir en el resultado del ensayo, como la especie microbia...
Divulgaciones
Los autores declaran que no tienen conflictos de intereses.
Agradecimientos
Esta investigación fue apoyada por el Consortium de Recherche et Innovations en Bioprocédés Industriels au Québec (CRIBIQ) (2016-049-C22), Agropur, Groupe Sani Marc y el Consejo de Investigación de Ciencias Naturales e Ingeniería de Canadá (NSERC) (RDCPJ516460-17). Agradecemos a Teresa Paniconi por la revisión crítica del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 µm filters | Corning | 09-754-28 | diameter: 50 mm, PTFE- Membrane |
| 316 stainless-steel disc coupon | Biosurface Technologies Corporation | RD128-316 | |
| 316 stainless-steel slide coupon | Biosurface Technologies Corporation | CBR 2128-316 | |
| 96-microtiter plate | Corning | 07-200-89 | cell Culture-Treated, flat-Bottom Microplate |
| Acetic acid | Sigma Aldrich | 27225 | store at RT |
| Aluminium stubs | Electron Microscopy Science | 75830-10 | 32x5mm |
| Aqueous glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16220 | store at -20 °C |
| AB204-S/FACT Analytical balance | Mettler Toledo | AB204-S | |
| Bacterial Vent Filter (0.45 µm) | Biosurface Technologies Corporation | BST 02915 | |
| BioDestroy | Groupe Sani Marc | 09-10215 | commercial peracetic acid-based disinfectant, store at RT |
| Carboy LDPE 20 L | Cole Parmer | 06031-52 | |
| CDC biofilm reactor | Biosurface Technologies Corporation | CRB 90 | bioreactor |
| Cerium (IV) sulphate | Thermo Scientific | 35650-K2 | store at RT |
| Confocal laser scanning microscope LSM 700 | Zeiss | LSM 700 | |
| Dey-Engley neutralizing broth | Millipore | D3435-500G | store at 4 °C |
| EMS950x + 350s gold sputter | Electron Microscopy Sciences | ||
| Epoxy resin | Electron Microscopy Sciences | 14121 | with BDMA |
| Ethyl alcohol 95%, USP | Greenfield global | P016EA95 | store at RT |
| Ferroin indicator solution | Sigma Aldrich | 318922-100ML | store at RT |
| Filling/venting cap | Cole Parmer | RK-06258-00 | |
| FilmTracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | fluorescent cell viability kit (SYTO 9: green fluorescent stain, Propidium iodide: red fluorescent stain), store at - 20 °C |
| Glass flow break | Biosurface Technologies Corporation | FB 50 | |
| Gold with silver paint | Electron Microscopy Sciences | 12684-15 | |
| Heating plate set | Biosurface Technologies Corporation | 110V Stir Plate | |
| Hex screwdriver | Biosurface Technologies Corporation | CBR 5497 | |
| Hydrogen peroxide | Sigma | 216763 | store at 4 °C |
| Inoculating loops | VWR | 12000-812 | sterile, 10 µl |
| Lactic acid | Laboratoire MAT | LU-0200 | store at RT |
| MASTERFLEX L/S 7557-04 W/ 7557-02 with EASY-LOAD II peristaltic pump and 77200-50 Head | Cole Parmer | 77200-60 | |
| MBEC (Minimum Biofilm Eradication Concentration) assay biofilm inoculator with a 96-well base | Innovotech | 19111 | Biofilm microtiter plate |
| Oxford agar base | Thermo Scientific | OXCM0856B | store at 4 °C |
| Plastic coupon holder | Biosurface Technologies Corporation | CBR 2203 | |
| Plastic slide holder rod | Biosurface Technologies Corporation | CBR 2203-GL | |
| Potassium iodide | Fisher Chemical | P410-500 | store at RT |
| Precision slotted screwdriver (1.5 mm x 40 mm) | Wiha | 26015 | |
| Propionic acid | Laboratoire MAT | PF-0221 | store at RT |
| Sartorius BCE822-1S Entris® II Basic Essential Toploading Balance | Cole Parmer | UZ-11976-3 | |
| Scanning electron microscope JSM-6360LV model | JEOL | JSM-6360LV | SEM and user control interface |
| Screw cap tube, 15 mL | Sarstedt | 62.554.205 | (LxØ): 120 x 17 mm, material: PP, conical base, transparent, HD-PE |
| Screw cap tube, 50 mL | Sarstedt | 62.547.205 | (LxØ): 114 x 28 mm, material: PP, conical base, transparent, HD-PE |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | store at -20 °C |
| Sodium thiosulfate | Thermo Scientific | AC124270010 | store at RT |
| Sonication bath | Fisher | 15-336-122 | 5,7 L |
| Starch solution | Anachemia | AC8615 | store at RT |
| Sulfuric acid | Sigma Aldrich | 258105-500ML | store at RT |
| Tryptic soy agar | BD Bacto | DF0369-17-6 | store at RT |
| Tryptic soy broth | BD Bacto | DF0370-17-3 | store at RT |
| Tubing Masterflex L/S 16 25' | Cole Parmer | MFX0642416 | |
| Tubing Masterflex L/S 18 25' | Cole Parmer | MFX0642418 | |
| Tygon SPT-3350 silicon tubing | Saint-Gobain | ABW18NSF | IDx OD: 1/4 in.x 7/16 in. |
| Vortex | Cole Parmer | UZ-04724-00 | |
| Water bath | VWR | 89202-970 | |
| Zen software | Zeiss |
Referencias
- Canada's dairy industry at a glance. Canadian Dairy Information Centre Available from: https://agriculture.canada.ca/en/canadas-agriculture-sectors/animal-industry/canadian-dairy-information-centre/canadas-dairy-industry-glance (2017)
- Oliver, S. P., Jayarao, B. M., Almeida, R. A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications. Foodborne Pathogens and Disease. 2 (2), 115-129 (2005).
- Fondation de technologie laitière du Québec. . Science et technologie du lait. 3rd edn. , (2018).
- Evanowski, R., et al. Short communication: Pseudomonas azotoformans causes gray discoloration in HTST fluid milk. Journal of dairy science. 100, 7906-7909 (2017).
- Bower, C. K., McGuire, J., Daeschel, M. A. The adhesion and detachment of bacteria and spores on food-contact surfaces. Trends in Food Science & Technology. 7 (5), 152-157 (1996).
- Gupta, S., Anand, S. Induction of pitting corrosion on stainless steel (grades 304 and 316) used in dairy industry by biofilms of common sporeformers. International Journal of Dairy Technology. 71 (2), 519-531 (2018).
- Marchand, S., et al. Biofilm formation in milk production and processing environments; Influence on milk quality and safety. Comprehensive Reviews in Food Science and Food Safety. 11 (2), 133-147 (2012).
- Silva, H. O., et al. Efficiency of different disinfectants on Bacillus cereus sensu stricto biofilms on stainless-steel surfaces in contact with milk. Frontiers in Microbiology. 9, 2934 (2018).
- Sedlak, D. L., von Gunten, U. Chemistry. The chlorine dilemma. Science. 331 (6013), 42-43 (2011).
- vander Veen, S., Abee, T. Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid. International Journal of Food Microbiology. 144 (3), 421-431 (2011).
- Saa Ibusquiza, P., Herrera, J. J., Cabo, M. L. Resistance to benzalkonium chloride, peracetic acid and nisin during formation of mature biofilms by Listeria monocytogenes. Food Microbiology. 28 (3), 418-425 (2011).
- Goetz, C., Larouche, J., Velez Aristizabal, M., Niboucha, N., Jean, J. Efficacy of organic peroxyacids for eliminating biofilm preformed by microorganisms isolated from dairy processing plants. Applied and Environmental Microbiology. 88 (4), 0188921 (2022).
- Vimont, A., Fliss, I., Jean, J. Study of the virucidal potential of organic peroxyacids against norovirus on food-contact surfaces. Food and Environmental Virology. 7 (1), 49-57 (2015).
- ASTM E2562-17. Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International Available from: https://www.astm.org/e2562-17.html (2017)
- ASTM E2871-19. Standard Test Method for Evaluating Disinfectant Efficacy Against Pseudomonas aeruginosa Biofilm Grown in CDC Biofilm Reactor Using Single Tube Method. ASTM International Available from: https://www.astm.org/e2871-19.html (2019)
- Niboucha, N., et al. Comparative study of different sampling methods of biofilm formed on stainless-steel surfaces in a CDC biofilm reactor. Frontiers in Microbiology. 13, 892181 (2022).
- ASTM E2799-17. Standard Test Method for Testing Disinfectant Efficacy against Pseudomonas aeruginosa Biofilm using the MBEC Assay. ASTM International Available from: https://www.astm.org/e2799-17.html (2022)
- Parker, A. E., et al. Ruggedness and reproducibility of the MBEC biofilm disinfectant efficacy test. Journal of Microbiological Methods. 102, 55-64 (2014).
- Stewart, P. S., Parker, A. E. Measuring antimicrobial efficacy against biofilms: A meta-analysis. Antimicrobial Agents and Chemotherapy. 63 (5), 00020 (2019).
- Lindsay, D. K., Fouhy, K., Loh, M., Malakar, P. The CDC biofilm bioreactor is a suitable method to grow biofilms, and test their sanitiser susceptibilities, in the dairy context. International Dairy Journal. 126, 105264 (2022).
- Buckingham-Meyer, K., Goeres, D. M., Hamilton, M. A. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods. 70 (2), 236-244 (2007).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology (Reading). 151, 757-762 (2005).
- Williams, D. L., Woodbury, K. L., Haymond, B. S., Parker, A. E., Bloebaum, R. D. A modified CDC biofilm reactor to produce mature biofilms on the surface of peek membranes for an in vivo animal model application. Current Microbiology. 62 (6), 1657-1663 (2011).
- Pieranski, M. K., Rychlowski, M., Grinholc, M. Optimization of Streptococcus agalactiae biofilm culture in a continuous flow system for photoinactivation studies. Pathogens. 10 (9), 1212 (2021).
- Mendez, E., Walker, D. K., Vipham, J., Trinetta, V. The use of a CDC biofilm reactor to grow multi-strain Listeria monocytogenes biofilm. Food Microbiology. 92, 103592 (2020).
- Salgar-Chaparro, S. J., Lepkova, K., Pojtanabuntoeng, T., Darwin, A., Machuca, L. L. Nutrient level determines biofilm characteristics and subsequent impact on microbial corrosion and biocide effectiveness. Applied and Environmental Microbiology. 86 (7), 02885 (2020).
- Goeres, D. M., Simoes, M., Borges, A., Chaves Simoes, L., et al. Design and Fabrication of Biofilm Reactors. Recent Trends in Biofilm Science and Technology. , 71-88 (2020).
- Fjeld, C. S., Schüller, R. B. Biofilm formation during hexadecane degradation and the effects of flow field and shear stresses. Annual Transactions - The Nordic Rheology Society. 21, 341-346 (2013).
- Gilmore, B. F., Hamill, T. M., Jones, D. S., Gorman, S. P. Validation of the CDC biofilm reactor as a dynamic model for assessment of encrustation formation on urological device materials. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (1), 128-140 (2010).
- Picioreanu, C., van Loosdrecht, M. C., Heijnen, J. J. Two-dimensional model of biofilm detachment caused by internal stress from liquid flow. Biotechnology and Bioengineering. 72 (2), 205-218 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados