Method Article
Desarrollo de un modelo de lesión crónica del manguito rotador de conejo para el estudio de la fibrosis y la degeneración grasa muscular
En este artículo
Resumen
Este estudio detalla los procedimientos para establecer una lesión crónica del manguito rotador (CR) del conejo. Específicamente, la lesión se crea en la unidad músculo-tendón/miotendinosa del subescapular (SSC) para imitar la anatomía y la fisiopatología del RC humano, incluida la degeneración grasa muscular (DF) grave. Este protocolo se puede aplicar para estudiar las lesiones por RC y evaluar las terapias regenerativas.
Resumen
La fisiopatología del manguito rotador (CR) de conejo puede conducir a cambios progresivos y altamente degenerativos en su musculatura y tendones asociados, lo que influye negativamente en parámetros clínicamente relevantes, como la fuerza y la retracción de la unidad músculo-tendinosa/miotendinosa, lo que en última instancia provoca la pérdida de la función del hombro y afecta negativamente a los resultados de reparación del RC. Los modelos animales que imitan aspectos de la anatomía y la fisiopatología de la RC humana son cruciales para avanzar en la comprensión conceptual de la progresión de las lesiones y desarrollar terapias eficaces basadas en la ingeniería de tejidos y la medicina regenerativa.
En este contexto, un modelo de conejo subescapular (SSC) es adecuado debido a (i) su similitud anatómica con la unidad hueso-tendón-músculo del supraespinoso humano (SSP), que es el sitio de RC lesionado con mayor frecuencia; (ii) su similitud fisiopatológica con los humanos en términos de fibrosis y degeneración grasa muscular (DF); y (iii) su capacidad para procedimientos quirúrgicos. Por lo tanto, el objetivo de este estudio es describir las técnicas quirúrgicas para la inducción de la lesión por CSR RC. Brevemente, el procedimiento implica el aislamiento del SSC mediante la identificación del músculo coracobraquial, seguido de una transección de espesor completo en la unión músculo-tendón y la envoltura del extremo libre de la unión músculo-tendón con un tubo de Penrose a base de silicona para evitar la reinserción espontánea. Se realizan evaluaciones histológicas para monitorizar la progresión de la FD muscular a las 4 semanas postoperatorias utilizando hematoxilina y eosina (H&E), así como tinción tricrómica de Masson.
La pérdida de músculo y la DF fueron evidentes 4 semanas después de la transección de la unión músculo-tendón SSC, similar a las condiciones fisiopatológicas de la RC humana. Este protocolo demuestra los pasos para establecer con éxito un modelo de lesión de RC SSC de conejo de tipo crónico, que puede servir como una herramienta poderosa para estudiar los cambios musculares esqueléticos asociados con la fisiopatología de RC y ayudar al desarrollo de nuevas estrategias terapéuticas para los desgarros de RC de tipo crónico.
Introducción
Los desgarros crónicos del manguito rotador (CR) se caracterizan por cambios degenerativos en la musculatura y los tendones, incluida la atrofia de los músculos, la acumulación de tejido adiposo y la fibrosis, que pueden comprometer el resultado de la reparación del RC y, en última instancia, causar dolor y disfunción en el hombro 1,2,3,4,5 . Para comprender mejor la patogénesis del desgarro por RC y mejorar los resultados quirúrgicos, es crucial desarrollar modelos animales apropiados que puedan imitar aspectos de la anatomía y fisiopatología del RC humano. Específicamente, los modelos de lesión RC deben cumplir con los siguientes criterios: (i) carecen de curación espontánea después de la lesión; (ii) contengan una presencia significativa de fibrosis, atrofia muscular y acumulación de tejido adiposo; y (iii) ser de tamaño adecuado para permitir la aproximación de las técnicas quirúrgicas utilizadas en humanos6.
En este contexto, el músculo subescapular del conejo (SSC) puede ser utilizado como un modelo animal preciso y confiable para el estudio de la fisiopatología de la RC, dada su anatomía única, respuesta fisiopatológica y propiedades biomecánicas7. De hecho, la anatomía del CR del CSE del conejo es similar a la del RC del supraespinoso humano (PSE), que es la unidad músculo-tendinosa que se asocia con mayor frecuencia a las lesiones derivadas del uso excesivo 8,9. En concreto, el complejo tendinoso SSC del conejo pasa a través de un túnel óseo y por debajo del músculo coracobraquial, lo que es análogo a la situación en humanos donde el complejo tendinoso SSP pasa por el túnel óseo subacromial y por debajo del ligamento coracoacromial7. Esta similitud anatómica da lugar a que el SSC de conejo experimente movimientos musculoesqueléticos similares a los del SSP humano, en el que el tendón viaja por debajo del acromion durante la elevación y abducción del húmero 7,10.
Además, se han observado cambios patohistológicos, similares a los desgarros humanos de RC11, en el conejo después del desgarro de SSC. Específicamente, el vientre muscular sufre una DF severa, con una pérdida significativa de masa muscular, disminución del área de la sección transversal de las fibras musculares y aumento de la adiposidad. Además, Otarodifard et al. evaluaron las características biomecánicas de la SSC de conejo después de (1) técnicas de reparación de RC de una sola fila, (2) de doble fila y (3) equivalente transóseo, y encontraron que las características biomecánicas iniciales de estas reparaciones eran similares a las reparaciones de SSP RC humanas realizadas en especímenes cadavéricos12. Como tal, la similitud anatómica, fisiológica y biomecánica de la SSC de conejo con la SSP humana la hace útil para modelar lesiones de RC.
Aunque muchas especies de animales, como ratas, ratones, perros y ovejas, se han utilizado en el estudio de la enfermedad y la reparación de la CR 6,13,14,15, el grado de cronicidad de las lesiones es una consideración clave. Esto se debe a que los desgarros de RC pueden ser asintomáticos y, a menudo, pueden diagnosticarse mucho más tarde, cuando el desgarro se ha agrandado y se ha vuelto de naturaleza crónica, y tanto el tendón como el músculo exhiben una degeneración severa16,17,18. Sin embargo, la mayoría de los modelos de reparación de RC emplean modelos de lesión aguda, en los que se secciona el tendón sano y luego se repara inmediatamente 19,20,21,22. Esto ocurre en gran medida por razones de conveniencia logística y facilidad técnica, lo que da lugar a pocos estudios que examinen la fisiopatología de la RC en un entorno crónico. Además, varios modelos animales pueden poseer atributos que dificultan su uso para estudios crónicos de RC.
Por ejemplo, aunque la rata se ha utilizado ampliamente para modelar el desgarro y la intervención de RC, la falta de acumulación adiposa significativa después de una lesión contrasta con la condición humana, y su pequeño tamaño hace que los procedimientos quirúrgicos repetidos sean un desafío23. Además, aunque Gerber et al. utilizaron el infraespinoso de ovejas para estudiar la atrofia muscular y la DF después de un desgarro crónico de RC24, existe cierta disimilitud anatómica entre el infraespinoso de ovejas y el SSP humano, así como numerosos desafíos logísticos para estudiar y alojar un modelo animal tan grande. Además, Gerber et al. desarrollaron un modelo de lesión de RC diferida en ovejas mediante la liberación de la cabeza superficial del músculo infraespinoso y el tendón para imitar las características de un desgarro crónico de RC, y luego evaluaron la eficacia de diferentes técnicas de reparación en el tendón a las 4 a 6 semanas. Desafortunadamente, este modelo de oveja de tipo crónico poseía una limitación, ya que el extremo del tendón liberado se volvió indistinguible del tejido cicatricial durante el segundo procedimiento quirúrgico25.
Coleman et al. también desarrollaron un modelo de desgarro crónico de RC en ovejas cubriendo el extremo del tendón seccionado con una membrana sintética en el momento de la cirugía inicial, lo que permitió la difusión de nutrientes y minimizó eficientemente la formación de tejido cicatricial alrededor del tejido lesionado, al tiempo que mejoró la discriminación entre el tendón y el tejido cicatricial26. Por su parte, Turner et al. sugirieron que la reparación diferida debe realizarse en un plazo de 4 semanas, ya que la reinserción directa rara vez ocurre en una retracción masiva del tendón27. En conjunto, estos estudios han contribuido a la creación de protocolos reproducibles y fiables para el establecimiento exitoso de un modelo de lesión crónica por CCE de conejo de tipo crónico.
En este protocolo, se establece un modelo de lesión crónica de conejo RC a las 4 semanas, en el que se pueden estudiar los cambios patológicos relacionados con la fibrosis y la atrofia muscular mediada por DF a través de evaluaciones histológicas. En particular, envolver el extremo libre de la unión músculo-tendón con un tubo de Penrose a base de silicona en el momento de la cirugía inicial permite una identificación clara de los tejidos de RC durante el segundo procedimiento quirúrgico y, en consecuencia, facilita una reparación segura para estudiar la cicatrización de RC con y sin aumento de andamios. En conjunto, un modelo de CSS de conejo de tipo crónico puede imitar mejor la fisiopatología de la RC y plantear requisitos técnicos y logísticos mínimos.
Protocolo
Todos los procedimientos deben realizarse mediante técnica quirúrgica estéril en una sala debidamente equipada y designada para cirugías con animales de acuerdo con un protocolo aprobado por el comité de ética de experimentación animal del instituto. En el presente estudio, las cirugías de conejos se realizaron de acuerdo con un protocolo aprobado por el Comité de Ética de Experimentación Animal de la Universidad China de Hong Kong.
1. Procedimiento quirúrgico
- Para preparar el área quirúrgica, precalienta una almohadilla térmica y cúbrela con paños quirúrgicos estériles para mantener la temperatura corporal del conejo. Posteriormente, coloque las herramientas y suministros quirúrgicos esterilizados (como se especifica en la Tabla de materiales) y organícelos de acuerdo con las preferencias del cirujano.
- Inducir la anestesia mediante la administración intramuscular de 35 mg/kg de ketamina y 5 mg/kg de xilacina a conejos blancos de Nueva Zelanda (con un peso de entre 3,5 y 4,5 kg, alrededor de 5-6,5 meses de edad; en este estudio se utilizaron dos conejos machos y una hembra). Posteriormente, confirme la anestesia con una prueba de pellizco de pata y/o cola.
- Si se requiere anestesia adicional para mantener el plano quirúrgico, administrar 10 mg/kg de ketamina y 3 mg/kg de xilacina por vía intravenosa a través de la vena marginal del oído28 y controlar la frecuencia respiratoria del animal a intervalos regulares de 5-10 min.
- Para preparar la ventana quirúrgica, afeitar el sitio de incisión previsto (la región de la piel superficial a la unidad músculo-tendinosa SSC) y limpiar con tres aplicaciones alternas de betadine y alcohol al 70%. Use un hisopo de algodón para aplicar betadine y alcohol al 70% con movimientos circulares (de adentro hacia afuera). Usa ungüento para los ojos para mantener los ojos del conejo húmedos y lubricados. Administrar 20 mg/kg de cefalexina por vía intramuscular como agente antiinfeccioso.
- Hacer una incisión en la piel de 3-4 cm por debajo de la clavícula, dividir el intervalo deltopectoral con un bisturí quirúrgico n.º 11 y retraerlo para acceder al hombro (Figura 1A,B).
- Para localizar la unidad músculo-tendón de la CSE, primero identifique el músculo coracobraquial (como tejido que cubre la inserción del tendón de la CSE) y divídalo. A continuación, identifique el tendón SSC e inserte una pinza en ángulo recto para exponer todo el tendón SSC en su inserción en la tuberosidad menor del húmero (Figura 1C).
- Antes de introducir la lesión, aislar el músculo-tendón del SSC (Figura 1D) y administrar anestésico intraoperatorio (0,2 mg/kg de bupivacaína al 0,5%) localmente cerca del sitio de la transección. Envuelva la unidad músculo-tendinosa SSC en un tubo de Penrose a base de silicona (Figura 1E) para evitar la unión no deseada a los tejidos circundantes y ayudar a la posterior recuperación del tejido.
- Para inducir la lesión, cree una transección de espesor completo en la unión músculo-tendón utilizando un bisturí quirúrgico n.º 11 (Figura 1F). Cuando sea necesario, detenga el sangrado aplicando presión con un trozo de gasa y use solución salina para irrigar la herida según sea necesario.
- Para cerrar la herida, utilice una sutura de ácido poliglicólico (PGA) 4-0 para reaproximar el tejido muscular deltoides (Figura 1G) y una sutura de nailon 4-0 para cerrar la herida cutánea (Figura 1H).
- Proporcionar cuidados postoperatorios mediante la administración subcutánea de 0,03 mg/kg de buprenorfina como analgésico (una vez inmediatamente después de la cirugía y dos veces al día durante las siguientes 48 h29).
- Permita que los conejos se recuperen en una almohadilla térmica cubierta y aplique un collar suave para evitar comportamientos no deseados, incluida la automutilación, el lamido de los sitios quirúrgicos y la extracción de suturas (Figura 1I).
- Controle a los animales para detectar cambios de peso y comportamiento. Informe al veterinario de cualquier disminución de más del 10% del peso corporal y dolor intenso que no se pueda controlar (evaluado en función de cinco acciones conductuales: estiramiento orbital, aplanamiento de las mejillas, cambios en la forma de las fosas nasales, cambios en la posición de los bigotes y cambios en la forma y posición de las orejas) para determinar si se requiere una intervención como la eutanasia temprana.
2. Recolección de muestras
- Sacrificar a los conejos a las 4 semanas desde el momento de la lesión. Anestesiar a los conejos y administrar una dosis letal de pentobarbital sódico (más de 60 mg/kg). Confirmar la muerte por toracotomía.
- Identificar la cabeza humeral y extirparla quirúrgicamente, preservando los tubérculos mayor y menor y todas las inserciones de tejidos blandos. Fijar con paraformaldehído (PFA) al 4% durante 72 h a 4 °C antes de pasar a una solución de ácido etilendiaminotetraacético (EDTA) al 10% durante 1 mes a temperatura ambiente (con cambio de medio cada 72 h) para descalcificar el hueso.
- Después de la descalcificación, someter las muestras a un procesamiento histológico estándar mediante deshidratación graduada con etanol, inclusión en parafina, corte histológico (secciones de 8 μm) y tinción con hematoxilina y eosina (H&E) y soluciones tricrómicas de Masson30,31,32.
- Capture imágenes con un microscopio vertical con un aumento de 10x.
- Realizar la semi-cuantificación de las imágenes tricrómicas de H&E y Masson midiendo el área y el porcentaje de músculo, tejido fibroso y grasa dentro del músculo, como se describió anteriormente33,34 utilizando un software de diseño gráfico de su elección. En este ejemplo, se utiliza el software Adobe Photoshop (https://www.adobe.com).
- Seleccione una región de un color particular que represente un determinado tipo de tejido con la herramienta de varita mágica (el rojo es tejido muscular, el azul es fibrosis y el blanco representa grasa).
- Haga clic en los elementos del menú Seleccionar | Inversa | Guardar selección | Asigne un nombre a la sección.
- Cuente el número de píxeles dentro de la región marcada haciendo clic en los elementos del menú Ventana | Registro de medición | Registrar medición para registrar estos valores de píxel y calcular manualmente el porcentaje de los tipos de tejido seleccionados.
3. Análisis estadístico
- Para los datos histológicos, realice el análisis estadístico utilizando el software analítico de su elección. Realizar una prueba t de Student para la comparación de dos muestras independientes entre el grupo control y el grupo lesionado.
- Exprese los datos como media ± error estándar de la media. Considere un valor de p de <0,05 como estadísticamente significativo.
Resultados
Para evaluar la cronicidad de la patología de CR después de la transección de las unidades músculo-tendinosas SSC, se caracterizó la morfología general del tejido y los cambios celulares mediante evaluación macroscópica y análisis histológico (H&E y tinción tricrómica de Masson, respectivamente), a las 4 semanas después de la lesión (Figura 2, Figura 3 y Figura 4 ). Las imágenes representativas de la morfología del tejido macroscópico mostraron la aparición de tejido blanco similar al tejido adiposo en los músculos SSC lesionados, que estaba ausente en el grupo control (Figura 2). La tinción de H&E confirmó la pérdida de la celularidad y organización muscular, que fue reemplazada por un gran número de adipocitos (espacios vacíos rodeados por bordes delgados de citoplasma que contenían núcleos comprimidos) en los músculos SSC lesionados en relación con el grupo control (Figura 3A).
La evaluación semicuantitativa de las imágenes de H&E mostró un alto grado de adipocitos intramusculares presentes en los músculos SSC lesionados (36,5% ± 8,5%) en relación con el grupo control (0,69% ± 0,18%) (Figura 3B). La tinción tricrómica de Masson también confirmó la atrofia muscular y la disposición desorganizada de las fibras de colágeno en los músculos SSC lesionados en relación con el grupo de control (Figura 4A). La evaluación semicuantitativa de las imágenes tricrómicas de Masson mostró una reducción en la celularidad muscular de los músculos SSC lesionados (41,3% ± 2,6%) en relación con el grupo control (99,2% ± 0,16%) (Figura 4B). Aunque una evaluación semicuantitativa posterior no mostró ninguna diferencia significativa para la formación de tejido fibrótico entre los músculos SSC lesionados (22,3% ± 13,1%) y el grupo control (0,07% ± 0,05%), se observó un alto grado de fibrosis en los músculos SSC lesionados (Figura 4C). En conjunto, la morfología del tejido macroscópico y el análisis histológico mostraron que el músculo-tendón SSC del conejo lesionado exhibía atrofia muscular severa, acumulación de grasa y fibrosis, que son características conocidas de la fisiopatología crónica de la RC.
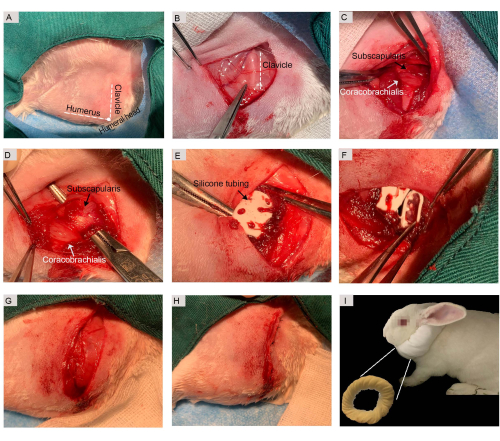
Figura 1: Procedimiento quirúrgico para el modelo de lesión músculo-tendinosa SSC de tipo crónico. (A) Se creó una ventana quirúrgica y se identificaron puntos de referencia anatómicos como el húmero, la cabeza humeral y la clavícula mediante palpación. (B) Se realizó una incisión cutánea de 3,0 cm por debajo de la clavícula. (C) El músculo coracobraquial se dividió para exponer el músculo SSC. (D) Se aisló la unidad músculo-tendinosa del SSC. (E) Se utilizó un drenaje de penrose a base de silicona para envolver el tejido músculo-tendinoso SSC. (F) Se seccionó el músculo-tendón SSC. (G) El músculo coracobraquial se reaproximó mediante suturas PGA. (H) La incisión en la piel se cerró con suturas de nylon. (I) Después de la cirugía, a los conejos se les dio un collar suave para que lo usaran. Abreviaturas: SSC = subescapular; PGA = ácido poliglicólico. Haga clic aquí para ver una versión más grande de esta figura.
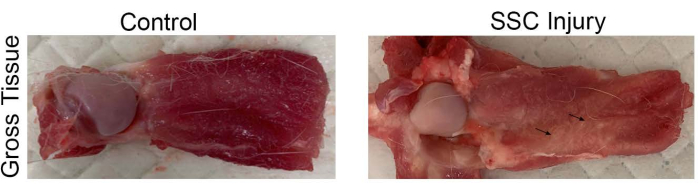
Figura 2: Morfología macroscópica de los músculos representativos de la CSE. Las flechas negras representan tejidos adiposos blancos. Abreviatura: SSC = subescapular. Haga clic aquí para ver una versión más grande de esta figura.
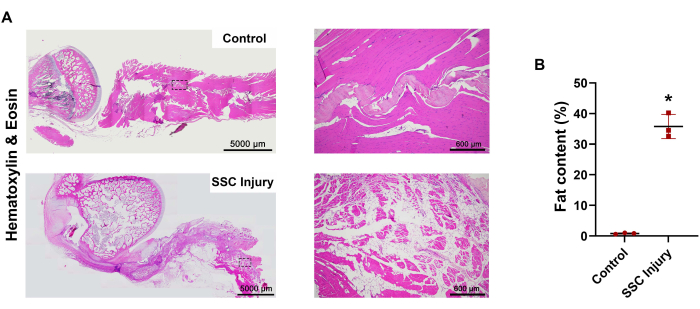
Figura 3: Análisis histológico del modelo de lesión crónica de RC a las 4 semanas. (A) Las imágenes histológicas representativas teñidas con H&E mostraron fibras musculares atróficas y acumulación de adipocitos. (B) Cuantificación del porcentaje de acumulación de grasa muscular lesionada. n = 3 conejos. Las barras de error indican SEM. *, estadísticamente significativo (p≤ 0,05). Barras de escala = 5.000 μm (A, columna izquierda), 600 μm (A, columna derecha). Abreviaturas: SSC = subescapular; RC = manguito rotador; H&E = hematoxilina y eosina. Haga clic aquí para ver una versión más grande de esta figura.
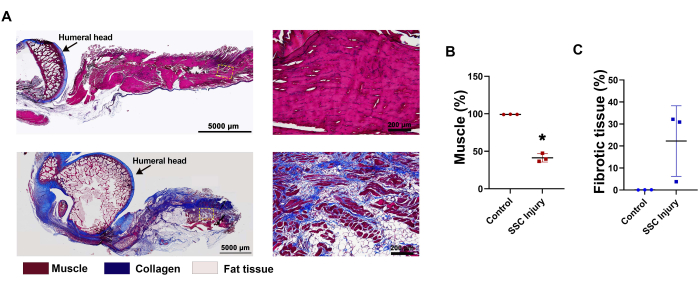
Figura 4: Análisis histológico del modelo de lesión crónica de RC a las 4 semanas. (A) Las imágenes teñidas con tricrómico de Masson mostraron una fibrosis sustancial. El tejido conectivo fibroso se tiñe de azul. (B) Cuantificación de la proporción de tejido muscular y (C) fibrótico. n = 3 conejos. Las barras de error indican SEM. *, estadísticamente significativo (p≤ 0,05). Barras de escala = 5.000 μm (A, columna izquierda), 200 μm (A, columna derecha). Abreviaturas: SSC = subescapular; RC = manguito rotador. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Un modelo animal reproducible y fisiológicamente relevante proporciona la capacidad de avanzar en la comprensión de la patogénesis de la enfermedad, evaluar los resultados de las terapias clínicas y mejorar y desarrollar aún más los tratamientos quirúrgicos35. En este estudio, se estableció un modelo fiable y preciso de CSC de conejo que imita aspectos de la anatomía y fisiopatología de la RC humana. Los desgarros de RC están relacionados con cambios degenerativos musculares progresivos y probablemente irreversibles, lo que resulta en un potencial de curación reducido. Por ejemplo, Ko et al. demostraron que la reinserción de SSP de conejo a las 6 semanas no revirtió la atrofia muscular o la FD en las siguientes 6 semanas. Dicha atrofia muscular mediada por FD influye en varios parámetros clínicos importantes, incluyendo la fuerza tendinosa-muscular y el rango de movimiento articular, lo que puede afectar los resultados quirúrgicos36,37.
El protocolo establecido aquí mostró importantes atributos crónicos después de la transección de las unidades músculo-tendinosas SSC. Específicamente, estos cambios incluyen una disminución visible de la masa muscular y un aumento del contenido adiposo y del tejido fibrótico (Figura 2, Figura 3 y Figura 4). Estos hallazgos son consistentes con los cambios degenerativos reportados en desgarros humanos de RC38. En los últimos años, la rata se ha convertido en uno de los modelos animales más intensamente estudiados para la enfermedad y lesión de RC debido a sus altas similitudes anatómicas con SSP humanos y ratas que viajan bajo el acromion38,39,40. Sin embargo, hay que tener en cuenta que la porción de SSP de rata que pasa por debajo del arco acromial es muscular en lugar de tendinosa, como es el caso de los humanos41. Lo más importante es que Barton et al. reconocieron una falta de acumulación significativa de grasa después del desprendimiento del tendón SSP en ratas23, lo que contrasta con la condición humana42. Como tal, se cree que el complejo SSC de conejo puede proporcionar un modelo apropiado para imitar el desgarro crónico de RC de los humanos.
Para garantizar la reproducibilidad de este modelo, vale la pena señalar dos puntos a la hora de realizar este protocolo. En primer lugar, después de la transección de las unidades músculo-tendinosas, el extremo libre del tendón seccionado puede estar en riesgo de formar adherencias, lo que puede dificultar la recuperación del tendón para manipulaciones posteriores. Para evitar este problema, se utilizó un tubo de silicona no reabsorbible para envolver el extremo libre de la unión músculo-tendón después de la transección para evitar la adhesión espontánea a los tejidos circundantes, así como la cicatrización espontánea (Figura 1E). Además, la unidad músculo-tendinosa seccionada durante un segundo procedimiento para la intervención (es decir, para realizar una reparación segura; los datos no se muestran) se puede identificar claramente envolviendo el extremo de los tejidos lesionados en el momento de la cirugía inicial. Esta técnica es económica, efectiva y puede ser fácilmente implementada en cirugía43. En segundo lugar, los conejos son una especie muy sensible que puede exhibir un comportamiento perjudicial después de la cirugía. Para evitar estos problemas, se recomienda encarecidamente que también se aplique un collarín blando para evitar comportamientos no deseados, como la automutilación, el lamido de los sitios quirúrgicos y la extracción de suturas (Figura 1I). En comparación con los collares electrónicos comercialmente convencionales que están hechos de plástico rígido, el collar blando de fabricación propia no causó ninguna lesión en la piel u otros efectos secundarios que afectaran el bienestar animal o la calidad de la investigación científica. En conjunto, estos pasos son fundamentales para crear un modelo de lesión RC de conejo reproducible con precisión y brindan la posibilidad de estudiar las estrategias de reparación regenerativa.
Para estudiar la fisiopatología y la curación de los tendones en un modelo animal, se debe crear una lesión distinta y reproducible, y los puntos de tiempo de estudio deben seleccionarse cuidadosamente. La gran mayoría de los estudios sobre la lesión y cicatrización de los tendones se han realizado en tendones de animales completamente seccionados44, ya que la transección es un procedimiento sencillo, altamente reproducible y capaz de simular adecuadamente el escenario clínico45,46. Huegel et al. demostraron que la lesión de un tendón parcialmente seccionado era menos grave que la de un tendón completamente seccionado, y la inmovilización tenía un efecto perjudicial sobre la mecánica del tendón, incluido el aumento de la rigidez articular47. Para evaluar la atrofia y la FD que se observa en el contexto de un desgarro masivo de RC, es esencial definir los puntos de tiempo característicos observados experimentalmente. Gupta et al. han validado un modelo de lesión por RC en el conejo macho y han observado atrofia muscular a las 2 y 6 semanas, con un aumento del contenido de grasa en los momentos posteriores (menos del 5% de contenido de grasa a las 2 semanas frente a más del 10% de contenido de grasa a las 6 semanas), en consonancia con el proceso patológico observado en los desgarros humanosde RC 11. En este estudio, se creó un desgarro masivo de RC por la transección de la unidad músculo-tendón SSC en conejos machos y hembras durante 4 semanas, lo que resultó en FD muscular SSC (36,5% de contenido de grasa). Por lo tanto, un punto de tiempo de 4 semanas es apropiado para generar FD muscular SSC en conejos blancos machos y hembras de Nueva Zelanda.
Existen varias limitaciones para este estudio. Estos incluyen: (i) pasos asociados con la generación de modelos animales, como un punto de tiempo relativamente corto y materiales potencialmente inflamatorios (tubo de Penrose a base de silicona) para la generación de lesiones crónicas; (ii) caracterización y análisis de modelos animales, como la falta de análisis de la marcha y electromiografía para evaluar la cinemática articular y la generación de fuerza contráctil muscular; y (iii) comparación de modelos animales, como la falta de comparación con otros sitios de lesión de RC.
En cuanto a la generación de modelos, las lesiones por RC en humanos suelen implicar atrofia progresiva y DF que pueden producirse a lo largo de varios años, lo que es relativamente más largo que el punto de tiempo de 4 semanas que se informa aquí. Esto se considera aceptable, ya que un modelo animal que genera alrededor del 36,5% de grasa intramuscular en un período de tiempo relativamente corto será logísticamente conveniente y puede prolongarse si se considera necesario. Además, la biocompatibilidad de los implantes a base de silicona, como el tubo de Penrose, ha sido una fuente de controversia de larga data debido a los informes de respuesta inmune celular e inflamación47; por lo tanto, se puede sustituir un material inerte alternativo, como el polietilenglicol (PEG), para envolver el tendón resecado si se realizan estudios de RC asociados a la inflamación.
En cuanto a la caracterización y análisis de modelos animales, la falta de análisis de la marcha49 y de estudios electromiográficos50 puede limitar los hallazgos del estudio a datos histológicos cualitativos. Estos aspectos pueden abordarse en futuros estudios mediante el uso del análisis de movimientode vídeo 51 y la electromiografía de superficie50 para generar datos cuantitativos sobre la cinemática del hombro y el rendimiento muscular del RC.
En cuanto a la comparación de modelos, dado que los tendones SSP e infraespinoso de los conejos también se han utilizado ampliamente para los estudios de RC, la comparación de la gravedad de la lesión, incluida la DF, entre estos diferentes sitios de lesión en el futuro, identificará sitios adicionales para la optimización del modelo.
En resumen, este estudio ha desarrollado un protocolo para modelar lesiones crónicas de RC en conejos machos y hembras. Este modelo es conveniente para los investigadores debido a su simplicidad (transección) y período relativamente corto para inducir cronicidad (4 semanas) y generar un alto grado (36,5%) de DF intramuscular. Como tal, se espera que este protocolo ayude a los investigadores en el estudio de la fisiopatología de la RC, así como que facilite el desarrollo de nuevas terapias para la reparación y regeneración músculo-tendinosa.
Divulgaciones
Los autores no tienen intereses contrapuestos que declarar.
Agradecimientos
La investigación de Dai Fei Elmer Ker cuenta con el apoyo financiero de la Oficina de Alimentación y Salud, RAE de Hong Kong (Fondo de Investigación, Médica y de Salud: 08190466), la Comisión de Innovación y Tecnología, RAE de Hong Kong (Premio de Nivel 3: ITS/090/18; Health@InnoHK programa), el Consejo de Becas de Investigación de Hong Kong, la RAE de Hong Kong (Premio al Programa de Carrera Temprana: 24201720 y Fondo General de Investigación: 14213922) y la Universidad China de Hong Kong (Premio a la Innovación de la Facultad: FIA2018/A/01). La investigación de Dan Wang cuenta con el apoyo financiero de la Oficina de Alimentos y Salud, RAE de Hong Kong (Fondo de Investigación, Médica y de Salud, 07180686), la Comisión de Innovación y Tecnología, RAE de Hong Kong (Premio de Nivel 3: ITS/333/18; Health@InnoHK y el Consejo de Becas de Investigación de Hong Kong, RAE de Hong Kong (Fondo General de Investigación: 14118620 y 14121121).
Materiales
| Name | Company | Catalog Number | Comments |
| Surgical tools | |||
| 4-0 Poly glycolic acid (PGA) | e-Sutures | GBK884 | |
| Toothed Adson forceps | Taobao, China | ||
| Fine scissors | Taobao, China | ||
| Hemostatic forceps | Taobao, China | ||
| Needle holders | Taobao, China | ||
| Surgical scalpel with handle | Taobao, China | No. 11 blade | |
| Suture (4-0 Nylon) | Taobao, China | 19054 | Either nylon or silk sutures are acceptable for skin closure. Each suture has its own advantages and disadvantages and users are advised to choose one according to their preference. |
| Surgical accessories | |||
| Cotton balls | Taobao, China | ||
| Gauze | Taobao, China | ||
| Razor | Taobao, China | ||
| Surgical heating pad | Taobao, China | ||
| Surgical lamp | |||
| Syringe with needles | Taobao, China | 1 mL, 5 mL, 10 mL | |
| Drugs | |||
| Buprenorphine | LASEC, CUHK | 0.12 mg/kg | |
| Bupivacaine | Sigma-Aldrich | b5274-5g | 1-2 mg/kg |
| Cephalexin | Santa Cruz Biotechnology | sc-487556 | 20 mg/kg |
| Ketamine | LASEC, CUHK | 35 mg/kg | |
| Sodium pentobarbital | LASEC, CUHK | more than 60 mg/kg | |
| Xylazine | LASEC, CUHK | 5 mg/kg | |
| Equipment | |||
| Nikon Ni-U Eclipse Upright Microscope | Nikon Instruments Inc, USA | ||
| Software | |||
| Adobe Photoshop 20.01 | Adobe Inc, USA | ||
| Other reagents | |||
| Betadine | Taobao, China | 5% | |
| Ethanol | Taobao, China | 70% | |
| Ethylene diamine tetraacetic acid (EDTA) | Sigma-Aldrich | EDS-1KG | 10% |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15713 | 4% |
| Silicone tubing | Easy Thru, China | ISO13485 | |
| Saline | Taobao, China | ||
| Histological staining reagents | |||
| Eosin Stain Solution | Sigma-Aldrich | R03040 | 5% Aqueous |
| Hematoxylin Solution | Sigma-Aldrich | HHS32 | |
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15 |
Referencias
- Goutallier, D., Postel, J. -M., Bernageau, J., Lavau, L., Voisin, M. -C. Fatty muscle degeneration in cuff ruptures. Pre-and postoperative evaluation by CT scan. Clinical Orthopaedics and Related Research. 304 (304), 78-83 (1994).
- Itoigawa, Y., Kishimoto, K. N., Sano, H., Kaneko, K., Itoi, E. Molecular mechanism of fatty degeneration in rotator cuff muscle with tendon rupture. Journal of Orthopaedic Research. 29 (6), 861-866 (2011).
- Mal Kim, H., et al. Relationship of tear size and location to fatty degeneration of the rotator cuff. The Journal of Bone and Joint Surgery. American Volume. 92 (4), 829-839 (2010).
- Melis, B., DeFranco, M. J., Chuinard, C., Walch, G. Natural history of fatty infiltration and atrophy of the supraspinatus muscle in rotator cuff tears. Clinical Orthopaedics and Related Research. 468 (6), 1498-1505 (2010).
- Li, K., Zhang, X., Wang, D., Tuan, R. S., Ker, D. F. E. Synergistic effects of growth factor-based serum-free medium and tendon-like substrate topography on tenogenesis of mesenchymal stem cells. Biomaterials Advances. , 146(2023).
- Derwin, K. A., Baker, A. R., Codsi, M. J., Iannotti, J. P. Assessment of the canine model of rotator cuff injury and repair. Journal of Shoulder and Elbow Surgery. 16, S140-S148 (2007).
- Grumet, R. C., Hadley, S., Diltz, M. V., Lee, T. Q., Gupta, R. Development of a new model for rotator cuff pathology: The rabbit subscapularis muscle. Acta Orthopaedica. 80 (1), 97-103 (2009).
- Renström, P., Johnson, R. J. Overuse injuries in sports. Sports Medicine. 2 (5), 316-333 (1985).
- Hertel, R., Lambert, S. M. Supraspinatus rupture at the musculotendinous junction. Journal of Shoulder and Elbow Surgery. 7 (4), 432-435 (1998).
- Oh, J. H., Chung, S. W., Kim, S. H., Chung, J. Y., Kim, J. Y. Neer Award: Effect of the adipose-derived stem cell for the improvement of fatty degeneration and rotator cuff healing in rabbit model. Journal of Shoulder and Elbow Surgery. 23 (4), 445-455 (2013).
- Gupta, R., Lee, T. Q. Contributions of the different rabbit models to our understanding of rotator cuff pathology. Journal of Shoulder and Elbow Surgery. 16, S149-S157 (2007).
- Otarodifard, K., Wong, J., Preston, C. F., Tibone, J. E., Lee, T. Q. Relative fixation strength of rabbit subscapularis repair is comparable to human supraspinatus repair at time 0. Clinical Orthopaedics and Related Research. 472 (8), 2440-2447 (2014).
- Liu, X., Manzano, G., Kim, H. T., Feeley, B. T. A rat model of massive rotator cuff tears. Journal of Orthopaedic Research. 29 (4), 588-595 (2011).
- Liu, X., et al. A mouse model of massive rotator cuff tears. The Journal of Bone and Joint Surgery. American Volume. 94 (7), 41(2012).
- Neer,, et al. Award 2007: Reversion of structural muscle changes caused by chronic rotator cuff tears using continuous musculotendinous traction. An experimental study in sheep. Journal of Shoulder and Elbow Surgery. 18 (2), 163-171 (2009).
- Warner, J. J., Parsons, I. M. Latissimus dorsi tendon transfer: A comparative analysis of primary and salvage reconstruction of massive, irreparable rotator cuff tears. Journal of Shoulder and Elbow Surgery. 10 (6), 514-521 (2001).
- Galatz, L. M., Ball, C. M., Teefey, S. A., Middleton, W. D., Yamaguchi, K. The outcome and repair integrity of completely arthroscopically repaired large and massive rotator cuff tears. The Journal of Bone and Joint Surgery. American. 86 (2), 219-224 (2004).
- Kim, H. M., Galatz, L. M., Lim, C., Havlioglu, N., Thomopoulos, S. The effect of tear size and nerve injury on rotator cuff muscle fatty degeneration in a rodent animal model. Journal of Shoulder and Elbow Surgery. 21 (7), 847-858 (2012).
- Carpenter, J. E., Thomopoulos, S., Flanagan, C. L., DeBano, C. M., Soslowsky, L. J. Rotator cuff defect healing: A biomechanical and histologic analysis in an animal model. Journal of Shoulder and Elbow Surgery. 7 (6), 599-605 (1998).
- Jal Soslowsky, L., et al. Rotator cuff tendinosis in an animal model: Role of extrinsic and overuse factors. Annals of Biomedical Engineering. 30 (8), 1057-1063 (2002).
- Thomopoulos, S., et al. The localized expression of extracellular matrix components in healing tendon insertion sites: An in situ hybridization study. Journal of Orthopaedic Research. 20 (3), 454-463 (2002).
- Su, W., et al. Effect of suture absorbability on rotator cuff healing in a rabbit rotator cuff repair model. The American Journal of Sports Medicine. 46 (11), 2743-2754 (2018).
- Barton, E. R., Gimbel, J. A., Williams, G. R., Soslowsky, L. J. Rat supraspinatus muscle atrophy after tendon detachment. Journal of Orthopaedic Research. 23 (2), 259-265 (2005).
- Gerber, C., Meyer, D. C., Schneeberger, A. G., Hoppeler, H., von Rechenberg, B. Effect of tendon release and delayed repair on the structure of the muscles of the rotator cuff: An experimental study in sheep. The Journal of Bone and Joint Surgery. American Volume. 86 (9), 1973-1982 (2004).
- Gerber, C., Schneeberger, A. G., Perren, S. M., Nyffeler, R. W. Experimental rotator cuff repair. A preliminary study. The Journal of Bone and Joint Surgery. American Volume. 81 (9), 1281-1290 (1999).
- Hal Coleman, S., et al. Chronic rotator cuff injury and repair model in sheep. The Journal of Bone and Joint Surgery. American Volume. 85 (12), 2391-2402 (2003).
- Turner, A. S. Experiences with sheep as an animal model for shoulder surgery: strengths and shortcomings. Journal of Shoulder and Elbow Surgery. 16, S158-S163 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder MA, Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Cooper, C. S., Metcalf-Pate, K. A., Barat, C. E., Cook, J. A., Scorpio, D. G. Comparison of side effects between buprenorphine and meloxicam used postoperatively in Dutch belted rabbits (Oryctolagus cuniculus). Journal of the American Association for Laboratory Animal Science. 48 (3), 279-285 (2009).
- Eal Ker, D. F., et al. Functionally graded, bone-and tendon-like polyurethane for rotator cuff repair. Advanced Functional Materials. 28 (20), 1707107(2018).
- Toumi, H., et al. Regional variations in human patellar trabecular architecture and the structure of the proximal patellar tendon enthesis. Journal of Anatomy. 208 (1), 47-57 (2006).
- Noor, R. A. M., Shah, N. S. M., Zin, A. A. M., Sulaiman, W. A. W., Halim, A. S. Disoriented collagen fibers and disorganized, fibrotic orbicularis oris muscle fiber with mitochondrial myopathy in non-syndromic cleft lip. Archives of Oral Biology. 140, 105448(2022).
- Wang, D., et al. Growth and differentiation factor-7 immobilized, mechanically strong quadrol-hexamethylene diisocyanate-methacrylic anhydride polyurethane polymer for tendon repair and regeneration. Acta Biomaterialia. 154, 108-122 (2022).
- Wang, D., et al. Combinatorial mechanical gradation and growth factor biopatterning strategy for spatially controlled bone-tendon-like cell differentiation and tissue formation. NPG Asia Materials. 13 (1), (2021).
- Kuyinu, E. L., Narayanan, G., Nair, L. S., Laurencin, C. T. Animal models of osteoarthritis: Classification, update, and measurement of outcomes. Journal of Orthopaedic Surgery and Research. 11, (2016).
- Safran, O., Derwin, K. A., Powell, K., Iannotti, J. P. Changes in rotator cuff muscle volume, fat content, and passive mechanics after chronic detachment in a canine model. The Journal of Bone and Joint Surgery. American. 87 (12), 2662-2670 (2005).
- Gerber, C., Fuchs, B., Hodler, J. The results of repair of massive tears of the rotator cuff. The Journal of Bone and Joint Surgery. American Volume. 82 (4), 505-515 (2000).
- Longo, U. G., Berton, A., Khan, W. S., Maffulli, N., Denaro, V. Histopathology of rotator cuff tears. Sports Medicine and Arthroscopy Review. 19 (3), 227-236 (2011).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. Journal of Shoulder and Elbow Surgery. 7 (4), 375-380 (1998).
- Soslowsky, L. J., Carpenter, J. E., DeBano, C. M., Banerji, I., Moalli, M. R. Development and use of an animal model for investigations on rotator cuff disease. Journal of Shoulder and Elbow Surgery. 5 (5), 383-392 (1996).
- Rowshan, K., et al. Development of fatty atrophy after neurologic and rotator cuff injuries in an animal model of rotator cuff pathology. The Journal of Bone and Joint Surgery. 92 (13), 2270-2778 (2010).
- Gladstone, J. N., Bishop, J. Y., Lo, I. K., Flatow, E. L. Fatty infiltration and atrophy of the rotator cuff do not improve after rotator cuff repair and correlate with poor functional outcome. The American Journal of Sports Medicine. 35 (5), 719-728 (2007).
- Chen, W. F., Kim, B. -S., Lin, Y. -T. Penrose drain interposition-A novel approach to preventing adhesion formation after tenolysis. The Journal of Hand Surgery. Asian-Pacific Volume. 27 (1), 174-177 (2022).
- Lui, P. P. Y. Stem cell technology for tendon regeneration: Current status, challenges, and future research directions. Stem Cells and Cloning: Advances and Applications. 8, 163-174 (2015).
- Howell, K., et al. Novel model of tendon regeneration reveals distinct cell mechanisms underlying regenerative and fibrotic tendon healing. Scientific Reports. 7, 45238(2017).
- Sharma, P., Maffulli, N. Tendinopathy and tendon injury: The future. Disability and Rehabilitation. 30 (20-22), 1733-1745 Forthcoming.
- Huegel, J., et al. Quantitative comparison of three rat models of Achilles tendon injury: A multidisciplinary approach. Journal of Biomechanics. 88, 194-200 (2019).
- Pal Heggers, J., et al. Biocompatibility of silicone implants. Annals of Plastic Surgery. 11 (1), 38-45 (1983).
- Liu, Y., et al. Evaluation of animal models and methods for assessing shoulder function after rotator cuff tear: A systematic review. Journal of Orthopaedic Translation. 26, 31-38 (2020).
- Disselhorst-Klug, C., Schmitz-Rode, T., Rau, G. Surface electromyography and muscle force: Limits in sEMG-force relationship and new approaches for applications. Clinical Biomechanics. 24 (3), 225-235 (2009).
- Kwon, D. R., Park, G. -Y., Moon, Y. S., Lee, S. C. Therapeutic effects of umbilical cord blood-derived mesenchymal stem cells combined with polydeoxyribonucleotides on full-thickness rotator cuff tendon tear in a rabbit model. Cell Transplantation. 27 (11), 1613-1622 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados