Method Article
Edición génica de células B primarias de macaco Rhesus
En este artículo
Resumen
Presentamos un método para el cultivo y edición génica de células B primarias de macaco rhesus utilizando CRISPR/Cas9 y virus adenoasociados recombinantes serotipo 6 para el estudio de terapias de células B.
Resumen
Las células B y su progenie son las fuentes de anticuerpos altamente expresados. Sus altas capacidades de expresión de proteínas junto con su abundancia, fácil acceso a través de sangre periférica y facilidad para transferencias adoptivas simples los han convertido en un objetivo atractivo para los enfoques de edición de genes para expresar anticuerpos recombinantes u otras proteínas terapéuticas. La edición de genes de células B primarias de ratón y humano es eficiente, y los modelos de ratón para estudios in vivo han demostrado ser prometedores, pero hasta ahora no se ha demostrado la viabilidad y escalabilidad para modelos animales más grandes. Por lo tanto, desarrollamos un protocolo para editar las células B primarias del macaco rhesus in vitro para permitir tales estudios. Informamos las condiciones para el cultivo in vitro y la edición génica de células B primarias de macaco rhesus a partir de células mononucleares de sangre periférica o esplenocitos utilizando CRISPR / Cas9. Para lograr la integración específica de casetes grandes (<4,5 kb), se incluyó un protocolo rápido y eficiente para preparar el serotipo 6 del virus adenoasociado recombinante como plantilla de reparación dirigida por homología utilizando un vector auxiliar adenoviral autosilenciador habilitado para tetraciclina. Estos protocolos permiten el estudio de posibles terapias de células B en macacos rhesus.
Introducción
Las células B son la base de la inmunidad humoral. Tras la activación por antígeno afín y señales secundarias, las células B ingenuas dan lugar a células B del centro germinal, células B de memoria y células plasmáticas1. Este último es la fuente de los anticuerpos secretados que median las funciones protectoras de la mayoría de las vacunas actualmente disponibles2. Las células plasmáticas se han descrito como fábricas de anticuerpos, ya que secretan grandes cantidades de anticuerpos en el suero, aproximadamente 2 ng / día / célula3, que ascienden a 7-16 g / L de suero, lo que hace que los anticuerpos sean una de las tres proteínas más abundantes en el suero4. Las células B son abundantes en la sangre y, por lo tanto, pueden obtenerse fácilmente e infundirse de nuevo en un individuo.
Estos rasgos han hecho de las células B un objetivo de los esfuerzos de terapia celular para editar genéticamente el receptor de células B (BCR) y expresar anticuerpos ampliamente neutralizantes (bNAbs) contra el virus de la inmunodeficiencia humana (VIH)5,6,7,8,9,10,11,12,13,14,15 y otras proteínas 16, 17,18,19,20,21. Tales enfoques han mostrado potencial en numerosos estudios con ratones in vivo 7,8,10,11,16,22. Sin embargo, aún deben superarse varios obstáculos para la traducción clínica 9,15,23, entre ellos la seguridad, la duración y la magnitud de la eficacia terapéutica, así como la escala a animales más grandes, como los primates no humanos (NHP). De hecho, los PNH, y en particular los macacos rhesus, que tienen una larga historia en la investigación de anticuerpos y VIH24,25, son el modelo más adecuado para probar estos parámetros.
Aquí, desarrollamos protocolos que permiten abordar estos problemas. Hasta la fecha, pocos estudios han intentado cultivar células B de macaco rhesus ex vivo, y solo se ha reportado una selección positiva usando CD20 para la purificación de células B de macaco rhesus26,27,28. Hemos establecido un protocolo para el aislamiento de células B de macaco rhesus intactas por el agotamiento negativo de otros tipos de células. Además, se definen las condiciones de cultivo para la edición génica dirigida de las células B del macaco rhesus. Este protocolo describe el uso de ribonucleoproteínas (RNP) CRISPR / Cas9 y virus adenoasociado recombinante serotipo 6 (rAAV6) como plantilla de reparación dirigida por homología (HDRT) para editar genes cultivados de células B de macaco rhesus. Usando este protocolo, se lograron eficiencias de edición de hasta el 40% con inserciones grandes (~ 1.5 kb). También presentamos un método rápido y rentable para producir rAAV6 utilizando un ayudante adenoviral autosilenciante habilitado para tetraciclina29 para permitir la prueba rápida de HDRT en este formato. Combinados, estos protocolos describen un flujo de trabajo eficiente para la edición génica de células B de macaco rhesus (Figura 1), lo que permite la evaluación de terapias de células B en un modelo NHP.
Para comenzar los experimentos, el material del donante puede solicitarse de fuentes comerciales u obtenerse mediante flebotomías o esplenectomías. En este estudio, las flebotomías y las colecciones de sangre se realizaron como se describió anteriormente30 utilizando el anticoagulante EDTA. Para obtener células B esplénicas, primarias de macaco rhesus, se realizaron esplenectomias parciales (25%-50%) o totales, utilizando técnicas reportadas anteriormente31. Los animales fueron ayunados durante la noche antes de la cirugía. Brevemente, durante la cirugía, el abdomen fue recortado y preparado con exfoliantes alternos de clorhexidina y alcohol isopropílico al 70% tres veces. Se realizó una incisión (5-10 cm) en el abdomen para identificar y aislar el bazo. La vasculatura del bazo se ligó con suturas o pinzas vasculares. La incisión se cerró en dos capas con 4-0 suturas de polidioxanona PDS. La esplenectomía se realizó una sola vez para un animal individual. Las suspensiones unicelulares se prepararon a partir de bazos de macaco por maceración a través de filtros celulares. Las células mononucleares de la sangre y las suspensiones de células esplénicas se prepararon mediante centrifugación por gradiente de densidad y se almacenaron en nitrógeno líquido.
Protocolo
Todos los procedimientos y experimentos con animales se realizaron de acuerdo con los protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales del Instituto Nacional de Alergias y Enfermedades Infecciosas, Institutos Nacionales de Salud. En la figura 1 se presenta un resumen de los siguientes protocolos. Los macacos rhesus machos y hembras (Macaca mulatta) de origen genético indio de 2 a 8 años de edad fueron alojados y atendidos de acuerdo con las directrices del Comité sobre el Cuidado y Uso de Animales de Laboratorio en una instalación de nivel 2 de bioseguridad.
PRECAUCIÓN: Todos los experimentos se realizaron de acuerdo con las precauciones universales para patógenos transmitidos por la sangre, con técnicas estériles / asépticas y equipos adecuados de nivel 2 de bioseguridad en campanas de flujo laminar.
1. Producción de rAAV6
- Prepare los reactivos para la producción de rAAV6.
- Diseñar y clonar la plantilla de reparación dirigida por homología entre las repeticiones terminales invertidas (ITR) de AAV2 en el vector pAAV utilizando técnicas estándar. Asegúrese de que los brazos de homología sean de al menos ~ 250 pb en cada lado, pero tan poco como 60 pb puede ser suficiente, aunque se prefieren brazos de homología más largos si el diseño de construcción lo permite. Si las secuencias objetivo de cualquiera de los sgRNAs utilizados están presentes en el HDRT, elimínelas utilizando mutaciones silenciosas, que son más efectivas en el motivo adyacente del protoespaciador o la región semilla del sitio objetivo.
NOTA: Se puede realizar la síntesis de genes combinada con el ensamblaje de Gibson para una clonación eficiente32. Preparar un Maxiprep de un clon correcto para la transfección. Para el diseño de sgRNA, se recomienda CHOPCHOP33, y se puede encontrar una lista de más herramientas en https://zlab.bio/guide-design-resources. La capacidad máxima de empaquetado para AAV incluyendo ITRs es ~4.7 kb. AAV6 es el serotipo más comúnmente utilizado para editar células hematopoyéticas, particularmente células B9. No se han probado otros serotipos de AAV para la edición génica de células B de macaco rhesus, pero AAV28 y AAV-DJ10,11 se han utilizado en estudios con ratones. - Preparar el medio de cultivo y el medio de producción 293AAV de acuerdo con la Tabla 1 y la Tabla 2. Filtro estéril a través de una unidad de filtro de membrana de polietersulfona (PES) de 0,2 μm. Conservar a 4 °C.
- Prepare 1x solución de polietilenimina (PEI) (1 mg/ml, 100 ml).
- En un vaso de precipitados de vidrio de 250 ml, caliente ~ 70 ml deH2Oen un microondas durante ~30 s y luego agregue 100 mg de PEI. Agregue un agitador magnético y revuelva hasta que el PEI se disuelva por completo.
- Ajuste el pH a 7 con 1 M HCl, luego rellene hasta 100 ml con H2O, espere 10 minutos, verifique el pH nuevamente y ajuste si es necesario.
- Filtrar estéril la solución de PEI a través de una unidad de filtro de membrana PES de 0,2 μm, alícuota y almacenar a -20 °C. Después de la descongelación, la solución puede conservarse a 4 °C durante un máximo de 2 meses.
- Prepare 5 soluciones de polietilenglicol (PEG)/NaCl.
- Pesar 400 g de PEG 8.000 y 24 g de NaCl.
- Agregue un agitador magnético a un vaso de precipitados de vidrio de 2 L, agregue el PEG 8,000 y NaCl pesados, y enjuague con ~ 550 ml de agua desionizada.
- Revuelva con el calentamiento y lleve a ebullición o 80-90 °C hasta que se disuelva por completo.
- Ajuste el pH a ~7.4 con 1 M NaOH, luego ajuste el volumen a 1 L usando un cilindro de medición y transfiéralo a una botella de vidrio de 2 L con el agitador magnético.
- Autoclave la botella, el agitador magnético y la solución en un baño maría durante 30 min a 121 °C.
- Después del autoclave, enfríe la solución en una cámara frigorífica mientras agita con el agitador magnético para evitar la separación en diferentes fases. Alícuota en caso necesario y conservar a 4 °C.
- Prepare el tampón de formulación.
- Mezclar 500 mL de DPBS con 50 μL de Pluronic F-68 al 10%. Filtro estéril a través de una unidad de filtro de membrana PES de 0,2 μm y almacenar a temperatura ambiente (RT).
- Diseñar y clonar la plantilla de reparación dirigida por homología entre las repeticiones terminales invertidas (ITR) de AAV2 en el vector pAAV utilizando técnicas estándar. Asegúrese de que los brazos de homología sean de al menos ~ 250 pb en cada lado, pero tan poco como 60 pb puede ser suficiente, aunque se prefieren brazos de homología más largos si el diseño de construcción lo permite. Si las secuencias objetivo de cualquiera de los sgRNAs utilizados están presentes en el HDRT, elimínelas utilizando mutaciones silenciosas, que son más efectivas en el motivo adyacente del protoespaciador o la región semilla del sitio objetivo.
- Cultivo celular, transfección y transducción para la producción de rAAV6
- Descongelar, cultivar y congelar células 293AAV según lo descrito por el fabricante utilizando el medio de cultivo 293AAV anterior y tripsina-EDTA para la división. Se recomienda congelar algunos pasajes tempranos y usar las células para la producción de AAV antes de que alcancen el paso 40.
- Para la producción de rAAV6, siembre cuatro placas de cultivo celular de 15 cm con 5 x 106 células en 30 ml cada una. Las células están listas para la transfección generalmente 1-2 días después de la siembra cuando alcanzan el 80% -90% de confluencia.
- Descongele un Maxiprep de plásmido pAAV que contiene el HDRT para ser empaquetado en AAV6. Resuspender 85,6 μg del plásmido pAAV en 3 ml de medio DMEM puro.
- Disuelva 342 μL de 1 mg/ml de solución de PEI en 3 ml de medio DMEM puro. Incubar ambas soluciones durante 10 minutos en RT.
- Mezclar ambos tubos de 3 ml en un tubo de ~6,4 ml de mezcla de transfección, e incubar durante 20 minutos en RT.
- Mientras tanto, descongele el vector auxiliar autosilenciable habilitado para tetraciclina RepCap6 del congelador de -80 °C en un baño de agua a 37 °C. Para transducir las células 293AAV, agregue el vector auxiliar a una multiplicidad de infección (MOI) de 25 utilizando la dosis infecciosa mediana de cultivo tisular (TCID 50) y suponiendo 1.15 x10 7 células/plato; típicamente, se usan 2-10 μL por plato de 15 cm. Mece y agita los platos suavemente para distribuirlos.
- Después de la incubación de la mezcla de transfección, añadir 1,6 ml gota a gota en cada uno de los cuatro platos de 15 cm. Incubar a 37 °C y 5% deCO2 durante la noche.
NOTA: Alternativamente, si los vectores de interés rAAV6 ya están disponibles, estos vectores se pueden usar para proporcionar el genoma viral que se va a empaquetar, lo que niega la necesidad de plásmidos con este sistema y produce títulos de rAAV6 comparables. Para este enfoque, las células 293AAV se cotransducen con el rAAV6 deseado a un MOI de 50 (basado en copias del genoma rAAV6 [GC] / mL) junto con el vector ayudante. - Al día siguiente, aspirar y desechar cuidadosamente el medio de cultivo, y reemplazar con 30 ml de medio de producción precalentado. Incubar durante otras 96 h antes de la cosecha. No se recomienda ningún cambio medio adicional para maximizar los rendimientos.
- Cosecha y purificación del AAV6 recombinante del medio
- Sin desalojar las células del plato, recoja todo el sobrenadante celular en una unidad de filtro con una membrana PES de 0,2 μm al menos un 50% más grande que el volumen de medio a filtrar. Luego, filtre el sobrenadante.
NOTA: Si se desean mayores rendimientos de rAAV6, las células pueden ser cosechadas y el rAAV extraído del pellet celular utilizando kits comerciales o protocolos establecidos34,35. Dado que AAV6 se secreta principalmente en el medio36, solo se usó sobrenadante, reduciendo la mano de obra, el costo y el tiempo. - Agregue 5 veces la solución de PEG/NaCl al sobrenadante filtrado al 25% del volumen recolectado; esto es típicamente 30 ml si se usan cuatro platos de 15 cm de 30 ml.
- Mezclar bien invirtiendo y luego incubar durante la noche a 4 °C para precipitar las partículas virales.
NOTA: Las partículas de AAV son estables hasta por 2 días en esta solución. - Preenfríe una centrífuga de cubo oscilante con 250 ml de insertos de tubo a 4 °C. Preparar una unidad de filtro centrífugo de 4 ml con un corte de 100 kDa y un filtro de jeringa PES hidrófilo de 0,22 μm pretratando cada membrana con 2 ml de Pluronic F-68 al 10% durante al menos 1 h en RT.
- Transfiera la mezcla AAV-PEG/NaCl a un tubo de 250 ml, centrifugar a 2.500 x g durante 1 h a 4 °C y, a continuación, retirar con cuidado todo el sobrenadante por aspiración.
- Resuspender el pellet viral beige a blanco mediante vórtice en 4 mL de 1 M HEPES hasta que esté completamente resuspendido. Si es necesario, déjelo reposar durante 5 minutos y vuelva a voráctel. Resuspender con una pipeta serológica de 5 ml y transferir el volumen total a un tubo de 15 ml.
- En una campana extractora, agregue un volumen igual de cloroformo a la suspensión del virus, típicamente 4 ml.
- Vigorosamente vórtice durante 2 min, y luego centrifugar a 1.000 x g durante 5 min a RT.
- Recoja la capa superior (sobrenadante que contiene AAV) en un tubo nuevo de 50 ml y deseche la capa inferior (cloroformo).
PRECAUCIÓN: Las soluciones que contienen cloroformo son residuos peligrosos. Seguir las directrices institucionales para su eliminación. - Coloque el sobrenadante que contiene AAV debajo de una campana extractora y deje que el cloroformo restante se evapore durante 30 minutos.
- Mientras tanto, lave la unidad de filtro centrífugo pretratado y el filtro de la jeringa.
- Agregue 1.5 ml de tampón de formulación a la unidad de filtro centrífugo pretratada. Centrífuga a 3.500 x g durante 10 min a 15 °C en un rotor de cangilón oscilante. Repita este paso con 4 ml de tampón de formulación para lavar la membrana.
- Enjuague el filtro de la jeringa dos veces con 5 ml de tampón de formulación con una jeringa de 5 ml.
- Cargue los ~4 ml de sobrenadante que contiene AAV de la extracción con cloroformo en una jeringa de 5 ml, conecte el filtro de la jeringa lavada y filtre directamente en la unidad de filtro centrífugo.
- Centrifugar a 3.500 x g durante 25 min a 15 °C, y luego confirmar que la solución AAV en el filtro está entre 50-100 μL. Si el volumen de la solución es >100 μL, continúe centrifugando.
- Después de retirar el filtrado, agregue 4 ml de tampón de formulación dentro de la taza de la unidad de filtro centrífugo y mezcle la solución uniformemente mediante pipeteo. Centrifugar a 3.500 x g durante 25 min a 15 °C, y luego confirmar que la solución AAV en el filtro está entre 50-100 μL. Si el volumen de la solución es >100 μL, continúe centrifugando. Repita este paso para otro lavado.
- Después de la centrifugación final, confirme que el volumen de la solución es de 50-70 μL; Si no, continúe centrifugando. Transfiera la preparación a un tubo de 1,5 ml. Alícuota si lo desea, y conservar a −80 °C.
- Sin desalojar las células del plato, recoja todo el sobrenadante celular en una unidad de filtro con una membrana PES de 0,2 μm al menos un 50% más grande que el volumen de medio a filtrar. Luego, filtre el sobrenadante.
- Determinación del título AAV6 recombinante por qPCR
NOTA: Los cebadores qPCR se reproducen en la región ITR y, por lo tanto, deben ser adecuados para todas las construcciones clonadas en pAAV.- Descongelar una alícuota del rAAV6 que se va a valorar y una alícuota del material de referencia AAV6. El material de referencia AAV6 debe estar cerca de 4 x 1011 GC/mL; de lo contrario, ajuste las diluciones en consecuencia.
- Realice una digestión de DNasa I para eliminar cualquier resto de ADN plásmido libre en la preparación de rAAV6 combinando 2.0 μL de la muestra o material de referencia AAV6 con 15.6 μL deH2Olibre de nucleasa, 2.0 μL de tampón DNasa I 10x y 0.4 μL de DNasa I.
- Mezclar suavemente e incubar durante 30 minutos a 37 °C, y luego transferir al hielo. Esta es la dilución 1 (ver Tabla 3).
- Preparar diluciones en serie quíntuples de todas las muestras y del material de referencia AAV6 como se indica en la Tabla 3 a continuación con agua.
- Prepare una mezcla maestra de qPCR SYBR Green. Por pozo, mezclar 4,7 μL de agua libre de nucleasas con 10 μL de mezcla maestra SYBR Green, 0,15 μL de cebador ITR hacia adelante a 100 μM y 0,15 μL de cebador ITR inverso a 100 μM.
NOTA: Cada muestra se mide por duplicado, con 16 pozos para el estándar de referencia, 8 pozos por muestra y 2 pozos para un control sin plantilla. Prepare un 10% más de mezcla maestra para tener en cuenta el error de pipeteo. - En una placa de reacción óptica de 96 o 384 pocillos, cargue 15 μL/pocillo de la mezcla maestra de qPCR SYBR Green.
- A continuación, cargue 5 μL de muestras y material de referencia AAV6 o agua libre de nucleasas para el control sin plantilla. Para el estándar de referencia AAV6, carga dilución 2 a dilución 9. Para las muestras, carga dilución 5 a dilución 8. Mida cada dilución por duplicado. Evita las burbujas.
- Selle la placa cargada con una película óptica transparente, centrifugar a 800 x g durante 1 minuto a RT y cargar la placa en el instrumento qPCR con la configuración adecuada de 96 o 384 pocillos.
- Configure y ejecute el instrumento qPCR utilizando la detección SYBR con las siguientes condiciones de ciclo: 98 °C durante 3 min, luego 40 ciclos de 98 °C durante 15 s y 58 °C durante 30 s, seguidos de una curva de fusión.
- Analice los datos con el software del instrumento utilizando la concentración del material de referencia AAV6 en copias del genoma por milímetro (GC/mL) como curva estándar (ver Tabla 3). Calcular la concentración final de la muestra multiplicando por el factor de dilución.
- Asegúrese de que la curva estándar R2 esté cerca de 1.0, la eficiencia de PCR sea del 90% -110%, se haya eliminado la línea de base, la curva de fusión muestre un solo pico, los valores de C t cambien de acuerdo con las diluciones y los duplicados estén dentro de 0.5 Ct; de lo contrario, excluya los valores atípicos. Espere rendimientos como en la Figura 2.
2. Preparación de medios y estímulos de células B
- Preparar medio de descongelación: Combine RPMI-1640 con 20% FCS. Filtro estéril a través de una unidad de filtro de membrana PES de 0,2 μm. Conservar a 4 °C.
- Preparar el medio de cultivo de células B: Combine los reactivos de la Tabla 4 y luego el filtro estéril a través de una unidad de filtro de membrana PES de 0,2 μm. Conservar a 4 °C.
- Resuspender cada uno de los estimulantes de células B de la Tabla 5 a concentraciones madre en medio de cultivo de células B, excepto CpG ODN, que debe resuspenderse en agua libre de nucleasas. Conservar a -80 °C.
- Si realiza una depleción negativa de células no B (paso opcional 4), prepare DPBS (sin calcio, sin magnesio) con FCS al 2% (DPBS 2% FCS). Filtro estéril a través de una unidad de filtro de membrana PES de 0,2 μm. Conservar a 4 °C.
3. Preparación y cultivo de células B de macaco rhesus
NOTA: Se utilizan PBMCs o esplenocitos de macaco rhesus criopreservados para configurar el cultivo celular30,31.
- Precaliente el medio de descongelación y los medios de cultivo de células B en un baño maría a 37 °C. Descongele los estimulantes de células B de la Tabla 5 en hielo.
- Prepare un tubo del tamaño adecuado que contenga un medio de descongelación precalentado. Idealmente, esto debería ser más de 10 veces el volumen de las células descongeladas.
- Descongele uno o dos crioviales de PBMC o esplenocitos a la vez en un baño de agua a 37 °C, y decanten en el tubo preparado con medio precalentado. Enjuague los criotubos para recoger todas las células.
- Centrifugar las células a 200 x g durante 10 min en RT.
NOTA: Estos ajustes de centrifugación reducen la contaminación plaquetaria al tiempo que preservan los rendimientos de PBMC. Se pueden usar velocidades más altas, como 350 x g durante 5 minutos. - Resuspender las células en medio de descongelación de 10 ml para el lavado.
- Repita los pasos 3.4 y 3.5 para un total de tres centrifugaciones para eliminar el medio de congelación. Después de la última centrifugación, resuspender las células a un estimado de ~5 x 106 células/ml en medio de cultivo de células B.
NOTA: El protocolo anterior cultiva preparaciones enteras de PBMC o esplenocitos con contaminación por otras células. Si se requieren cultivos de células B más puros, aunque con rendimientos totales de células B significativamente reducidos, continúe con el paso 4. No se han observado diferencias en las eficiencias de edición entre los dos métodos. - Diluir una alícuota de 10 μL de células según sea necesario con medio de cultivo de células B para el recuento. Contar con hemocitómetro y tinción de azul de tripano, combinando volúmenes iguales de células resuspendidas y solución de azul de tripano al 0,4%.
- Ajustar la concentración celular a 3 x 106 células/ml con medio de cultivo de células B según el recuento celular. Luego, agregue los estimulantes de células B a sus concentraciones finales de acuerdo con la Tabla 5 y mezcle.
- Transfiera las células a una placa de cultivo celular apropiada. En general, se recomienda 0,6 x 10 6-0,7 x 106 células/cm2. Incubar las células a 37 °C con 5% deCO2 durante 48 h ± 2 h.
4. Agotamiento negativo opcional de células no B
NOTA: El rendimiento y la pureza dependen del porcentaje de entrada de células B entre las PBMC, que puede diferir drásticamente entre los macacos rhesus individuales27. Espere 80% -95% de pureza, 60% de eficiencia y 1 x 10 6-1.5 x 106 celdas de 1 x 107 PBMC.
- Después del último lavado (paso 3.6), resuspender las células a 1 x 108 células/ml en DPBS 2% FCS y Fc-block humano diluido 1:200. Los recuentos de células se basan en el número de células descongeladas.
- Incubar durante 15 minutos en hielo para bloquear los receptores Fc, y luego añadir los anticuerpos biotinilados en la Tabla 6. Incubar durante otros 20 minutos en hielo.
- Rellene el tubo con DPBS 2% FCS y gire a 200 x g durante 10 min a 4 °C.
- Resuspender las células en DPBS 2% FCS al 80% del volumen del paso 4.1 (es decir, 80 μL por 1 x 107 células).
- Agregue perlas magnéticas de estreptavidina a la suspensión celular al 20% del volumen desde el paso 4.1 (es decir, 20 μL de perlas por 1 x 107 células).
- Incubar las células durante 15 minutos en hielo y agitar ocasionalmente.
- Mientras tanto, por 1 x 108 celdas, prepare un separador magnético con una gran columna de agotamiento magnético y un filtro de preseparación. Enjuague el filtro y la columna de preseparación con 2 ml de DPBS 2% FCS por flujo por gravedad, y deseche el flujo continuo. Instale un tubo de recolección de 15 ml.
NOTA: El uso de otras columnas, como columnas de selección positiva u otros sistemas de purificación de perlas magnéticas, puede reducir drásticamente la pureza. - Después de la incubación, rellene las células a 0,5 ml con DPBS 2% FCS si el volumen es <0,5 ml. Si el volumen es ≥0.5 ml, simplemente proceda.
- Cargue la suspensión de la celda en el filtro de preseparación en la columna preparada y recoja el flujo en el tubo de 15 ml.
- Eluya las células B enriquecidas no unidas dos veces agregando 1 ml de DPBS 2% FCS en el filtro de preseparación. Recoger las células no unidas en el mismo tubo por flujo de gravedad.
NOTA: La elución adicional puede aumentar marginalmente el rendimiento. La pureza y la eficiencia pueden evaluarse mediante la citometría de flujo de las células de entrada, las células enriquecidas y las células retenidas en la columna. Para obtener las células retenidas en la columna, retire la columna del imán y enjuague con 3 ml de DPBS 2% FCS utilizando el émbolo provisto. Si se desea, evalúe la pureza por citometría de flujo como en la Figura 3 utilizando los reactivos de la Tabla 7. - Centrifugar las células B enriquecidas a 200 x g durante 10 min a 4 °C.
- Resuspender las células a un estimado de ~5 x 106 células/ml en medio de cultivo de células B y continuar en el paso 3.7.
5. Edición primaria del gen de células B del macaco rhesus
- Después de activar las células B del macaco rhesus durante 48 h ± 2 h, preparar los reactivos para electroporación y transducción.
- Precaliente DMSO, tampón dúplex libre de nucleasa, tampón T y tampón E (kit de electroporación de 10 μL) o E2 (kit de electroporación de 100 μL) desde el kit de electroporación a RT.
- Descongele los estimulantes de células RAAV6 HDRT y B de la Tabla 5 en hielo.
- Resuspender los sgRNAs de CRISPR-Cas9 a 100 μM en tampón dúplex. Reconstituir durante 10 minutos en RT, y mezclar por vórtice y movimiento. Mantenga los sgRNAs reconstituidos en hielo hasta su uso. Conservar a -80 °C.
NOTA: Los sgRNAs de CRISPR-Cas9 se pueden diseñar con varias herramientas en línea (ver 1.1.1) y pueden variar drásticamente en su eficiencia de corte. Se recomienda realizar pruebas empíricas de la eficiencia de corte utilizando ensayos como TIDE37 o ICE38. - Por 10 μL de electroporación, preparar 550 μL de medio de cultivo de células B con todos los estimulantes de la Tabla 5, y añadir DMSO al 1%. Escale los volúmenes 10 veces para electroporaciones de 100 μL. Opcionalmente, el 10% de este medio se puede preparar sin antibiótico-antimicótico, lo que aumenta ligeramente la viabilidad celular después de la transfección.
- Por electroporación de 10 μL, preparar un pocillo de una placa de cultivo celular de 48 pocillos con 50 μL del medio de cultivo de células B con estimulantes y sin antibiótico-antimicótico, si se utiliza. Para electroporaciones de 100 μL, pipetear 500 μL en los pocillos de una placa de 6 pocillos.
- Agregue rAAV6 HDRT al medio en los pozos, hasta el 20% del volumen en el pozo. Apunte a los MOI que van desde 1 x 10 5-1 x 106 según el número de células por transfección (electroporación de 10 μL: 5 x 105 células; electroporación de 100 μL:5 x 106 células) y el GC en la preparación rAAV6. Se recomiendan altas concentraciones madre de rAAV6 de 5 x 1013 GC/ml a 5 x 1014 GC/ml para lograr MOI altos con volúmenes bajos.
NOTA: Los MOI más bajos pueden conducir a una eficiencia de edición reducida, y los MOI de 5 x 105 generalmente están cerca de las eficiencias de edición máximas que hemos visto. No se ha observado una influencia de los MOI variables en la viabilidad de las células B. Se recomienda incluir controles sin rAAV6 HDRT, sin transfección RNP y sin ambos. - Precaliente los platos preparados y el medio restante transfiriéndolos a una incubadora a 37 °C con 5% deCO2.
- Por 10 μL de electroporación, preparar 1,15 μL de ribonucleoproteína (RNP): Mezclar 0,4 μL de 61 μM Cas9 con 0,75 μL de 100 μM sgRNA en tampón dúplex. Preparar extra (se recomienda un 30% más para una sola electroporación) debido al error de pipeteo y para evitar burbujas al cargar las puntas de electroporación. Báscula 10 veces para puntas de 100 μL.
- Incubar el RNP durante al menos 15 minutos en RT antes de mezclarlo con las células. Después de la incubación, se pueden combinar múltiples RNP si se va a dirigir simultáneamente más de un locus. No se han observado diferencias significativas en la eficiencia con hasta tres loci al mismo tiempo.
- Mientras tanto, prepare las células para la electroporación. Mantenga las celdas en RT en todo momento para evitar choques de temperatura. Cosechar las células después de 48 h ± 2 h de cultivo en un recipiente apropiado. Enjuague los platos con DPBS para recoger el número máximo de células.
- Centrifugar las células a 200 x g durante 10 min a RT. Desechar el sobrenadante y resuspender las células en DPBS a ~2 x 106 células/ml.
- Combine 10 μL de solución de azul de tripano al 0,4% con 10 μL de la suspensión celular y cuente con un hemocitómetro.
NOTA: En este punto, debido a la pérdida durante la cosecha y el lavado, espere alrededor del 60% de las células que se pusieron en cultivo 48 h ± 2 horas antes. - Mientras tanto, centrifugar las células a 200 x g durante 10 minutos en RT. Deseche el sobrenadante, asegurándose de minimizar cualquier DPBS restante. Resuspender las células en tampón T precalentado (RT) a 5,55 x 107 células/ml en función del recuento de células anterior.
- Configure el sistema de transfección encendiendo la máquina y ajustándola a 1.350 V, 15 ms y 1 pulso. Coloque la estación de pipetas dentro de la campana de flujo laminar
- Para cada serie de 10 electroporaciones, preparar un tubo de transfección con 3 ml de tampón E (para transfecciones de 10 μL) o E2 (para transfecciones de 100 μL). Inserte el tubo en la estación de pipetas.
- Por 10 μL de electroporación, combinar 1,15 μL de RNP con 9 μL de células. Asegúrese de tener un volumen suficiente (+ 30%) para evitar aspirar aire en la punta de electroporación. Incubar a RT durante 1-2 min antes de la electroporación.
- Aspirar 10 μL o 100 μL de RNP y mezcla celular en la punta de electroporación del tamaño adecuado en una pipeta de electroporación, insertar la pipeta cargada en la estación de pipetas e iniciar la electroporación. Asegúrese de que las puntas estén completamente libres de burbujas de aire para evitar la formación de arcos. Observe durante la electroporación para verificar que no se produzca un arco eléctrico.
- Expulsar inmediatamente las células electroporadas en el pequeño volumen de medio preparado, precalentado con o sin rAAV6 dentro de la placa de 48 pocillos (transfecciones de 10 μL) o de 6 pocillos (transfecciones de 100 μL). Repita los pasos 5.15-5.17 con las muestras restantes. Añadir muestras de control sin transfección a los pocillos de cultivo.
- Incubar las células a 37 °C con 5% deCO2 durante 4 h ± 2 h, y luego añadir el medio de cultivo de células B precalentado preparado que contiene estimulantes, DMSO y antibióticos/antimicóticos: 450 μL para transfecciones de 10 μL o 4,5 ml para transfecciones de 100 μL.
- Continuar la incubación a 37 °C con 5% de CO2 durante12-24 h. Luego, cambie el medio a medio de cultivo de células B que contenga estimulantes y antibióticos/antimicóticos sin DMSO si se desea un cultivo prolongado. El análisis del ADN genómico se puede hacer después de 24 h. La PCR digital de gotas utilizando un cebador fuera del brazo de homología y un cebador dentro del inserto se puede utilizar para cuantificar la eficiencia de edición39. Realice PCR para amplificar el sitio de inserción y secuenciación de Sanger para verificar la edición correcta.
- Para el análisis de los niveles de proteína, cultivar las células durante 40-48 h después de la electroporación para permitir cambios en la expresión de proteínas, y realizar un análisis por citometría de flujo utilizando los reactivos de la Tabla 7.
Resultados
La producción de rAAV6 con el uso del ayudante adenoviral autosilenciante habilitado para tetraciclina dio como resultado la producción de 4 x 1010 GC / ml de medio de cultivo celular en promedio, superando así la producción utilizando una transfección triple estándar sin ayudantes en 30-40 veces (Figura 2).
La purificación opcional de las células B de macaco rhesus resultó en la eliminación de la gran mayoría de las células T CD3 + y las células mieloides CD14 + y / o CD16 +, con purezas de 80% -95% de células B CD20 + que se obtienen rutinariamente (Figura 3). Basándonos en nuestros diseños anteriores en células B murinas7, desarrollamos un método para editar la especificidad del receptor de células B de macaco rhesus mientras mantenemos simultáneamente la exclusión alélica en la gran mayoría de las células B mediante la eliminación de cadenas ligeras de anticuerpos endógenos a través de la interrupción de su región constante. Construimos un HDRT sin promotor para ser insertado en el locus IGH entre el último gen IGHJ y el potenciador Eμ de las células B del macaco rhesus (Figura 4). Esta construcción utiliza el promotor endógeno VH de la región VDJ reorganizada naturalmente aguas arriba en células B maduras y, por lo tanto, no se expresa en los genomas episomales de AAV. Además, esta construcción requiere el empalme en regiones constantes de cadena pesada de anticuerpos aguas abajo que se expresarán en la superficie celular. Por lo tanto, la unión específica del antígeno en la superficie celular mostrada por citometría de flujo indica la integración correcta del locus objetivo y que la secuencia insertada es funcional.
Empaquetamos un anticuerpo codificador de construcción Ab1485, un bNAb40 anti-VIH derivado del macaco rhesus, en rAAV6 y lo usamos para editar cultivos de esplenocitos de macaco rhesus primario activado o PBMC, como se describió anteriormente (Figura 5A). El protocolo mantuvo una alta viabilidad celular (~ 90%) mientras eliminaba simultáneamente la expresión de la cadena ligera en ~ 80% de las células B. La mayoría de las células B todavía expresaban el isotipo IgM (Figura 5B). La adición del rAAV6 que codifica el HDRT Ab1485 dio como resultado la edición de genes y la expresión de la superficie de Ab1485 en el 16% -21% de las células B (Figura 5A), aunque a una intensidad de fluorescencia más baja para las cadenas de anticuerpos que en las células B no editadas (panel derecho de la Figura 5A, Figura 5C). Esto puede ser el resultado de la competencia de epítopos entre la tinción de antígeno y los monoclonales utilizados para detectar la BCR de superficie en la citometría de flujo, así como la expresión de proteínas reducida real debido a la naturaleza policistrónica del HDRT y el empalme menos eficiente. La adición de DMSO al 1% e incubaciones concentradas extendidas con el HDRT rAAV6 generalmente aumentó la eficiencia de edición (Figura 6A-C). Usando este método específico, típicamente 5% -20%, y hasta 40%, la eficiencia de edición se logra dependiendo del macaco rhesus individual (Figura 5A, Figura 6A-E) y la calidad del lote rAAV6 HDRT (Figura 6E). En general, presentamos protocolos para la producción eficiente de rAAV6, así como el cultivo, purificación y edición genética de células B de macaco rhesus.
| Reactivos | Volumen | Acción | Concentración final |
| DMEM, glucosa alta | 500 ml | 1 x | ~ 88.5% |
| FCS, inactivado por calor | 50 ml | 1 x | ~ 8.85% |
| Antibiótico/Antimicótico | 5 ml | 100 x | 1 x |
| Glutamina | 5 ml | 200 mM | 2 mM |
| Piruvato de sodio | 5 ml | 100 mM | 1 mM |
Tabla 1: El medio de cultivo celular 293AAV.
| Reactivos | Volumen | Acción | Concentración final |
| DMEM, glucosa alta | 500 ml | 1 x | ~ 95.2% |
| FCS, inactivado por calor | 10 ml | 1 x | ~ 1.9% |
| Antibiótico/Antimicótico | 5 ml | 100 x | 1 x |
| Glutamina | 5 ml | 200 mM | 2 mM |
| Piruvato de sodio | 5 ml | 100 mM | 1 mM |
Tabla 2: El medio de producción de células 293AAV.
| Serie de dilución | Volumen de la muestra (μL) | Diluyente y volumen | Factor de dilución | Dilución total | Referencia AAV6 |
| GC/ml | |||||
| Dilución 1 | Muestra de 2 μL o patrón de referencia AAV a 4,1 x 1011 GC/ml | Tampón DNAseI de 18 μL y enzima | 10 x | 10 x | 4,1 x 1010 |
| Dilución 2 | 15 μL Dil. 1 | 60 μL H2O | 5 x | 50 x | 8,2 x 109 |
| Dilución 3 | 20 μL Dil. 2 | 80 μL H2O | 5 x | 250 x | 1,6 x 109 |
| Dilución 4 | 20 μL Dil. 3 | 80 μL H2O | 5 x | 1250 x | 3,3 x 108 |
| Dilución 5 | 20 μL Dil. 4 | 80 μL H2O | 5 x | 6250x | 6,6 x 107 |
| Dilución 6 | 20 μL Dil. 5 | 80 μL H2O | 5 x | 31250 x | 1,3 x 107 |
| Dilución 7 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 156250 x | 2,6 x 106 |
| Dilución 8 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 781250 x | 5,24 x 105 |
| Dilución 9 | 20 μL Dil. 7 | 80 μL H2O | 5 x | 3906250 x | 1,05 x 105 |
Tabla 3: tabla de dilución de qPCR.
| Reactivo | Volumen | Acción | Concentración final |
| RPMI-1640 | 420 ml | 1 x | 84% |
| FCS, inactivado por calor | 50 ml | 1 x | 10% |
| Antibiótico/Antimicótico | 5 ml | 100 x | 1 x |
| Glutamina | 5 ml | 200 mM | 2 mM |
| Piruvato de sodio | 5 ml | 100 mM | 1 mM |
| HEPES | 5 ml | 2 . | 10 mM |
| 2-B-mercapto-etanol | 550 μL | 55 mM | 55 μM |
| Aminoácidos no esenciales | 5 ml | 100 x | 1 x |
| Insulina-Transferina-Selenio | 5 ml | 100 x | 1 x |
Tabla 4: Medio de cultivo de células B.
| Reactivo | Dilución | Acción | Concentración final |
| MegaCD40L | 1:1000 | 100 μg/ml | 100 ng/ml |
| CpG ODN | 1:300 | 1 mg/ml | 3,33 μg/ml |
| BAFF humano | 1:1000 | 40 μg/ml | 40 ng/ml |
| IL-2 humana | 1:1000 | 50 μg/ml | 50 ng/ml |
| IL-10 humana | 1:1000 | 50 μg/ml | 50 ng/ml |
Tabla 5: Estimulantes de células B.
| Anticuerpo | Clon | Dilución | Final Conc. |
| CD3 antihumano | FN-18 | 1:40 | 2,5 μg/ml |
| CD8a antihumano | RPA-T8 | 1:200 | 2,5 μg/ml |
| CD14 antihumano | M5E2 | 1:200 | 2,5 μg/ml |
| CD16 antihumano | 3G8 | 1:200 | 2,5 μg/ml |
| CD33 antihumano | AC104.3E3 | 1:50 | 1 prueba |
| CD64 antihumano | 10.1 | 1:800 | 0,625 μg/ml |
| CD66 antihumano | TET2 | 1:11 | 1 prueba |
| CD89 antihumano | A59 | 1:800 | 0,625 μg/ml |
Tabla 6: Anticuerpos para el agotamiento opcional de células no B.
| Reactivo | Tipo/clon | Dilución/concentración de trabajo |
| anti-humano CD14 AlexaFluor647 | M5E2 | 1:50 |
| anti-humano CD16 AlexaFluor700 | 3G8 | 1:50 |
| anti-humano CD20 PECy7 | 2H7 | 1:50 |
| anti-humano CD3 PE | SP34-2 | 1:50 |
| Zombie-NIR | - | 1:500 |
| antihumano HLA-DR BV605 | L243 | 1:200 |
| antihumana Ig cadena ligera lambda APC | MHL-38 | 1:50 |
| antihumano Kappa Light Chain FITC | policlonal | 1:500 |
| antihumana IgM BV421 | MHM-88 | 1:50 |
| Antígeno RC1, biotinilado aleatoriamente | - | 5 μg/ml |
| Estreptavidina-PE | - | 1:500 |
Tabla 7: Reactivos citométricos de flujo para análisis.
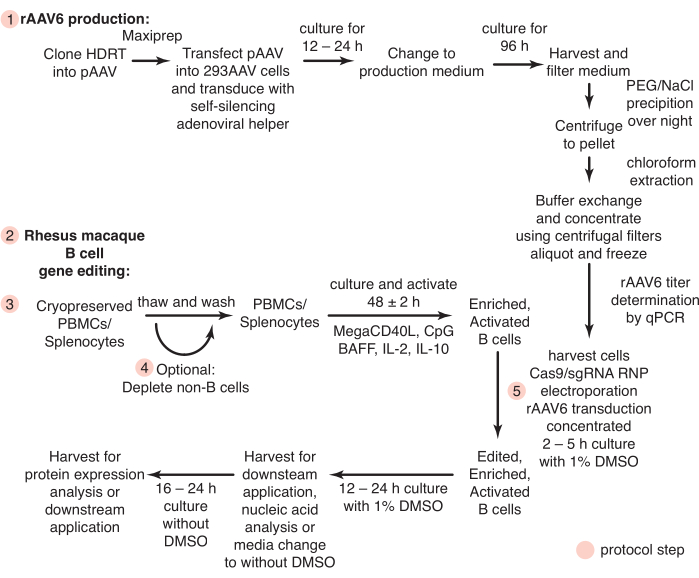
Figura 1: Descripción esquemática de la producción de rAAV6 y la edición génica de las células B primarias del macaco rhesus. Los protocolos se dividen en la producción de rAAV6 (paso 1) y la edición génica de las células B del macaco rhesus (pasos 2-5), incluido un paso opcional para el agotamiento de las células no B (paso 4). Los pasos de los protocolos se indican con círculos rojos. Haga clic aquí para ver una versión más grande de esta figura.
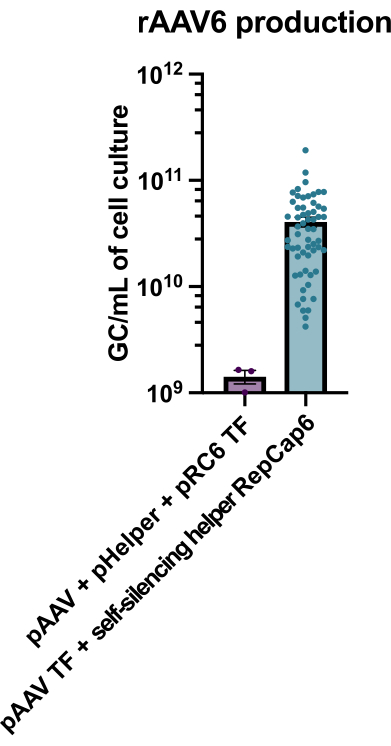
Figura 2: Altos rendimientos de rAAV6 utilizando un ayudante adenoviral autosilenciador. rAAV6 se produjo utilizando los métodos descritos aquí (transfección de pAAV [TF] + ayudante autosilenciador RepCap6, ayudante adenoviral autosilenciante) o transfección triple típica sin ayudante de pAAV, pHelper y pRepCap6 (pRC6). rAAV6 se purificó a partir del sobrenadante celular solamente. Los métodos que utilizaron los vectores auxiliares adenovirales autosilenciantes produjeron 30-40 veces más rAAV titulada por qPCR, como se describió anteriormente. Cada punto representa una producción individual de rAAV utilizando varias construcciones de pAAV de 2 a 20 experimentos independientes. Se representa la media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
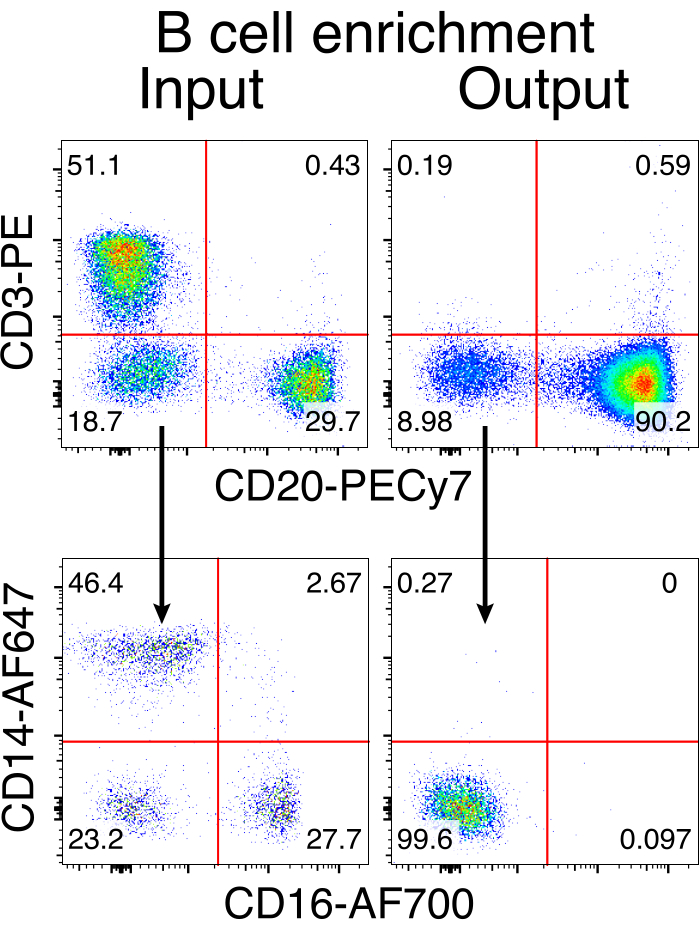
Figura 3: Enriquecimiento de células B por el agotamiento negativo de células no B. Las células B del macaco Rhesus se enriquecieron a partir de PBMC utilizando el protocolo descrito y se enriquecieron con una pureza del 90%. Se muestran la entrada previa al enriquecimiento y la salida después del enriquecimiento. Cerrado en PBMCs singlete en vivo. Representante de cinco experimentos independientes. Haga clic aquí para ver una versión más grande de esta figura.
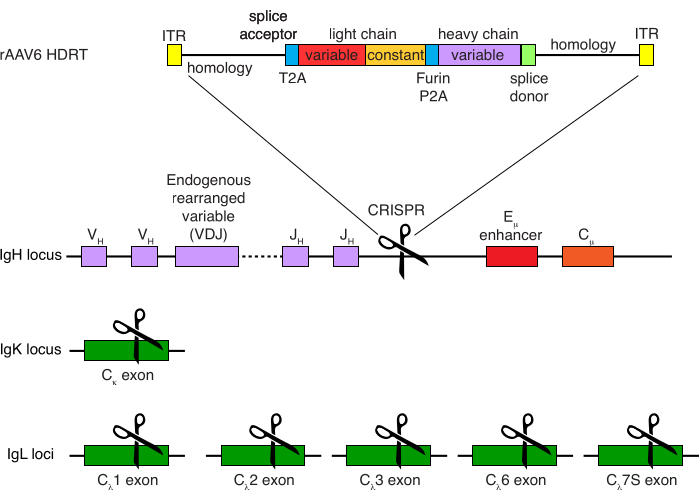
Figura 4: Estrategia de focalización utilizada para editar la especificidad del receptor de células B de macaco rhesus. rAAV6 fue producido que contiene el HDRT representado. El HDRT consiste en un brazo de homología de 266 pb 5', seguido de 111 pb del aceptor de empalme del exón 1 del macaco rhesus IGHM, luego un enlazador GSG con una secuencia peptídica 2A autoescindida del virus Thosea asigna (T2A), seguido de una secuencia líder y la cadena ligera completa del anticuerpo de macaco rhesus Ab1485 como macaco rhesus IGLC1. Esto es seguido por un sitio de escisión de furina, un enlazador GSG y una secuencia peptídica 2A autoescindida del teschovirus porcino (Furin-P2A), seguida de otra secuencia líder y la variable de cadena pesada Ab1485, seguida de 52 pb de la secuencia donante de empalme IGHJ4 del macaco rhesus, para permitir el empalme en regiones constantes de cadena pesada de anticuerpos aguas abajo, y un brazo de homología de 514 pb. Esta construcción se dirigió al locus IGH entre el último gen IGHJ y el potenciador Eμ utilizando la secuencia diana sgRNA GAGATGCCAGAGCAAACCAG. Ambos brazos de homología fueron diseñados para terminar en el sitio de corte de este sgRNA, eliminando así la secuencia objetivo y permitiendo eficiencias de integración óptimas. Simultáneamente, para mantener la exclusión alélica y la expresión de un único receptor de células B, eliminamos cadenas ligeras endógenas utilizando sgRNAs dirigidos al macaco rhesus IGKC con la secuencia diana GGCGGGAAGATGAAGACAGA e IGLC1, IGLC2, IGLC3, IGLC6 e IGLC7S utilizando la secuencia diana CTGATCAGTGACTTCTACCC. El HDRT incluyó mutaciones silenciosas que previenen la escisión de la secuencia IGLC1 por este sgRNA. Haga clic aquí para ver una versión más grande de esta figura.
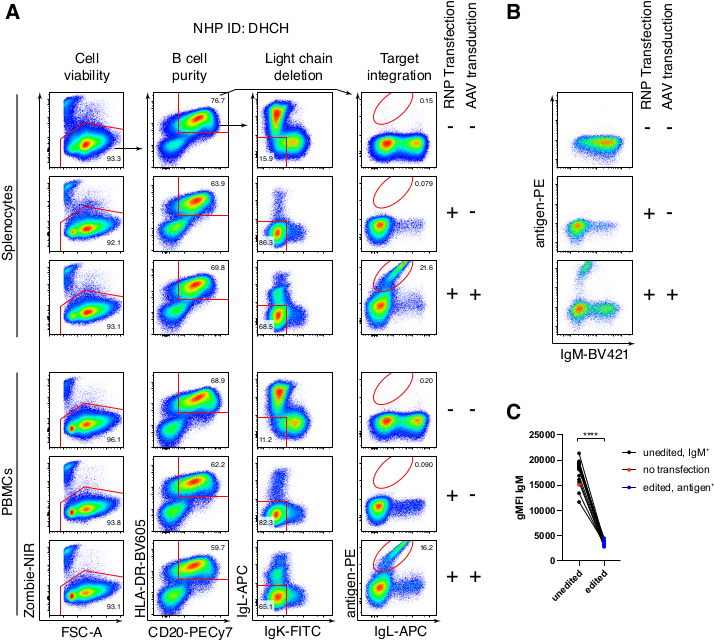
Figura 5: Edición génica de células B primarias de macaco rhesus. (A) Los esplenocitos primarios (panel superior) o PBMC (panel inferior) del mismo macaco rhesus se cultivaron sin el agotamiento de las células no B y se editaron como se describió anteriormente. La estrategia de focalización fue como se muestra en la Figura 4. Dos días después de la electroporación, las células fueron recolectadas y teñidas superficialmente para el análisis citométrico de flujo. La columna izquierda estaba cerrada en celdas singletes, y las otras columnas estaban cerradas, como se indica en la fila superior. La viabilidad de las células, la pureza de las células B, la eficiencia de deleción de las cadenas ligeras y la eficiencia de golpe de Ab1485 mediante tinción con el antígeno específico RC141 se indican en muestras no tratadas, transfectadas con RNP o transfectadas con RNP + transducidas por rAAV6 (MOI = 5 x 105). Representante de seis experimentos independientes con células de diferentes macacos rhesus. (B) expresión de IgM en controles de células B de macaco rhesus cultivadas o después de la edición y (C) intensidad de fluorescencia media geométrica (gMFI) de IgM en células B que no han perdido expresión de Ig debido a la orientación de IgLC e IgKC (sin editar) o células B que se unen al antígeno esperado (editado). El punto rojo indica el gMFI de las células B de control no transfectadas cultivadas. indica p < 0,0001 en una prueba t pareada. Haga clic aquí para ver una versión más grande de esta figura.
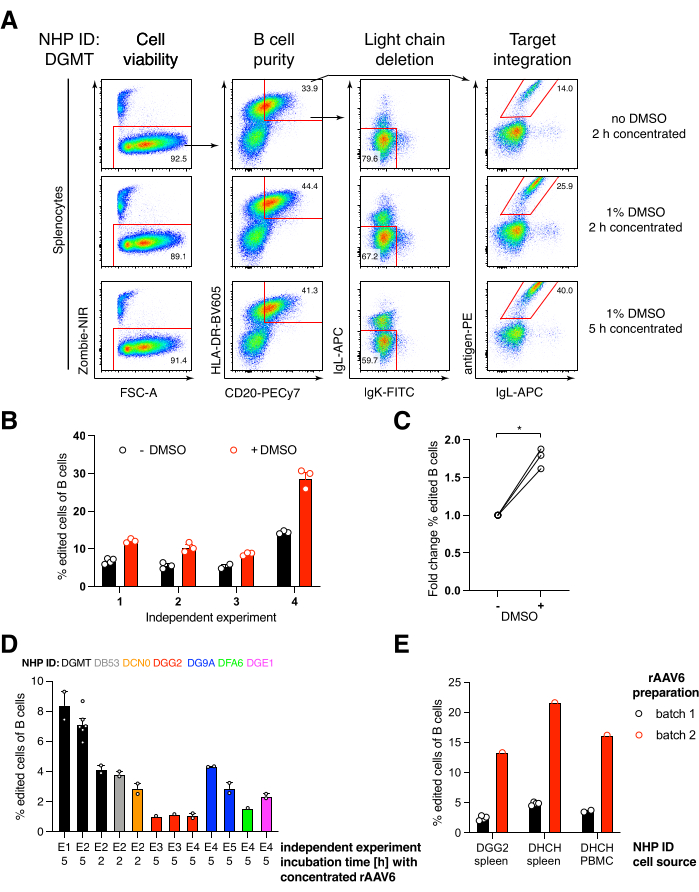
Figura 6: Efectos del DMSO, incubación concentrada prolongada con rAAV6 HDRT, calidad del lote de rAAV y reproducibilidad entre diferentes NHP de donantes sobre la eficiencia de edición de genes en células B de macaco rhesus primarias. (A) Los esplenocitos fueron cultivados y editados como se describe. Después de la electroporación, 5 x 10 5 células se cultivaron en medio con o sin DMSO al 1% y se incubaron en 50 μL de medio que contenía rAAV6 HDRT a un MOI de 5 x 10 5 durante 2 h o5 h antes de la adición de otros 450 μL de medio. Las células fueron analizadas 2 días después de la electroporación por citometría de flujo, como en la Figura 5. Representante de cuatro experimentos independientes. (B) Cuantificación de (A) en cuatro experimentos independientes. Los puntos indican réplicas técnicas con ajustes de transfección de 1.350 V, 10-20 ms y 1 duración de electroporación de pulso y concentraciones de DMSO que oscilan entre 0,75% y 1,25%. (C) Cambio promedio de pliegue en la eficiencia de edición de (B). * p > 0,05 en la prueba U de Mann-Whitney. (D) Eficiencia de edición sobre experimentos independientes con diferentes macacos utilizando un lote comercial rAAV6 de menor eficiencia. (E) Eficiencia de edición utilizando dos lotes comerciales diferentes de rAAV6 en los que se empaquetó la misma construcción en las células B de dos NHP diferentes en el mismo experimento. Los puntos indican réplicas técnicas con ajustes de transfección de 1.350 V, 10-20 ms y 1 electroporación de pulso. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los protocolos presentados aquí proporcionan un método rápido y eficiente para generar altos rendimientos y títulos de rAAV6 como HDRT y métodos novedosos para editar genéticamente de manera eficiente las células B primarias del macaco rhesus in vitro.
El protocolo de producción rAAV6 es comparativamente simple y rápido, permitiendo la producción y prueba de muchas construcciones diferentes simultáneamente sin mano de obra excesiva. Si se desea, rAAV6 se puede purificar aún más utilizando protocolos establecidos como la ultracentrifugación de gradiente de iodixanol34 o la partición acuosa de dos fases35 antes del intercambio y concentración de tampón.
Aunque redujo el rendimiento general, optamos por usar solo medio de cultivo celular reducido en suero para la purificación de rAAV6 en lugar de purificación del pellet celular, ya que la mayoría de rAAV6 se libera en el medio36, y la purificación del pellet celular agrega más costo y mano de obra. El uso del ayudante adenoviral autoinactivador aumentó los rendimientos 30-40 veces en promedio, permitiendo la prueba de construcciones empaquetadas en AAV6 en un solo plato de 15 cm. Aunque nuestro método de purificación es básico, usando este método, obtenemos relativamente poca variación de lote a lote en la eficiencia de edición de genes o la viabilidad celular después de la transducción utilizando varias líneas celulares u otras células primarias (datos no mostrados).
Desarrollamos un protocolo de purificación de células B de macaco rhesus para obtener células B primarias intactas utilizando el agotamiento negativo de poblaciones no deseadas. Aunque no es necesario para la edición de genes de estas células, proporciona una forma de obtener una población relativamente pura de células B de macaco rhesus primario para esta u otras aplicaciones en caso de que otros tipos de células interfieran con los objetivos experimentales. Sin embargo, la pureza tiene el costo de reducir los rendimientos generales de células B. En particular, tanto para los cultivos de células B enriquecidos como para los no enriquecidos, la fracción de células B en las preparaciones iniciales de PBMC o esplenocitos es crucial. Para las PBMC en particular, recomendamos el cribado de diferentes macacos para individuos con un alto porcentaje de células B en sangre periférica para obtener un alto número de células B para experimentos, ya que este valor puede diferir dramáticamente entre individuos27. Las PBMC pueden obtenerse por sangrado regular o leucoféresis42.
El protocolo de edición de genes conduce a una edición genética eficiente, típicamente entre el 60% -80% de knock-out y el 5% -20% de las células B knock-in, aunque hemos logrado hasta un 90% de BCR knock-out y 40% de BCR knock-in B (Figura 5 y Figura 6).
Los principales parámetros para la edición eficiente de las células B de macaco rhesus son la eficiencia de corte del sgRNA, los parámetros de electroporación, el MOI y la calidad de la preparación rAAV6. Las eficiencias de corte de los sgRNAs candidatos deben determinarse empíricamente para permitir una edición y diseño óptimos del HDRT. Los parámetros de electroporación presentados aquí equilibran la eficiencia con la viabilidad para obtener el número total máximo de células B editadas en lugar del porcentaje más alto de células B editadas. Si se requiere un mayor porcentaje de celdas editadas, se recomiendan mayores voltajes (hasta 1.750 V) o longitudes de pulso alteradas (10-30 ms), aunque se puede observar más muerte celular. También observamos eficiencias de edición ligeramente más altas en las células B esplénicas en comparación con las células B de PBMC del mismo individuo (Figura 5); Sin embargo, la razón subyacente de esto es actualmente desconocida.
Encontramos que la adición de DMSO al 1% después de la electroporación aumentó significativamente la eficiencia de edición de genes en ~ 40% en células B de macaco rhesus sin afectar la viabilidad celular (Figura 6A-C), en línea con los informes en otras células43. Sin embargo, se debe evitar el cultivo prolongado en DMSO al 1% y puede afectar la viabilidad celular. DMSO puede omitirse por completo si se desea.
El cultivo de las células en un pequeño volumen después de la electroporación durante varias horas junto con el rAAV6 conduce a mayores eficiencias de edición, probablemente debido a la mejor transducción de HDRT por el rAAV6 y, por lo tanto, la mayor concentración intracelular de HDRT en el momento relevante cuando Cas9 está activo. Encontramos que cultivar las células de esta manera hasta 8 h no afectó la viabilidad celular, pero las eficiencias de edición no aumentaron dramáticamente más allá de 5 h (Figura 6). Si solo se requiere knock-out en lugar de knock-in, este paso puede omitirse.
En conclusión, presentamos protocolos integrales para la edición génica de células B de macaco rhesus in vitro y la producción de rAAV6 HDRT necesaria para el knock-in eficiente de las construcciones deseadas. Estos protocolos permiten la prueba rápida y rentable de muchas construcciones empaquetadas como rAAV6 y permiten la prueba preclínica de la viabilidad y escalabilidad de las terapias de células B en un modelo de primates no humanos más relevante.
Divulgaciones
No se declaran intereses en conflicto.
Agradecimientos
Nos gustaría agradecer a Harry B. Gristick y Pamela Bjorkman por proporcionar el antígeno RC1 y a todos los laboratorios de Nussenzweig y Martin para una discusión crítica. Este trabajo fue apoyado por la subvención INV-002777 de la Fundación Bill y Melinda Gates (a M.C.N.) y el Programa de Investigación Intramuros del Instituto Nacional de Alergias y Enfermedades Infecciosas, Institutos Nacionales de Salud. (R.G. y M.A.M). M.C.N. es un investigador del HHMI.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
Referencias
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. . Protein Electrophoresis - Serum., 6th edition. , 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850 (2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851 (2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995 (2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630 (2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934 (2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144 (2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973 (2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855 (2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182 (2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686 (2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991 (2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados