Establecimiento simple de un nicho de médula ósea osteogénica vascularizada utilizando hidrogeles de poli(etilenglicol) (PEG) prefabricados en una microplaca de imágenes
En este artículo
Resumen
Se establece un modelo in vitro del nicho vascular de la médula ósea mediante la siembra de células mesenquimales y endoteliales en hidrogeles PEG 3D prefabricados. Las redes endoteliales, los componentes de ECM y la actividad ALP de los nichos varían según el factor de crecimiento utilizado. La plataforma se puede utilizar para modelos avanzados de cáncer.
Resumen
El hueso y la médula ósea son órganos altamente vascularizados y estructuralmente complejos, y son sitios para el cáncer y la formación de metástasis. Los modelos in vitro que recapitulan las funciones específicas de la médula ósea y ósea, incluida la vascularización, que son compatibles con el cribado farmacológico son altamente deseables. Tales modelos pueden cerrar la brecha entre los modelos bidimensionales (2D) in vitro simplistas y estructuralmente irrelevantes y los modelos in vivo más caros y éticamente desafiantes. Este artículo describe un ensayo de cocultivo tridimensional (3D) controlable basado en matrices de poli(etilenglicol) (PEG) diseñadas para la generación de nichos vascularizados de médula ósea osteogénica. El diseño de la matriz PEG permite el desarrollo de cultivos celulares 3D a través de un simple paso de siembra celular que no requiere encapsulación, lo que permite el desarrollo de sistemas complejos de cocultivo. Además, las matrices son transparentes y están prefabricadas en placas de imagen de 96 pocillos con fondo de vidrio, lo que hace que el sistema sea adecuado para microscopía. Para el ensayo descrito aquí, las células estromales mesenquimales derivadas de la médula ósea humana (hBM-MSC) se cultivan primero hasta que se forma una red de células 3D suficientemente desarrollada. Posteriormente, se agregan células endoteliales de la vena umbilical humana que expresan GFP (HUVECs). El desarrollo del cultivo es seguido por microscopía de campo claro y fluorescencia. La presencia de la red hBM-MSC apoya la formación de estructuras vasculares que de otro modo no se formarían y que permanecen estables durante al menos 7 días. La extensión de la formación de redes vasculares se puede cuantificar fácilmente. Este modelo se puede ajustar hacia un nicho osteogénico de médula ósea complementando el medio de cultivo con proteína morfogenética ósea 2 (BMP-2), que promueve la diferenciación osteogénica de las hBM-MSC, según lo evaluado por el aumento de la actividad de la fosfatasa alcalina (ALP) en el día 4 y el día 7 del cocultivo. Este modelo celular se puede utilizar como una plataforma para cultivar varias células cancerosas y estudiar cómo interactúan con nichos vasculares específicos de hueso y médula ósea. Además, es adecuado para la automatización y los análisis de alto contenido, lo que significa que permitiría la detección de medicamentos contra el cáncer en condiciones de cultivo altamente reproducibles.
Introducción
El hueso y la médula ósea son órganos estructural y funcionalmente complejos fundamentales para la salud humana. Esto se refleja en la existencia de nichos distintos que regulan la hematopoyesis y el mantenimiento óseo1. Ahora se acepta ampliamente que en la médula ósea sana, el mantenimiento y la expansión de las células madre hematopoyéticas y esqueléticas, así como su progenie, están controlados por nichos distintos. Estos nichos comprenden varios tipos de células, incluyendo células de osteolinaje, células madre mesenquimales, células endoteliales y perivasculares, células neuronales y gliales, adipocitos, osteoclastos, macrófagos y neutrófilos2. No es sorprendente que estos nichos en su mayoría asociados a la vasculatura también estén involucrados en el desarrollo de varios tipos de leucemia3 y sean el sitio de metástasis para diferentes cánceres4. Debido a sus funciones específicas en la formación ósea, remodelación y mantenimiento óseo (médula), la vasculatura asociada al hueso tiene distintas estructuras especializadas diferentes de la vasculatura que se encuentra en otras partes del cuerpo 5,6,7. Así, los fármacos antiangiogénicos o moduladores de la vasculatura aplicados sistémicamente pueden tener diferentes efectos dentro de estos ambientes especializados8. Por lo tanto, los modelos para investigar los mecanismos moleculares implicados en el mantenimiento de las propiedades fisiológicas del hueso y la médula ósea, la regeneración ósea y de la médula ósea y las respuestas a los tratamientos terapéuticos son altamente deseables.
Los cultivos clásicos de tejidos bidimensionales (2D) y las investigaciones in vivo utilizando modelos animales han proporcionado información invaluable sobre los roles de diferentes células y actores moleculares involucrados en el desarrollo del hueso y la médula ósea 9,10. Los modelos que permiten experimentos de alto rendimiento con células humanas relevantes podrían mejorar nuestra comprensión de cómo modular parámetros seleccionados en estos sistemas altamente complejos.
En la última década, los principios derivados de la ingeniería de tejidos se han empleado para generar modelos de tejidos3D 11,12. Estos se han basado principalmente en la encapsulación de células relevantes para el tejido en biomateriales para establecer monocultivos o cocultivos 3D13. Entre los biomateriales más utilizados se encuentran la fibrina 14, el colágeno 15 y el Matrigel16,17, todos los cuales son altamente biocompatibles y proporcionan condiciones apropiadas para el crecimiento de muchos tipos de células. Estos biomateriales tienen la capacidad de generar modelos in vitro que recapitulan aspectos clave de los diferentes nichos vasculares encontrados in vivo18. Además, el uso de dispositivos microfluídicos para generar modelos vasculares perfundidos de hueso y médula ósea ha contribuido a la generación de modelos in vitro de mayor complejidad 19,20,21,22.
La dificultad para controlar la composición e ingeniería de las propiedades de los biomateriales naturales ha inspirado el desarrollo de análogos sintéticos que pueden ser diseñados racionalmente con propiedades físicas, químicas y biológicas predecibles23,24. Hemos desarrollado hidrogeles totalmente sintéticos a base de poli(etilenglicol) reticulado (PEG) del factor XIII (FXIII), que se funcionalizan con péptidos RGD y sitios de escisión de la metaloproteasa de matriz (MMP) para facilitar la unión celular y la remodelación25,26. El diseño modular de estos biomateriales se ha utilizado con éxito para optimizar las condiciones para la formación de modelos 3D vascularizados de hueso y médula ósea27,28.
Para la prueba de un mayor número de diferentes condiciones de cultivo y nuevas terapias, se requieren modelos con una mayor capacidad de rendimiento. Recientemente hemos demostrado que la reticulación FXIII de nuestro hidrogel PEG se puede controlar a través de un proceso electroquímico tal que se forma un gradiente de rigidez de hidrogel en profundidad29. Cuando se agregan células sobre tales hidrogeles, migran hacia el interior y gradualmente se convierten en redes celulares 3D altamente interconectadas30. La eliminación de la necesidad de encapsular células en el hidrogel, que suele estar presente con otros andamios 3D, no solo simplifica el diseño experimental, sino que también permite la adición secuencial de diferentes tipos de células en diferentes puntos de tiempo para generar complejos sistemas de cocultivo. Estos hidrogeles están disponibles prefabricados en placas de imágenes de 96 pocillos con fondo de vidrio, lo que hace que el establecimiento de cultivos 3D sea posible mediante protocolos de siembra celular manuales y automatizados. La transparencia óptica de los hidrogeles PEG hace que la plataforma sea compatible con la microscopía.
Aquí, presentamos un método sencillo para la generación y caracterización de nichos osteogénicos vascularizados dentro de esta plataforma sintética plug-and-play lista para usar. Mostramos que el desarrollo de redes vasculares puede ser estimulado con un factor de crecimiento comúnmente utilizado para inducir osteogénesis in vitro, la proteína morfogenética ósea-2 (BMP-2), mientras que la diferenciación osteogénica puede prevenirse mediante la suplementación del factor de crecimiento de fibroblastos 2 (FGF-2)27,31. Las redes formadas son diferentes en comparación con las redes estimuladas por FGF-2 en términos de la apariencia general, así como la distribución celular y ECM. Además, monitorizamos la inducción osteogénica utilizando fosfatasa alcalina como marcador. Demostramos el aumento de la expresión de este marcador a lo largo del tiempo y comparamos la expresión con la de las redes estimuladas por FGF-2 utilizando métodos cualitativos y cuantitativos. Finalmente, demostramos la idoneidad de los nichos generados de este modelo para dos aplicaciones potenciales. En primer lugar, realizamos un ensayo de prueba de concepto de sensibilidad a los medicamentos agregando bevacizumab a nichos preformados y monitoreando la degradación de las redes vasculares en su presencia. En segundo lugar, agregamos células de cáncer de mama MDA-MB-231 y osteosarcoma U2OS a nichos osteogénicos preformados, lo que demuestra que los nichos se pueden usar para estudiar las interacciones entre las células cancerosas y su entorno.
Protocolo
En la figura 1 se resumen las siguientes secciones de protocolo.
1. Establecimiento del monocultivo del estroma 3D
- Prepare la suspensión de células hBM-MSC.
- Cultive hBM-MSC a un nivel de confluencia de 70% -90% en MEMα suplementado con 10% FBS, 1% de penicilina-estreptomicina y 5 ng / ml FGF-2 en una incubadora a 37 ° C y 5% deCO2 en una atmósfera humidificada. Las celdas pueden utilizarse hasta el pasaje 6.
- Lavar las células con PBS y separarlas con tripsina-EDTA al 0,05% durante 3-5 min a 37 °C. Detenga el proceso de desprendimiento lavando con medio basal (MEMα suplementado con 10% FBS y 1% de penicilina-estreptomicina). Recoja las células suspendidas en un tubo de centrífuga cónica de 50 ml.
- Cuente las células con un hematocitómetro o un contador de células automatizado, y determine el número total de células en la suspensión.
- Granular las células por centrifugación a 200 x g durante 5 min. Retire con cuidado el sobrenadante.
- Resuspender las células en un volumen apropiado de medio basal para alcanzar una concentración de 1 x 107 células/ml de solución madre.
- Prepare tubos de centrífuga cónica de 50 ml que contengan el volumen requerido de medio basal suplementado con los respectivos factores de crecimiento (FGF-2 y BMP-2 a concentraciones definidas, por ejemplo, 0 ng / ml, 25 ng / ml, 50 ng / ml, 100 ng / ml o 200 ng / ml). Por pozo, se requieren 200 μL. Si la siembra de células se va a realizar utilizando un manipulador de líquidos automatizado, considere también el volumen muerto del instrumento. Para la siembra manual de células, un exceso de volumen del 10% es suficiente.
- Añadir las hBM-MSC de la solución madre con una dilución de 1:66,67 para alcanzar una concentración de 1,5 x 105 células/ml.
- Prepare el plato para la siembra.
- Retire la película adhesiva de polipropileno que cubre la placa de hidrogel de 96 pocillos.
- Aspirar cuidadosamente el tampón de almacenamiento que cubre los hidrogeles. Para esta tarea, use una lavadora de microplacas; sin embargo, la manipulación manual es posible.
- Cuando use un aspirador manual o una pipeta multicanal, coloque la punta contra la pared del pozo y desplácese lentamente hacia el borde del pozo interior mientras aspira el tampón. Esto evitará dañar la superficie del hidrogel.
- Cuando utilice una lavadora de placas automatizada, coloque las boquillas de aspiración al menos a 3,8 mm del portador de la placa (esto corresponde a 0,8 mm del anillo interior de la placa de hidrogel) y hacia el borde del pozo. Consulte el manual del fabricante para obtener instrucciones más detalladas y para obtener los dibujos de la placa de hidrogel de 96 pocillos.
- Añadir 200 μL/pocillo de la suspensión celular preparada en la etapa 1.1.7 después de mezclar bien para asegurarse de que las células están distribuidas homogéneamente. Durante la siembra, para evitar la sedimentación desigual de las células en una región del sustrato, no incline la placa. Para la siembra manual, mezcle periódicamente la suspensión celular (después de sembrar tres pocillos) para mantener la mezcla homogénea. Para la siembra automatizada, mezclar con una pipeta serológica inmediatamente antes de la dispensación para dispensar volúmenes que contengan igual número de células.
- Mantener los cultivos a 37 °C y 5%CO2 en atmósfera humidificada.
- Monitorear el desarrollo de los cultivos por microscopía de campo claro con un objetivo 5x según se desee. Adquiera imágenes de referencia aproximadamente 30 minutos después de la siembra para evaluar el número de células agregadas.
2. Establecimiento del cocultivo 3D de células estromales-endoteliales
- Prepare la suspensión celular GFP-HUVEC.
- Preparar matraces para el cultivo HUVEC recubriendo con una solución consistente en 150 μg/ml de colágeno I de cola de rata en ácido acético 0,02 M durante 30 min a 37 °C. Enjuague una vez con PBS antes de usar.
- Cultivar las GFP-HUVEC a un nivel de confluencia del 80%-100% en EGM-2 suplementado con 10% de FBS en una incubadora a 37 °C y 5% deCO2 en una atmósfera humidificada. Las celdas pueden utilizarse hasta el pasaje 7.
- Lave las células con PBS y sepárelas con tripsina-EDTA al 0,05% durante 2-3 min a 37 °C. Detenga el proceso de desprendimiento lavando con medio basal (MEMα suplementado con 10% FBS y 1% de penicilina-estreptomicina). Recoja las células suspendidas en un tubo de centrífuga cónica de 50 ml.
- Cuente las células usando un hematocitómetro o un contador celular automatizado, y determine el número total de células presentes en la suspensión.
- Granular las células por centrifugación a 200 x g durante 5 min. Retire con cuidado el sobrenadante.
- Resuspender las células en un volumen apropiado de medio basal para alcanzar una concentración de 1 x 107 células/ml de solución madre.
- Preparar tubos de centrífuga cónicos de 50 ml que contengan el volumen requerido de medio basal suplementado con los respectivos factores de crecimiento (FGF-2 y BMP-2 a concentraciones definidas, por ejemplo, 0 ng/ml, 25 ng/ml, 50 ng/ml, 100 ng/ml o 200 ng/ml) como se describe para las hBM-MSC en el paso 1.1.6.
- Añadir las GFP-HUVEC de la solución madre a una dilución de 1:66,67 para alcanzar una concentración de 1,5 x 105 células/ml, como se describe para las hBM-MSC en el paso 1.1.7.
- Aspirar el medio de la placa que contiene el monocultivo del estroma, como se describe para la eliminación del tampón en el paso 1.2.2.
- Añadir 200 μL/pocillo de la suspensión celular GFP-HUVEC preparada en el paso 2.1.8, tal como se describe para la adición de hBM-MSC en el paso 1.3.
- Incubar a 37 °C y 5% deCO2 en atmósfera humidificada. Cambie el medio cada 3-4 días.
- Monitorear el desarrollo del cultivo mediante microscopía de campo claro y fluorescencia utilizando un objetivo 5x según se desee. Mantener los cultivos hasta el día 4 o el día 7 de cocultivo para caracterizaciones tempranas o intermedias, respectivamente, o según se desee.
3. Procedimiento de caracterización 1: Cuantificación de la formación de redes celulares endoteliales
- En los puntos de tiempo deseados, adquiera la señal GFP de los GFP-HUVEC con microscopía de fluorescencia utilizando ajustes adecuados para la cuantificación (es decir, mejor enfoque, alto contraste y bajo aumento [por ejemplo, 5x] para campos de visión más grandes).
- Preprocese por igual todas las imágenes adquiridas el mismo día (por ejemplo, usando Fiji32) para mejorar aún más el contraste. Tenga en cuenta que la señal GFP puede atenuarse con el tiempo de cultivo; Por lo tanto, las imágenes adquiridas en diferentes días pueden necesitar un procesamiento diferente.
- Si usa Fiji o ImageJ, abra todas las imágenes del canal GFP del mismo punto de tiempo y abra el menú Brillo y contraste . Seleccione una imagen que represente una condición intermedia (no la señal más tenue ni la más brillante) y ajuste automáticamente el contraste seleccionando Automático. Seleccione Establecer y marque Propagar a todas las demás imágenes abiertas.
- Evalúe visualmente si el rango seleccionado automáticamente se ajusta a todas las imágenes del punto de tiempo actual, y vuelva a ajustar y volver a propagar manualmente a todas las imágenes según sea necesario.
- Guarde las imágenes ajustadas como archivos TIF y repita los pasos 3.2.1 y 3.2.2 para los demás puntos de tiempo adquiridos.
- Aplique un filtro de desenfoque mediano (por ejemplo, radio 3 para imágenes de 2048x2048) a todas las imágenes para evitar el reconocimiento de artefactos aguas abajo y, por lo tanto, facilitar la identificación precisa de la red. Reduzca el tamaño agrupando (2x2) y guarde todas las imágenes preprocesadas como archivos TIF de color RGB en escala de grises en una carpeta para su cuantificación. Estos pasos se pueden realizar manualmente o en modo por lotes utilizando macros que los autores compartirán a pedido.
- Analice todas las imágenes de la carpeta creada en los pasos 3.1-3.3 mediante el modo Proceso por lotes del Analizador de angiogénesis para ImageJ33. Tenga en cuenta que, dependiendo del tamaño de las imágenes y la memoria de trabajo disponible, esto puede tardar unos minutos por imagen.
- Validar los resultados de cuantificación examinando las superposiciones de las estructuras reconocidas y las imágenes originales. Si el algoritmo reconoce estructuras artificiales, donde solo se pueden ver unas pocas o ninguna celda en la imagen original, ajuste los parámetros de preprocesamiento y vuelva a analizar las imágenes originales, o excluya dichas áreas problemáticas y / o replique las imágenes del análisis.
- Normalizar los valores obtenidos a un área de 1 mm 2 multiplicando los valores de cada muestra por la relación del área analizada a 1 mm2. Este paso es de particular importancia si se utilizan imágenes de diferentes tamaños.
- Extraiga varios parámetros de red, como la longitud total de la red, el número de uniones, el número de segmentos, el número de segmentos aislados, el intervalo de ramificación y el tamaño medio de la malla, del análisis, y utilícelos para caracterizar la red endotelial en diferentes puntos de tiempo y bajo diferentes condiciones de cultivo.
4. Procedimiento de caracterización 2: Evaluación de la deposición de ECM
- En los puntos de tiempo finales deseados, evalúe la deposición de ECM utilizando inmunofluorescencia. Añadir anticuerpos primarios contra varias moléculas de ECM en 100 μL del medio de cultivo durante las últimas 6 h de cultivo o después de la fijación, como se describe a continuación.
- Lave los cultivos una vez con 200 μL/pocillo de PBS durante 5 min a RT, y fíjelos con 100 μL/pocillo de paraformaldehído al 4% bajo una campana extractora de humos químicos durante 30 min a RT. Tenga en cuenta que se recomienda fijar todos los pocillos de una placa al mismo tiempo, ya que los cultivos circundantes pueden dañarse durante este paso. Lavar los cultivos fijos con 200 μL/pocillo de PBS a RT tres veces durante 5 min cada vez, y almacenar a 4 °C en 200 μL/pocillo de PBS, o proceder inmediatamente al siguiente paso.
- Antes de incubar con anticuerpos primarios contra moléculas de ECM después de la fijación, incubar los cultivos fijos con 200 μL/pocillo de BSA al 1% en PBS como solución bloqueante durante 30 min a RT.
- Aspirar la solución de bloqueo e incubar con 100 μL/pocillo de la solución de anticuerpos primarios en BSA al 1% en PBS durante la noche a 4 °C. Lavar con 200 μL/pocillo de PBS tres veces durante 5 min, al menos 3 h y 5 min, respectivamente, a RT.
NOTA: El paso de lavado largo es necesario para la difusión completa del anticuerpo no unido fuera del hidrogel.
- Aspirar la solución de bloqueo e incubar con 100 μL/pocillo de la solución de anticuerpos primarios en BSA al 1% en PBS durante la noche a 4 °C. Lavar con 200 μL/pocillo de PBS tres veces durante 5 min, al menos 3 h y 5 min, respectivamente, a RT.
- Para facilitar la penetración de la solución de tinción secundaria, incluyendo contratinciones intracelulares, permeabilizar los cultivos utilizando Triton X-100 al 0,3% y BSA al 1% en PBS durante 30-90 min en RT, dependiendo de la densidad celular de los cultivos.
NOTA: Para la tinción basada en anticuerpos de moléculas intracelulares, este paso debe realizarse antes de la incubación con el anticuerpo primario descrito en el paso 4.1.2. - Prepare soluciones de tinción secundaria que contengan los respectivos anticuerpos secundarios y contratinciones según desee (por ejemplo, una tinción nuclear como DAPI y una tinción citoesquelética como faloidina-rodamina).
- Prepare un tampón de tinción que consista en 0.1% de Triton X-100, 1% de BSA en PBS y contratinciones (por ejemplo, 1 μg / ml de DAPI y 1: 4,000 faloidina-rodamina), y agregue los anticuerpos secundarios respectivos en las diluciones recomendadas.
- Añadir 100 μL/pocillo de solución de tinción secundaria e incubar durante la noche a 4 °C. Similar al procedimiento después de la incubación primaria de anticuerpos, lavar con 200 μL/pocillo de PBS tres veces durante 5 min, al menos 3 h y 5 min, respectivamente, a RT.
- Para la resolución 3D de las estructuras, adquiera pilas confocales comenzando en el fondo de vidrio con un paso z de 2,5 μm que alcanza una altura final de 500 μm, use un objetivo de 10x y un zoom digital de 0,75x. Para generar una reconstrucción 3D de la señal GFP y F-actin en Fiji, establezca un umbral de cada canal por separado antes de crear un compuesto y generar la reconstrucción utilizando Fiji 3D Viewer.
- Para la visualización de la ECM depositada a partir de las inmunotinciones, adquiera pilas confocales de una altura de 100 μm con un paso z de 5 μm, un objetivo de 10x y un zoom digital de 1.5x. Genere proyecciones de máxima intensidad y ajuste el brillo y el contraste de cada canal por separado en Fiji antes de crear un compuesto.
- Realizar tinciones directas de color del ambiente extracelular.
- Añadir 200 μL/pocillo de solución de tinción de rojo de Picrosirius a los pocillos fijados en paraformaldehído e incubar durante 1 h a RT.
- Luego, lave los pocillos manchados cinco veces con agua destilada, seguido de lavar dos veces al día o cada dos días durante 3-4 días mientras monitorea la limpieza del color de la muestra. Mantener las placas a 4 °C durante los largos pasos de lavado (es decir, cualquier cosa que exceda las 6 h).
- Adquiera imágenes de las muestras teñidas utilizando un microscopio de campo brillante equipado con una cámara a color y mantenga un balance de blancos igual en todas las condiciones. Para obtener una visión general de las muestras, use un aumento bajo (por ejemplo, 2.5x) para escanear todo el pozo. Si el microscopio no viene con un software que admita la costura automática, hágalo manualmente (por ejemplo, usando Pairwise Stitching en Fiji34).
NOTA: Los pocillos utilizados anteriormente para la inmunofluorescencia se pueden utilizar para esto, siempre que se complete la adquisición de imágenes de fluorescencia. - Siga los mismos pasos descritos para la tinción de Picrosirius Red en los pasos 4.2.1-4.2.3 para realizar la tinción, el lavado y la obtención de imágenes de Alizarin Red.
5. Procedimiento de caracterización 3: Evaluación de la diferenciación osteogénica mediante la monitorización de la actividad de la fosfatasa alcalina
- En diferentes puntos finales del cultivo (p. ej., día 4 y día 7 de cocultivo), evalúe cuantitativamente la actividad de la fosfatasa alcalina mediante el uso de tinción con 5-bromo-4-cloro-3-indolil fosfato (BCIP)/nitro azul tetrazolio (NBT).
- Lavar los cultivos una vez con 200 μL/pocillo de PBS antes de incubar con la solución de sustrato BCIP/NBT, que debe prepararse siguiendo las instrucciones del fabricante. Incubar a 37 °C mientras monitorea periódicamente el desarrollo del color. Una vez que el color comience a desarrollarse en condiciones no osteogénicas, lavar inmediatamente una vez con 200 μL/pocillo de PBS antes de fijarlo con paraformaldehído al 4%, como se describe en el paso 4.1.1.
- Adquiera imágenes en color de las muestras teñidas, como se describe en el paso 4.2.3 para la tinción de rojo Picrosirius.
- En diferentes puntos finales del cultivo (p. ej., día 4 y día 7 de cocultivo), cuantifique la actividad de ALP en los lisados celulares.
- Lavar los cultivos tres veces con 200 μL/pocillo de PBS antes de incubar con 200 μL/pocillo de tripsina-EDTA al 0,25% a 37 °C. Cada 10 minutos, agite los cultivos pipeteando vigorosamente hacia arriba y hacia abajo para facilitar la digestión, y controle la morfología del cultivo con un microscopio de cultivo celular estándar.
- Una vez que se obtiene una suspensión líquida de una sola célula sin estructuras celulares alargadas en los pocillos (generalmente después de 20-30 min), transfiera las muestras a tubos de 2 ml, agregue 200 μL de medio basal MSC para inhibir la tripsina y centrifugue a 500 x g durante 5 minutos para granular las células recuperadas. Decantar el sobrenadante y congelar los gránulos a −80 °C, o continuar directamente al paso 5.2.3.
- Descongelar los gránulos celulares obtenidos en la etapa 5.2.2, e incubar con 500 μL de tampón de lisis compuesto por 0,56 M 2-Amino-2-metil-1-propanol, 0,2% Triton X-100, pH 10, durante 30 min en hielo. A continuación, centrifugar a 16.100 x g durante 10 min a 4 °C, y mantener las muestras en hielo. Después de las mediciones descritas en el paso 5.2.7, congelar las muestras a −20 °C o −80 °C, o continuar directamente con la cuantificación del ADN, como se describe en el paso 5.2.8.
NOTA: El tampón de lisis puede prepararse de antemano, filtrarse estérilmente y almacenarse a 4 °C. - Preparar el reactivo ALP constituido por 20 mM de sal disódica de 4-nitrofenil fosfato hexahidratado y 4 mM de MgCl2 en tampón de lisis.
NOTA: Es mejor preparar esta solución fresca el día de la cuantificación. - Sin perturbar ningún residuo granulado, dispensar 50 μL del sobrenadante de lisado celular preparado en el paso 5.2.3 en los pocillos de una placa estándar transparente de 96 pocillos en duplicados. Agregue búfer de lisis a dos pocillos como controles en blanco.
- Con una pipeta multicanal, añadir 50 μL/pocillo de reactivo ALP a los pocillos llenados en el paso 5.2.5. Agitar brevemente el plato e incubar a 37 °C durante 10 min protegido de la luz. Los pozos con mayor actividad ALP aparecerán amarillos. Detener la reacción añadiendo 100 μL/pocillo de NaOH 1 M utilizando una pipeta multicanal.
- Lea la densidad óptica a 410 nm utilizando un lector de placas. Promedie los duplicados técnicos y reste el promedio de los controles en blanco.
- Realizar la cuantificación del ADN para normalizar la actividad ALP determinada en los pasos anteriores contra el número total de células. Aquí se describe un método basado en mediciones de fluorescencia, pero cualquier otro método para la cuantificación del ADN en lisados celulares es compatible con el ensayo. Preparar los reactivos y los estándares de ADN necesarios para la cuantificación del ADN utilizando kits disponibles comercialmente de acuerdo con las instrucciones del fabricante.
NOTA: Se recomienda utilizar tampón de lisis para preparar los estándares de ADN. - Si las muestras utilizadas para la cuantificación de la fosfatasa alcalina descritas en el paso 5.2.3 se congelaron, descongelarlas, centrifugarlas a 16.100 x g durante 2 min a 4 °C y colocarlas en hielo. Sin perturbar ningún residuo granulado, dispensar 50 μL del sobrenadante de lisado celular en los pocillos de una placa negra de 96 pocillos por duplicado. Congelar las muestras a -20 °C o -80 °C, y repetir las cuantificaciones de ALP y ADN si es necesario. Agregue los estándares de ADN por duplicado.
- Con una pipeta multicanal, agregue 50 μL del agente de tinción de ADN, incube y lea la intensidad de fluorescencia según las instrucciones del fabricante. Utilizando los valores de la curva estándar, determine y aplique la conversión de los valores de intensidad medidos a las concentraciones de ADN.
- Normalizar los valores de ALP obtenidos en el paso 5.2.7 dividiéndolos por la respectiva concentración de ADN de cada muestra.
6. Aplicación 1: Realización de ensayos de sensibilidad a los medicamentos
- Cuando las redes endoteliales estén completamente desarrolladas (típicamente en el día 4 de los cocultivos de células estromales-endoteliales), agregue compuestos antiangiogénicos, como bevacizumab, a los cultivos en un medio de cultivo fresco y pruebe su actividad a lo largo del tiempo y bajo diferentes condiciones (por ejemplo, diferentes concentraciones de FGF-2 o BMP-2).
- Preparar un medio de cultivo fresco que contenga los mismos factores de crecimiento utilizados para los cultivos respectivos hasta ese momento.
- Prepare una solución de control que consista en el diluyente del compuesto de interés (p. ej., para bevacizumab: 60 mg/ml de α-trehalosa dihidrato, 0,4 mg/ml de Tween20, 5,8 mg/ml de fosfato de sodio, monobásico y monohidrato, y 1,2 mg/ml de fosfato de sodio dibásico, anhidro), y filtrarlo estérilmente.
- Añadir el compuesto de interés a la concentración deseada (p. ej., 10 μg/ml de bevacizumab) y un volumen igual de la solución de control al medio de cultivo designado para las condiciones de ensayo y control, respectivamente.
- Preparar un medio de cultivo fresco que contenga los mismos factores de crecimiento utilizados para los cultivos respectivos hasta ese momento.
- Aspirar el medio del cultivo y añadir 200 μL/pocillo del medio recién preparado en la etapa 6.1.1. Incubar durante un tiempo apropiado para el compuesto a probar (p. ej., para bevacizumab: 2 días). Monitorizar el desarrollo del cultivo y caracterizar las redes endoteliales como se describe en la sección 3. Evaluar la eficacia del compuesto para inhibir la angiogénesis o ablacionar las estructuras preformadas utilizando las imágenes GFP y los parámetros cuantitativos de red extraídos del análisis descrito en el paso 3.7.
7. Aplicación 2: Establecimiento de sistemas avanzados de cocultivo con varios tipos de células cancerosas
- En el día 4 del cocultivo, cuando las redes endoteliales están casi establecidas, agregue otros tipos de células, como MDA-MB-231 o células cancerosas U2OS, a los cultivos en medio de cultivo fresco.
- Etiquete las células cancerosas utilizando un tinte vivo compatible con las células según las instrucciones del fabricante para poder distinguirlas de los HUVEC marcados con GFP y los hBM-MSC no marcados en los cocultivos.
- Preparar una suspensión de células cancerosas a una concentración de 1,5 x 104 células/ml en un medio de cultivo fresco que contenga los mismos factores de crecimiento utilizados para los cultivos respectivos hasta ese momento.
- Monitorear el desarrollo del cultivo y la localización de células cancerosas según se desee.
NOTA: Dependiendo del tipo, la actividad y el entorno del cáncer, puede tomar algunos días para que lleguen a las estructuras vasculares en los cocultivos de células estromales-endoteliales (por ejemplo, 2 días para MDA-BM-231 y U2OS). Por lo tanto, las imágenes de lapso de tiempo para visualizar las interacciones cáncer-células vasculares deben cronometrarse en consecuencia.
Resultados Representativos
Los cultivos de nicho vascular se establecieron mediante la siembra secuencial de hBM-MSC y GFP-HUVEC en hidrogeles prefabricados basados en PEG con un gradiente de rigidez dentro de una placa de imagen de 96 pocillos (Figura 1). Los cultivos se monitorizaron longitudinalmente mediante microscopía de epifluorescencia en vivo y se caracterizaron aún más en puntos de tiempo seleccionados. El compartimiento extracelular se evaluó mediante tinciones directas de color y tinciones basadas en anticuerpos. La actividad de ALP se cuantificó después de recuperar y lisar las células de los nichos generados. Además, demostramos la idoneidad de esta plataforma para ensayos de sensibilidad a fármacos antiangiogénicos y como base para modelos de cocultivo de cáncer.
Los cocultivos de hBM-MSCs y HUVECs que expresan GFP se establecieron mediante la siembra de 3 x 104 células/pocillo en ausencia de factores de crecimiento o en presencia de FGF-2 o BMP-2 a 50 ng/mL, como se describe en el protocolo. Desde un punto de tiempo temprano, las diferencias entre los cultivos se pudieron observar tanto en las imágenes de campo claro como de fluorescencia que muestran solo los GFP-HUVEC (Figura 2A). Al observar las mismas áreas longitudinalmente, se pudieron observar diferencias en el desarrollo de los cultivos, como un desarrollo más rápido en presencia de FGF-2. En general, los cultivos parecían menos desarrollados en ausencia de cualquier factor de crecimiento, con menos células de cualquier tipo diseminándose y la presencia de áreas acelulares. En contraste, las imágenes de campo brillante mostraron las culturas más densas en presencia de BMP-2. Sin embargo, las redes vasculares se formaron en ambas condiciones que contienen factores de crecimiento, y las redes más extensas e interconectadas se formaron con FGF-2. Estas diferencias observadas también podrían cuantificarse utilizando Angiogenesis Analyzer for ImageJ. De hecho, la longitud total de la red fue más alta en presencia de FGF-2 y más baja en ausencia de factores de crecimiento (Figura 2B). El número de uniones que indican puntos de ramificación en las redes siguió la misma tendencia que la longitud total (Figura 2C). Por el contrario, ambas condiciones que contienen factores de crecimiento presentaron significativamente menos segmentos aislados, lo que indica una mayor interconectividad, que la condición sin ningún factor de crecimiento (Figura 2D). Además, las imágenes confocales 3D revelaron una penetración más fuerte de las células endoteliales en términos de profundidad en la condición estimulada por FGF-2 (Figura 2E).
Los cocultivos hBM-MSC/GFP-HUVEC se mantuvieron durante 7 días en presencia de FGF-2 o BMP-2 antes de ser fijados y teñidos para componentes de ECM. Las tinciones inmunocitoquímicas seguidas de microscopía de barrido láser confocal mostraron diferencias notables en la morfología del cultivo dependiendo del tipo de suplementación con factor de crecimiento (Figura 3A). Con FGF-2, el cultivo se organizó en estructuras microvasculares condensadas, que eran densas tanto en células endoteliales como mesenquimales, mientras que en presencia de BMP-2, las hBM-MSC abarcaban un área mucho más grande, como es evidente en las áreas más extensas positivas para F-actina y GFP negativas. Las proteínas ECM fibronectina y colágeno I se localizaron de manera similar, mientras que la laminina y el colágeno IV se concentraron más alrededor de las estructuras endoteliales. Sin embargo, este aumento de la concentración alrededor de las estructuras endoteliales fue mucho más pronunciado en presencia de FGF-2 que en presencia de BMP-2. Además de las tinciones basadas en anticuerpos, se realizaron tinciones directas de color para evaluar el estado fibrótico general de la ECM (tinción de rojo de Picrosirius; Figura 3B), así como la deposición de Ca en la ECM (tinción de rojo alizarina; Figura 3C) de los nichos formados. La tinción Picrosirius Red fue más fuerte y más extensa en los nichos cultivados con BMP-2, y la tinción Alizarin Red siguió la misma tendencia.
A continuación, los cultivos se caracterizaron en términos de su potencial osteogénico mediante la evaluación de la actividad de la fosfatasa alcalina como un marcador osteogénico temprano. En el día 4 y el día 7 del cocultivo, las células se recuperaron de los nichos digiriendo los hidrogeles con tripsina. Para cuantificar la actividad de ALP, se lisaron las células recuperadas y se realizó un ensayo de pNPP. Los valores obtenidos se normalizaron contra el ADN total de cada muestra para tener en cuenta las diferencias potenciales en el número de células a través de las condiciones. De hecho, se pudieron observar pequeñas diferencias entre el contenido de ADN de las condiciones, y se recuperaron la menor cantidad de células de la condición sin ningún factor de crecimiento (no se muestra). La actividad normalizada de ALP, sin embargo, varió mucho entre las condiciones, con una tendencia de aumento de la actividad con concentraciones más altas de BMP-2 y una meseta de 100 ng / ml (Figura 4A, B). Los niveles de actividad más bajos se identificaron para la condición que contiene 50 ng / ml FGF-2. Si bien se pudieron observar tendencias similares para ambos puntos de tiempo evaluados, todos los valores aumentaron significativamente con el tiempo en cultivo desde el día 4 hasta el día 7. Además del ensayo cuantitativo, la actividad ALP podría visualizarse cualitativamente utilizando tinción directa de color basada en la conversión de sustrato BCIP / NBT. Se observó una tinción púrpura más extensa e intensa en presencia de BMP-2 en comparación con FGF-2 (Figura 4C).
Para demostrar dos aplicaciones potenciales de los nichos osteogénicos caracterizados, se realizó un estudio de prueba de concepto de sensibilidad a los medicamentos y cocultivos de cáncer. Para el ensayo de sensibilidad al fármaco, se añadió bevacizumab o una solución de control consistente en el diluyente de la formulación de bevacizumab al medio de cultivo que contenía BMP-2 fresco. El día 4, cuando se formaron redes establecidas en presencia de 50 ng/mL BMP-2, se agregó la solución de control o el medio que contenía bevacizumab durante el cambio regular del medio, y los cultivos se monitorizaron mediante imágenes de fluorescencia. La adición de 10 μg/ml de bevacizumab condujo a la retracción o ablación de la red previamente formada, mientras que la condición de control todavía presentaba redes extensas 2 días después del cambio del medio (Figura 5A, B). Estos cambios también podrían cuantificarse mediante el seguimiento de la longitud total de las redes utilizando Angiogenesis Analyzer for ImageJ en imágenes de fluorescencia adquiridas diariamente (Figura 5C). Alternativamente, también se podría agregar bevacizumab o cualquier otro compuesto desde el inicio del cocultivo para evaluar su influencia en la formación de las redes. En el caso de bevacizumab, esto inhibió completamente la formación de redes endoteliales (no se muestra).
Para la segunda aplicación, se agregaron células de cáncer de mama MDA-MB-231 u osteosarcoma U2OS a cocultivos del día 4 a una densidad de 1.5 x 103 células/pocillo en medio de cultivo fresco que contenía 50 ng / ml BMP-2. Para distinguirlos de los HUVEC marcados con GFP y los hBM-MSC no marcados, las células cancerosas se incubaron con CellTrace FarRed justo antes de la siembra en los nichos osteogénicos. Los cultivos fueron monitoreados por microscopía de fluorescencia; Al principio, la mayoría de las células cancerosas se localizaban cerca de la superficie del sustrato, pero después de 2 días, se podían encontrar más cerca de las capas que contienen los cocultivos vasculares. Por lo tanto, se seleccionó el día 2 como punto de partida para la microscopía de lapso de tiempo para mostrar la dinámica de las interacciones entre las células cancerosas y las células dentro del nicho vascular. Curiosamente, se podía ver que las células MDA-MB-231 se acercaban y se alejaban de las estructuras endoteliales y, por lo tanto, posiblemente estaban sondeando o remodelando su entorno (Figura 5D). Usando CellTrace FarRed como una etiqueta para las células cancerosas, GFP como una etiqueta para HUVEC y tinción adicional para F-actina, todos los tipos de células podrían distinguirse utilizando microscopía de barrido láser confocal (Figura 5E).
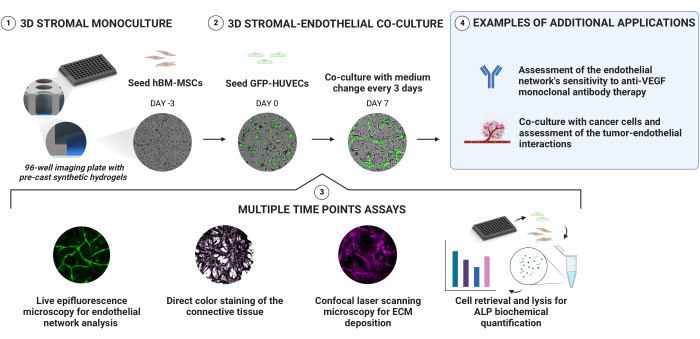
Figura 1: Un enfoque simple para la generación confiable de nichos osteogénicos vascularizados. Los hidrogeles sintéticos prefabricados con un gradiente de rigidez profundo permiten la generación de cultivos 3D a través de la siembra secuencial de células sin necesidad de encapsulación directa. Las hBM-MSC se precultivan durante 3 días antes de agregar las HUVEC que expresan GFP. Los cultivos se monitorean mediante la adquisición de señales de campo claro y GFP longitudinalmente. En puntos de tiempo seleccionados, los nichos se evalúan más a fondo por su deposición de ECM y estado osteogénico. La actividad de la fosfatasa alcalina se evalúa mediante tinción directa del color y recuperando células de los nichos y realizando un ensayo de pNPP en los lisados celulares. Haga clic aquí para ver una versión más grande de esta figura.
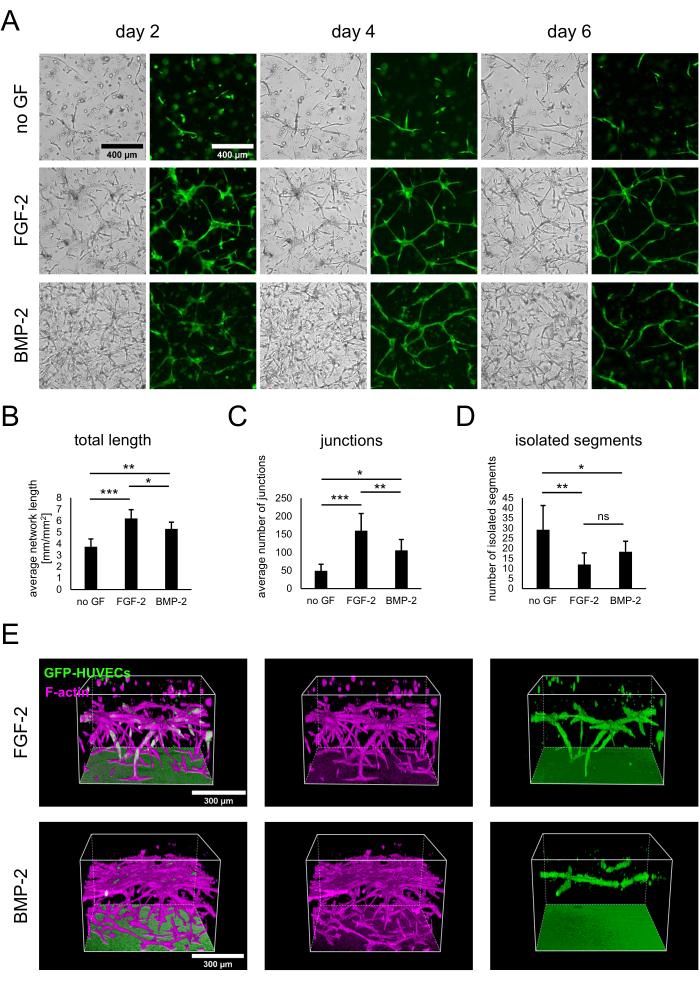
Figura 2: Estimulación de redes vasculares con FGF-2 o BMP-2. (A) Las imágenes de campo claro y fluorescencia (GFP) se adquirieron el día 2, el día 4 y el día 6 del cocultivo de células cultivadas en ausencia de factores de crecimiento o en presencia de FGF-2 o BMP-2, ambos a 50 ng / ml. Barra de escala: 400 μm. (B-D) Parámetros cuantificados de las redes GFP-HUVEC fotografiadas en el día 4 de cocultivo, analizadas utilizando Angiogenesis Analyzer for ImageJ. Los datos se representan como media ± desviación estándar. El análisis estadístico se realizó utilizando GraphPad Prism 9.5.1. Se realizó un ANOVA unidireccional ordinario con la prueba de comparaciones múltiples de Dunnett con n ≥ 4; * P < 0,05; ** P < 0,01; P < 0,001. (E) Reconstrucciones tridimensionales generadas a partir de pilas confocales (altura total: 547.5 μm; paso z: 2.5 μm) de las señales GFP y F-actina para las condiciones estimuladas FGF-2- (fila superior) y BMP-2- (fila inferior). Barra de escala: 300 μm. Haga clic aquí para ver una versión más grande de esta figura.
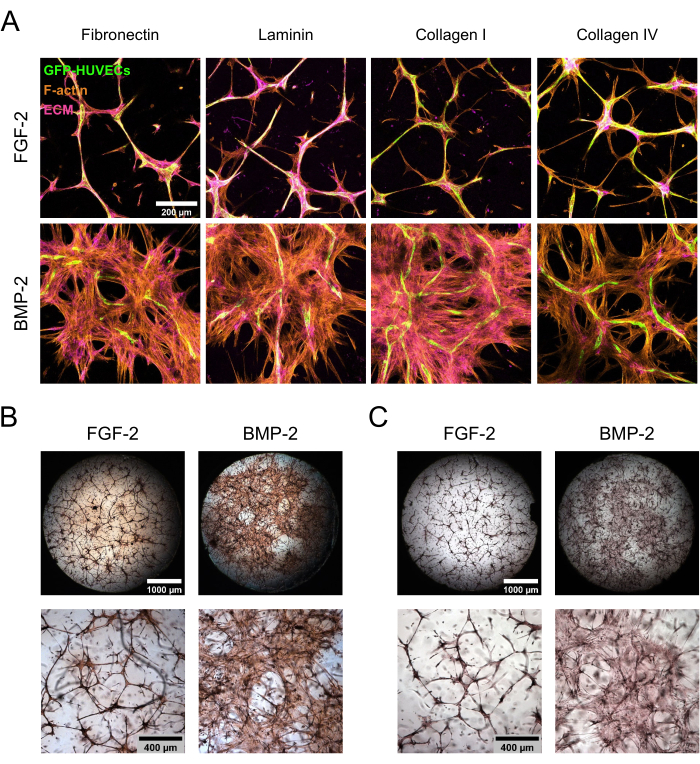
Figura 3: Inducción de propagación deslocalizada de hBM-MSC y deposición de ECM por BMP-2. (A-C) Los cocultivos de 7 días cultivados en presencia de FGF-2 o BMP-2 se sometieron a (A) inmunofluorescencia o (B, C) tinción directa del color. (A) Los cultivos se tiñeron para la actina F y las proteínas ECM fibronectina, laminina, colágeno I y colágeno IV. Las imágenes muestran las proyecciones de intensidad máxima de las pilas confocales (altura total: 100 μm; paso z: 5 μm). Barra de escala: 200 μm. (B,C) Los cultivos se tiñeron usando (B) Rojo Picrosirius y (C) Rojo Alizarina. La fila superior muestra resúmenes cosidos y completos de las imágenes adquiridas con un aumento de 2,5x (barra de escala: 1.000 μm), mientras que la fila inferior representa un campo de visión adquirido con un aumento de 5x (barra de escala: 400 μm). Haga clic aquí para ver una versión más grande de esta figura.
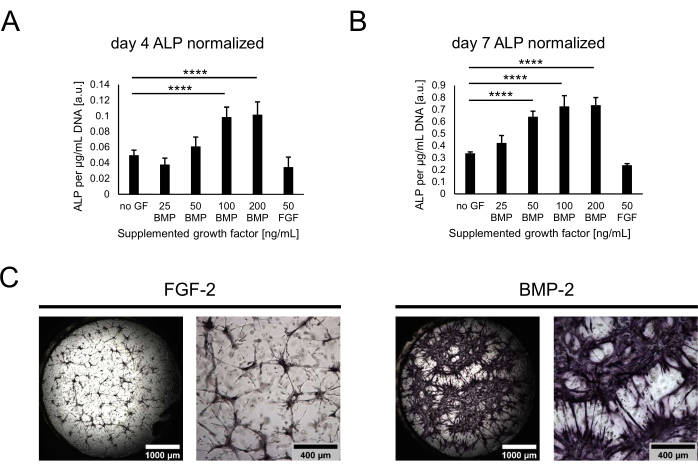
Figura 4: Evaluación bioquímica de la actividad de la ALP inducida por BMP-2 mediante tinción directa del color. (A,B) La actividad ALP se determinó en los lisados celulares de cultivos cultivados en ausencia de factores de crecimiento o en presencia de BMP-2 a diferentes concentraciones o FGF-2 a 50 ng/mL durante (A) 4 días o (B) 7 días de cocultura. La actividad ALP se muestra normalizada al contenido de ADN de cada muestra de lisado. Los datos se representan como media ± desviación estándar. El análisis estadístico se realizó utilizando GraphPad Prism 9.5.1. Se realizó un ANOVA unidireccional ordinario con la prueba de comparaciones múltiples de Dunnett con n = 5; P < 0,0001. (C) Tinción directa del color de la actividad ALP en nichos cultivados en presencia de 50 ng/mL FGF-2 o BMP-2 durante 7 días de cocultivo. Las imágenes del lado izquierdo muestran resúmenes cosidos de imágenes adquiridas con un aumento de 2,5x (barra de escala: 1.000 μm), mientras que las imágenes del lado derecho representan un campo de visión adquirido con un aumento de 5x (barra de escala: 400 μm). Haga clic aquí para ver una versión más grande de esta figura.
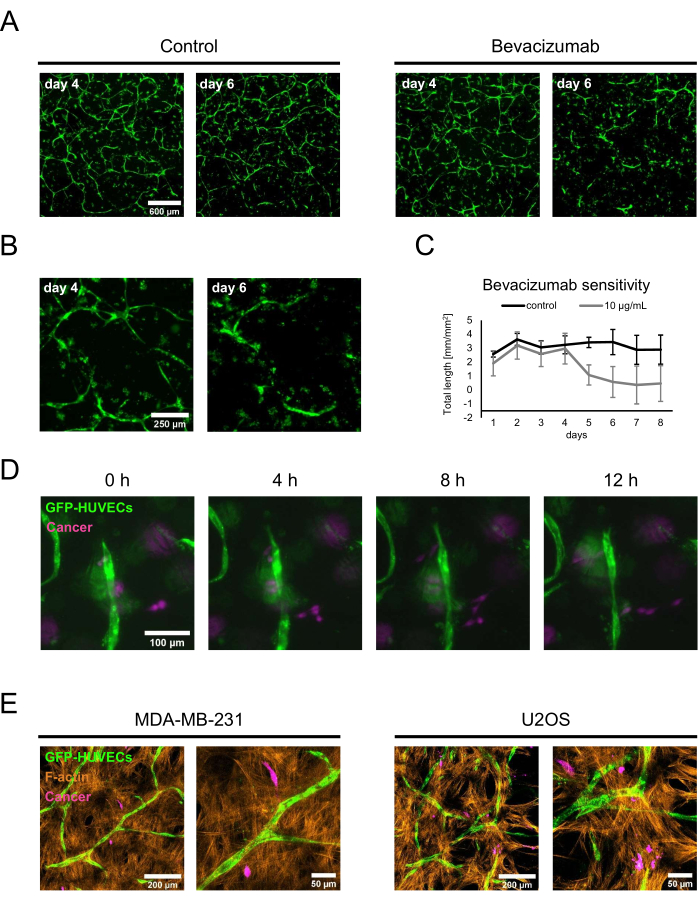
Figura 5: Empleo de nichos osteogénicos vascularizados en modelos avanzados de cáncer. (A) Las señales GFP de cultivos cultivados en presencia de BMP-2 se visualizaron en el día 4 de cocultivo antes de agregar una solución de control (izquierda) o bevacizumab a 10 μg / ml (derecha) durante 2 días, después de lo cual los cultivos se visualizaron nuevamente (día 6 de cocultivo). Barra de escala: 600 μm. (B) Las imágenes de mayor aumento de los cultivos tratados con bevacizumab se muestran en A. Barra de escala: 250 μm. (C) La longitud total de las redes endoteliales como se muestra en A se cuantificó utilizando Angiogenesis Analyzer for ImageJ a partir de imágenes adquiridas diariamente; n ≥ 3. (D) Se agregaron células de cáncer de mama MDA-MB-231 marcadas con FarRed de CellTrace a los cocultivos de 4 días cultivados en presencia de BMP-2, y se adquirieron imágenes de lapso de tiempo a partir de 2 días después de la adición de células cancerosas. Barra de escala: 100 μm. (E) Proyecciones de intensidad máxima de pilas confocales (altura total: 70 μm; paso z: 2,4 μm) de cocultivos triples generados como se describe en D y fijados y teñidos para F-actina. Izquierda: nichos con células de cáncer de mama MDA-MB-231; derecha: nichos con células de osteosarcoma U2OS. Barras de escala para imágenes a la izquierda: 200 μm; Barras de escala para imágenes a la derecha: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, describimos un protocolo para el establecimiento de un modelo in vitro de hueso altamente vascularizado y nichos de médula ósea en una matriz basada en PEG 3D totalmente sintética y controlable, que tiene una variedad de aplicaciones en la investigación de la biología ósea y de la médula ósea, la ingeniería de tejidos y la investigación del cáncer. Este modelo se basa en un hidrogel sintético basado en PEG que se funcionaliza con péptidos RGD y sitios de escisión MMP y se moldea con un gradiente de densidad en profundidad en placas de imágenes de 96 pocillos con fondo de vidrio30. Se demostró que esta plataforma plug-and-play permite el establecimiento de redes celulares 3D altamente interconectadas sin la necesidad de encapsular células en el hidrogel. Similar al protocolo de encapsulación celular descrito anteriormente, en este trabajo, mostramos la remodelación del sustrato mediante un ECM28 inherente a la célula para crear un microambiente específico para el tipo de célula. Por lo tanto, con este método, los ensayos de detección de fármacos y los análisis de alto contenido se pueden realizar fácilmente en condiciones de cultivo 3D organotípicas altamente reproducibles. Las placas de 96 pocillos con fondo de vidrio y los hidrogeles ópticamente transparentes hacen que la plataforma sea compatible con la automatización del manejo de líquidos y la microscopía de alto rendimiento.
El primer paso para generar un nicho de médula ósea vascular osteogénica es el precultivo de hBM-MSCs en el hidrogel PEG durante al menos 3 días. Durante este tiempo, se adhieren al hidrogel, lo penetran y comienzan a establecer contactos célula-célula y deposición de ECM. Antes de sembrar los hBM-MSC, se debe quitar el búfer de almacenamiento. Como el hidrogel está situado dentro de un pozo interior dentro del pocillo estándar de la placa de imágenes de 96 pocillos, es seguro insertar la punta de aspiración a lo largo del lado del pozo hasta que toque el anillo interior del pozo. Se puede usar una bomba de vacío para aspiración si se ajusta a la fuerza de succión más baja posible. Alternativamente, se puede usar una arandela de placas automatizada con la altura de la boquilla ajustada al menos a 0,8 mm por encima del anillo interior del pozo para aspirar el tampón de la placa de hidrogel. El uso de la automatización para el manejo de líquidos puede minimizar el daño a la superficie del hidrogel y conducir a una mayor reproducibilidad de los cultivos resultantes. Pequeños defectos en la superficie del hidrogel se hacen visibles una vez que las células se asientan en el hidrogel y aparecen en un plano de enfoque inferior en áreas de hidrogel defectuosas. Por lo tanto, la adquisición de imágenes de referencia en el día 0 sirve como un buen control de calidad para la homogeneidad de la siembra celular y la integridad de la superficie del hidrogel. Si bien los pequeños defectos superficiales de hidrogel no impiden el uso posterior del pozo, las células tienden a agruparse en las áreas defectuosas y pueden crecer en patrones no representativos o llegar más rápidamente al vidrio inferior, donde crecen en una monocapa. Estos artefactos deben tenerse en cuenta al usar/evaluar estos pozos. Consideraciones similares se aplican a cualquier cambio de medio realizado durante toda la duración del ensayo.
El segundo paso del protocolo implica la adición de GFP-HUVECs al monocultivo hBM-MSC preformado (día 0 de cocultivo). La ECM depositada por el hBM-MSC proporciona un gran andamio para el crecimiento de células endoteliales, que en este trabajo, incluso en presencia de medio condicionado por hBM-MSC, solo podrían formar grupos de células redondas en los hidrogeles (no se muestra). Al sembrar en los cultivos hBM-MSC, los HUVEC integran y forman estructuras similares a microvasos comparables a las observadas en cocultivos generados por encapsulación celular27,28. Por lo general, las redes microvasculares 3D bien desarrolladas se forman dentro de los 4 días posteriores al cocultivo, y esto puede ser monitoreado longitudinalmente mediante el uso de HUVEC marcados con GFP. Estas estructuras se pueden mantener durante al menos 7 días en cultivo, lo que significa que hay tiempo suficiente para seguir los cambios en la organización de la red vascular en respuesta a los tratamientos, como para la detección de fármacos antiangiogénicos. Los elementos morfológicos de la red endotelial se pueden cuantificar en modo por lotes segmentando las imágenes GFP utilizando herramientas bien establecidas, como el complemento Angiogenesis Analyzer de ImageJ33, y sus parámetros se pueden utilizar para evaluar, por ejemplo, la eficacia del fármaco y la farmacodinámica.
Una ventaja significativa del modelo celular descrito para muchas aplicaciones potenciales es su plasticidad. Simplemente complementar el medio de cultivo con diferentes factores de crecimiento puede cambiar la apariencia del cocultivo. Por ejemplo, la presencia de BMP-2 durante todo el período de monocultivo y cocultivo crea un nicho vascular osteogénico, mostrando una mayor actividad de ALP, deposición de calcio extracelular, así como ensamblaje y deposición de ECM. Por el contrario, en presencia de FGF-2, los marcadores osteogénicos están ausentes, y el cocultivo forma menos asociaciones celulares laterales, pero muestra un crecimiento celular 3D más pronunciado. El hecho de que FGF-2 suprime la actividad de ALP mientras que BMP-2 provoca una actividad de ALP más fuerte en comparación con ningún tratamiento con factor de crecimiento está de acuerdo con observaciones anteriores27. Sin embargo, a pesar de estas grandes diferencias en el componente estromal hBM-MSC, la extensión de la red microvascular fue muy similar para las dos condiciones tratadas con factor de crecimiento en este trabajo. En los cultivos de control, solo se formaron unas pocas redes vasculares cortas, lo que representa quizás un nicho de médula ósea poco vascularizado. Esto sugiere que simplemente cambiando el tipo, la concentración y el momento de los factores de crecimiento agregados al medio de cultivo, se podría producir una gama de nichos de médula ósea vascularizados bien definidos, como se requeriría para estudios comparativos. Sin embargo, para garantizar resultados reproducibles, es importante tener en cuenta que la progresión del cultivo y la morfología pueden variar dependiendo de la historia de las células utilizadas (por ejemplo, el número de paso y el método de desprendimiento utilizado durante el mantenimiento rutinario del cultivo), y es aconsejable controlar tales factores durante el diseño del ensayo.
Aquí, como primera aplicación de este modelo, demostramos la sensibilidad de las redes microvasculares diseñadas para el tratamiento con bevacizumab. En particular, es importante confirmar que el algoritmo utilizado puede reconocer con precisión la red endotelial, ya que los artefactos a menudo se generan en imágenes con redes poco desarrolladas. Si este es el caso, los parámetros utilizados para el procesamiento de imágenes (antes y durante la segmentación) deben ajustarse, a menudo sobre una base de prueba y error.
Como segunda aplicación, presentamos un modelo avanzado de cocultivo formado por la siembra secuencial de células mesenquimales, endoteliales y cancerosas. Este modelo permite estudiar las interacciones entre las células cancerosas, el estroma y la vasculatura de la médula ósea, que pueden ser factores importantes durante la metástasis. Además, este modelo podría usarse para aplicaciones de detección de medicamentos y probar compuestos con objetivos más allá de la angiogénesis.
En los cultivos 2D, las células no reciben señales microambientales fisiológicas, no adquieren morfologías celulares naturales y, en consecuencia, se diferencian de manera diferente en comparación con las células en ambientes3D nativos 35. Cuando se cultivan en hidrogeles 3D diseñados, las células depositan una ECM inherente desde el principio, que proporciona sitios de adhesión y puede ser remodelada activamente28,36. Aquí, para establecer un modelo 3D simplificado para aplicaciones de cribado, las células formadoras de vasos se sembraron en la superficie de hidrogeles diseñados y se les permitió establecer redes vasculares en ausencia de perfusión. Las evaluaciones basadas en imágenes se realizaron en proyecciones 2D de las células endoteliales que contribuyen a las estructuras vasculares. Sin embargo, solo las imágenes confocales revelaron el crecimiento menos pronunciado de las redes vasculares 3D en las muestras estimuladas por BMP-2 en comparación con las muestras estimuladas por FGF-2. Esto sugiere que la longitud de las estructuras vasculares formadas fue subestimada, mientras que su conectividad fue sobreestimada. Además, no se han investigado las interacciones entre las células perivasculares y endoteliales y la formación de luz vascular. Estos aspectos, especialmente en términos de respuestas al tratamiento farmacológico, requerirán mayor atención. Finalmente, los protocolos refinados para establecer primero extensas redes vasculares 3D y solo entonces inducir su diferenciación osteogénica serían deseables para generar modelos más fisiológicos de hueso y médula ósea.
En general, el modelo presentado aquí es muy versátil y se puede adaptar fácilmente a aplicaciones específicas. Por ejemplo, se podrían utilizar células mesenquimales y endoteliales de diferentes fuentes. Se sabe que las MSCs de tejido adiposo y las MSCs de cordón umbilical expresan diferentes factores angiogénicos en comparación con las BM-MSCs, pudiendo ser fácilmente sustituidas como un componente estromal alternativo37. También podrían utilizarse células endoteliales aisladas de nichos de médula ósea ya definidos en lugar de HUVECs. También se podría establecer el cocultivo con células mesenquimales y endoteliales de médula ósea derivadas del paciente para aplicaciones de medicina personalizada, como se ha sugerido recientemente para cocultivos musculares vascularizados38. Además, el diseño de la placa de hidrogel permite la monitorización longitudinal del cultivo tanto con microscopía de campo claro como de fluorescencia, ofreciendo así al usuario la posibilidad de acortar o extender el tiempo de cultivo dependiendo de la aplicación. Alternativamente, las densidades celulares utilizadas para la siembra podrían ajustarse en consecuencia para acelerar o retrasar la formación de la red celular si se necesitan tiempos de observación más cortos o más largos que los de este protocolo. En cualquier caso, se debe tener precaución para evitar el crecimiento excesivo de células en estructuras similares a láminas, lo que puede conducir a la contracción del hidrogel y al eventual desprendimiento celular.
Finalmente, se puede realizar una amplia gama de ensayos utilizando este modelo. Además de la inmunofluorescencia y la microscopía realizadas en cultivos vivos o fijos, los cultivos 3D pueden ser digeridos enzimáticamente, y las células pueden ser recuperadas y sometidas a cualquier tipo de ensayo bioquímico. Aquí, demostramos la determinación de la actividad de ALP y la cuantificación del contenido de ADN en lisados celulares utilizando ensayos colorimétricos / fluorométricos, pero el sistema es compatible con muchas otras técnicas, incluyendo PCR, RNAseq y proteómica. Si la sensibilidad del ensayo deseado no es muy alta, se pueden agrupar muestras de más de un pocillo para aumentar la cantidad de muestra disponible para el ensayo. Si la aplicación deseada requiere una disolución de gel más rápida, la agitación orbital de la placa podría aplicarse en combinación con volúmenes más pequeños de la solución digestiva para garantizar la formación de vórtices en los pozos, suponiendo que todos los pocillos de la placa se usarán de esta manera (los cultivos vivos son sensibles a un manejo tan duro). En resumen, presentamos aquí un protocolo que, si se utiliza como se describe, garantiza la generación de un modelo in vitro que recapitula los aspectos clave de los nichos vasculares osteogénicos, pero también es lo suficientemente versátil como para ser modificado para aplicaciones a medida.
Divulgaciones
Ectica Technologies AG es el fabricante de la placa de pozo de hidrogel 3DProSeed y tiene intereses comerciales. Benjamin R. Simona y Martin Ehrbar son accionistas de Ectica Technologies AG.
Agradecimientos
Los autores desean agradecer a Riccardo Urbanet por la asistencia técnica con los dispositivos de manejo de líquidos y a Rodi Odabasi por su apoyo con la microscopía de epifluorescencia. Este trabajo fue financiado por la Fundación Nacional Suiza para la Ciencia (números de subvención 310030E_202429 y 205321_204318) y Ectica Technologies AG.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200-072 | |
| 2 mL microtubes | Eppendorf | 30120094 | |
| 2-Amino-2-methyl-1-propanol | Sigma | A9199 | |
| 3DProSeed hydrogel well plate | Ectica Technologies | ECT.PS1.001.096 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate | Sigma | 71768 | |
| Alizarin Red S | Sigma | A5533 | |
| Anti-Collagen IV antibody | Abcam | ab6311 | |
| Anti-Laminin 1+2 antibody | Abcam | ab7463 | |
| Automated plate washer | Agilent Biotek | ELχ50 | |
| Automated washer/dispenser | Agilent Biotek | MULTIFLO FX equipped with a peristaltic pump 5uL cassette | |
| Bevacizumab | Evidentic | ID PS-E07-2019-00119 A009 | |
| BMP-2 | Peprotech | 120-02C | |
| BSA | AppliChem | A1391 | |
| Centrifuge | Eppendorf | 5415 R | To centrifuge 2 mL tubes at 16100 x g during ALP analysis |
| Confocal laser scanning microscope | Leica | Stellaris 5 | |
| Conical 50 mL centrifuge tubes | TPP | 91050 | |
| DAPI | Sigma | D9542 | |
| DyLight 649 Donkey anti-rabbit IgG (minimal x-reactivity) Antibody | Biolegend | 406406 | |
| DyLight 649 Goat anti-mouse IgG (minimal x-reactivity) Antibody | Biolegend | 405312 | |
| EGM-2 | Lonza | CC-3162 | |
| Epifluorescence microscope | Leica | DMI6000B | |
| FBS | Gibco | 10500-064 | |
| FGF-2 | Peprotech | 100-18B | |
| Fibronectin (IST-9) | Santa Cruz | sc-59826 | |
| GFP-HUVECs | PELOBiotech | PB-CAP-0001GFP | |
| hBM-MSCs | - | - | Isolated at University Hospital Basel; Papadimitropoulos A, Piccinini E, Brachat S, et al. Expansion of human mesenchymal stromal cells from fresh bone marrow in a 3D scaffold-based system under direct perfusion. PLoS One. 2014;9(7):e102359 |
| Inverted microscope | Zeiss | 200M | |
| Magnesium chloride | Sigma | M8266 | |
| MDA-MB-231 breast cancer cell line | - | Kindly obtained from J Massagué at the Memorial Sloan-Kettering Cancer Center | |
| MEMα | Gibco | 22571-038 | |
| Multimode imaging reader | Agilent Biotek | Cytation 1 | For automated imaging |
| Multimode imaging reader - fluorescence and absorbance | Agilent Biotek | Cytation 5 | For measuring absorbance and fluorescence intensity duing ALP analysis |
| Paraformaldehyde | Artechemis | US 040 | |
| PBS | Gibco | 10010-015 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Phalloidin-rhodamine | Invitrogen | R415 | |
| Picro-Sirius Red Solution | Abcam | ab246832 | |
| Quant-iT PicoGreen dsDNA Assay kit | ThermoFisher Scientific | P7589 | |
| Recombinant Anti-Collagen I antibody | Abcam | ab260043 | |
| SIGMAFAST BCIP/NBT | Sigma | B5655-25TAB | |
| Sodium hydroxide | Sigma | 1064981000 | |
| Sodium phosphate dibasic, anhydrous | Sigma | S-0876 | |
| Sodium phosphate monobasic, monohydrate | Merck | 1.06346 | |
| Triton X-100 | Sigma | T8787 | |
| Tween20 | AppliChem | A4974 | |
| U2OS osteosarcoma cell line | - | Kindly obtained from J Snedeker at the Institute for Biomechanics, Zurich | |
| α-trehalose dihydrate | Sigma | 90208 |
Referencias
- Mendez-Ferrer, S., et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466 (7308), 829-834 (2010).
- Calvi, L. M., Link, D. C. Cellular complexity of the bone marrow hematopoietic stem cell niche. Calcified Tissue International. 94 (1), 112-124 (2014).
- Behrmann, L., Wellbrock, J., Fiedler, W. Acute myeloid leukemia and the bone marrow niche-take a closer look. Frontiers in Oncology. 8, 444 (2018).
- Yip, R. K. H., et al. Mammary tumour cells remodel the bone marrow vascular microenvironment to support metastasis. Nature Communications. 12 (1), 6920 (2021).
- Potente, M., Makinen, T. Vascular heterogeneity and specialization in development and disease. Nature Reviews Molecular Cell Biology. 18 (8), 477-494 (2017).
- Augustin, H. G., Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science. 357 (6353), (2017).
- Kusumbe, A. P., Ramasamy, S. K., Adams, R. H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 507 (7492), 323-328 (2014).
- Barillari, G. The anti-angiogenic effects of anti-human immunodeficiency virus drugs. Frontiers in Oncology. 10, 806 (2020).
- Owen, M., Friedenstein, A. J. Stromal stem-cells - Marrow-derived osteogenic precursors. Ciba Foundation Symposia. 136, 42-60 (1988).
- Sacchetti, B., et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 131 (2), 324-336 (2007).
- Traore, M. A., George, S. C. Tissue engineering the vascular tree. Tissue Engineering. Part B, Reviews. 23 (6), 505-514 (2017).
- Bessy, T., Itkin, T., Passaro, D. Bioengineering the bone marrow vascular niche. Frontiers in Cell and Developmental Biology. 9, 645496 (2021).
- Bray, L. J., et al. A three-dimensional ex vivo tri-culture model mimics cell-cell interactions between acute myeloid leukemia and the vascular niche. Haematologica. 102 (7), 1215-1226 (2017).
- Montano, I., et al. Formation of human capillaries in vitro: The engineering of prevascularized matrices. Tissue Engineering Part A. 16 (1), 269-282 (2010).
- Sun, Z. Y., Kemp, S. S., Lin, P. K., Aguera, K. N., Davis, G. E. Endothelial k-RasV12 expression induces capillary deficiency attributable to marked tube network expansion coupled to reduced pericytes and basement membranes. Arteriosclerosis Thrombosis and Vascular Biology. 42 (2), 205-222 (2022).
- Kleinman, H. K., et al. Basement-membrane complexes with biological-activity. Biochemistry. 25 (2), 312-318 (1986).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement-membrane in the morphological-differentiation of human-endothelial cells into capillary-like structures. Journal of Cell Biology. 107 (4), 1589-1598 (1988).
- Davis, G. E., et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes. Methods in Molecular Biology. 1066, 17-28 (2013).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
- Bersini, S., et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone. Biomaterials. 35 (8), 2454-2461 (2014).
- Wang, X. L., et al. Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels. Lab on a Chip. 16 (2), 282-290 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
- Kyburz, K. A., Anseth, K. S. Synthetic mimics of the extracellular matrix: How simple is complex enough. Annals of Biomedical Engineering. 43 (3), 489-500 (2015).
- Ehrbar, M., et al. Enzymatic formation of modular cell-instructive fibrin analogs for tissue engineering. Biomaterials. 28 (26), 3856-3866 (2007).
- Ehrbar, M., et al. Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules. 8 (10), 3000-3007 (2007).
- Blache, U., et al. Dual role of mesenchymal stem cells allows for microvascularized bone tissue-like environments in PEG hydrogels. Advanced Healthcare Materials. 5 (4), 489-498 (2016).
- Blache, U., et al. Notch-inducing hydrogels reveal a perivascular switch of mesenchymal stem cell fate. Embo Reports. 19 (8), e45964 (2018).
- Simona, B. R., et al. Density gradients at hydrogel interfaces for enhanced cell penetration. Biomaterials Science. 3 (4), 586-591 (2015).
- Zhang, N., et al. Soft hydrogels featuring in-depth surface density gradients for the simple establishment of 3d tissue models for screening applications. SLAS Discovery. 22 (5), 635-644 (2017).
- Martin, I., Muraglia, A., Campanile, G., Cancedda, R., Quarto, R. Fibroblast growth factor-2 supports ex vivo expansion and maintenance of osteogenic precursors from human bone marrow. Endocrinology. 138 (10), 4456-4462 (1997).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Carpentier, G., Martinelli, M., Courty, J., Cascone, I. Angiogenesis Analyzer for ImageJ. 4th ImageJ User and Developer Conference. , 198-201 (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Loebel, C., Mauck, R. L., Burdick, J. A. Local nascent protein deposition and remodelling guide mesenchymal stromal cell mechanosensing and fate in three-dimensional hydrogels. Nature Materials. 18 (8), 883-891 (2019).
- Curtis, M. B., Kelly, N., Hughes, C. C. W., George, S. C. Organotypic stromal cells impact endothelial cell transcriptome in 3D microvessel networks. Scientific Reports. 12 (1), 20434 (2022).
- Wust, R., Terrie, L., Muntefering, T., Ruck, T., Thorrez, L. Efficient co-isolation of microvascular endothelial cells and satellite cell-derived myoblasts from human skeletal muscle. Frontiers in Bioengineering and Biotechnology. 10, 964705 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados