Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estabilización de una osteotomía de fémur con fijación en placa en Ambystoma mexicanum
En este artículo
Resumen
Se presenta un protocolo para la cirugía de osteotomía femoral con el uso de la fijación interna de la placa en ajolotes maduros. El procedimiento se puede utilizar para realizar estudios comparativos sobre la regeneración de extremidades y la curación de fracturas en anfibios acuáticos.
Resumen
El ajolote (Ambystoma mexicanum) es un organismo modelo prometedor para la medicina regenerativa debido a su notable capacidad para regenerar órganos perdidos o dañados, incluidas extremidades, cerebro, corazón, cola y otros. Los estudios sobre el ajolote arrojan luz sobre las vías celulares y moleculares que gobiernan la activación de los progenitores y la restauración de tejidos después de una lesión. Este conocimiento se puede aplicar para facilitar la curación de lesiones incompetentes por regeneración, como la pseudoartrosis ósea. En el protocolo actual se describe la estabilización de la osteotomía fémur mediante un sistema de fijación interna de placa. El procedimiento fue adaptado para su uso en animales acuáticos (ajolote, Ambystoma mexicanum). ≥Se utilizaron ajolotes de 20 cm desde el hocico hasta la punta de la cola con fémures comparables del tamaño de un ratón totalmente osificados, y se prestó especial atención a la posición y fijación de la placa, así como a los cuidados postoperatorios. Esta técnica quirúrgica permite la fijación ósea estandarizada y estabilizada y podría ser útil para la comparación directa con la regeneración de extremidades de ajolotes y estudios análogos de la curación ósea en anfibios y mamíferos.
Introducción
El ajolote (Ambystoma mexicanum) es un modelo importante para la regeneración de órganos, incluyendo la cola, la médula espinal, el cerebro, el corazón, las branquias y las extremidades 1,2,3,4,5. Los estudios detallados de la regeneración de las extremidades de los ajolotes descubrieron mecanismos de desdiferenciación celular y la formación de un grupo de células madre, blastema, en el sitio de la amputación. Debido a la capacidad de las células del blastema para reconstruir todas las partes faltantes de las extremidades, incluido un esqueleto con patrón 6,7, el ajolote parece ser un organismo modelo atractivo para los estudios de curación ósea. Recientemente, varios estudios se centraron más en la biología ósea de los ajolotes, describiendo la morfología del esqueleto, la composición celular y la dinámica de osificación.
Se encontró en mamíferos que el proceso de curación ósea en huesos largos ocurre a través de la osificación endocondral y consta de varias etapas: hematoma, tejido de granulación y formación de callos blandos, osificación de callos en callo duro y hueso tejido, y remodelación ósea8. Un estudio reciente ha demostrado que se pueden observar etapas similares en la cicatrización del hueso del ajolote9.
Hasta ahora, las fracturas de ajolote se estudiaban en un sistema no estabilizado, en el que el hueso se corta simplemente con tijeras de iridectomía. Las grandes fracturas se crearon en el zeugópodo, donde la osteotomía se realiza en uno de los huesos, mientras que el otro sirve de soporte10,11. Por el contrario, las fracturas se estudian de forma rutinaria en mamíferos, incluidas ratas y ratones, utilizando sistemas de fijación confiables, como clavos intramedulares y placas de alineación ósea, para controlar el tamaño de la fractura y garantizar la alineación ósea.
Por lo tanto, el método tiene como objetivo asegurar una fijación estabilizada y uniforme del fémur del ajolote antes de la osteotomía. Con el fin de hacer los estudios de ajolotes más comparables con los de los mamíferos, incluidos los ratones y los humanos, se consideró la fijación del pinintramedular 12, el fijador de la placa externa13,14 y la fijación de la placa de alineación ósea interna 15,16,17. Se demostró que este último asegura la correcta fijación del hueso y permite crear un espacio de cierto tamaño mediante el uso de uno o dos cortes con una sierra Gigly de un diámetro específico. Como los ajolotes representan las larvas acuáticas de Ambystoma mexicanum, el fijador externo podría haber causado complicaciones postquirúrgicas debido a la herida abierta y al contacto con el agua. Dado que los ajolotes no desarrollan centros de osificación secundarios incluso hasta muy tarde en su desarrollo (20 años18) y, por lo tanto, no se podía evitar que el clavo intramedular estándar utilizado en ratones perforara las epífisis, se tomó la decisión de aplicar un método de fijación de placas internas a los ajolotes grandes. En los ajolotes grandes, el tamaño del fémur y el grado de osificación se asemejan a los de un ratón adulto, lo que permite una osteotomía diafisaria media con fijación de placa de titanio1.
El tamaño del espacio de fractura determina en gran medida la dinámica de curación y el resultado. Por ejemplo, en un ratón, las fracturas estabilizadas de 0,25 mm se curan principalmente a través de la osificación intramembranosa debido a su pequeño tamaño y estabilización rígida; una fractura de 0,7 mm cicatriza por osificación endocondral, con la formación de un callo cartilaginoso alrededor de la fractura; Los defectos grandes, como los defectos de tamaño crítico de 3,5 mm, no se curan completamente y, por lo tanto, se utilizan para modelar la falta de consolidación de la fractura ósea16. En este estudio, se estableció el protocolo de fijación en placa del fémur del ajolote antes de la osteotomía utilizando el ejemplo de un espacio de fractura de 0,7 mm con el objetivo final de comparar la cicatrización del hueso del ajolote con la del ratón9.
Después de la osteotomía, las fracturas se sometieron al proceso de osificación endocondral, aunque más lento que en los ratones, posiblemente debido al estilo de vida acuático de los ajolotes y a tasas de división celular más lentas. En el método que aquí se presenta, se muestra la osteotomía de espacio de 0,7 mm con fijación de placa rígida; Sin embargo, otros tamaños de espacio y fijadores semiflexibles, así como placas de diferentes materiales, son potencialmente posibles. En general, el método presentado aquí se puede utilizar para la fijación ósea estandarizada y será útil para los estudios que comparan la regeneración de las extremidades de los ajolotes con la cicatrización ósea o para estudiar la cicatrización ósea en ajolotes en diferentes condiciones para garantizar la fijación estandarizada de las fracturas.
Protocolo
El siguiente procedimiento se realizó con la aprobación del Magistrado de Viena (GZ: MA 58-65248-2021-26). De 5 a 8 años de edad, ≥se utilizaron ajolotes de 20 cm de largo (hocico a la punta de la cola) de 20 cm para la cirugía de fracturas y amputaciones. Para las cirugías se utilizaron tanto hombres como mujeres. Los ajolotes se criaron en las instalaciones del Instituto de Investigación de Patología Molecular. El dolor y el riesgo de infecciones se trataron con analgésicos y antibióticos adecuados para garantizar un resultado exitoso. Los reactivos y equipos utilizados para el estudio se enumeran en la Tabla de Materiales.
1. Preparación animal
- Bañe al animal en una solución de benzocaína al 0,03% durante unos 15-20 minutos hasta que se alcance la sedación completa y no haya movimiento reflejo al tocar las extremidades con pinzas.
- Coloque al animal con el lado ventral hacia abajo sobre toallas de papel húmedas empapadas en una solución de benzocaína al 0,03% y cúbralo con toallas de papel empapadas en benzocaína. La piel de los animales acuáticos, como los ajolotes, es sensible a la sequedad y, por lo tanto, es esencial cubrir la superficie corporal para evitar la deshidratación y asegurar la respiración cutánea (piel).
- Estire la extremidad trasera que se va a operar con pinzas de anillo. No aplique reactivos desinfectantes, como etanol, ya que la piel del ajolote es sensible a los productos químicos y se irrita fácilmente. En su lugar, use 0.7x PBS (A-PBS) con 50 U/mL de penicilina y 20 μg/mL de estreptomicina para limpiar la extremidad y luego para la irrigación ósea al aserrar.
NOTA: La infección generalmente no es una preocupación para las cirugías realizadas en ajolotes. Sin embargo, debido a la naturaleza acuática de estos animales y a las suturas colocadas en la superficie de la piel, recomendamos el uso de antibióticos para evitar cualquier contaminación del sitio quirúrgico.
2. Cirugía
NOTA: Esterilice todos los instrumentos quirúrgicos. Los métodos de esterilización comunes, como la esterilización por calor, el autoclave y el lavado en etanol al 70%, seguidos de la eliminación completa de los restos de alcohol, son adecuados para este propósito. Si opera en varios animales, esterilice las herramientas entre medias con un esterilizador de perlas calientes o etanol al 70%.
- Realizar una incisión longitudinal lateral (1,5-2 cm) con un bisturí por encima del hueso del fémur que abarque todo el muslo en la extremidad posterior superior. Para hacer esto, palpa el hueso antes de cortar la piel.
- Desplazar con cuidado los músculos y nervios del sitio de la cirugía sin cortar. Use pinzas arqueadas para hacerlo de manera eficiente.
- Coloque suavemente pinzas arqueadas debajo del fémur para exponerlo para la cirugía.
- Coloque una placa fijadora rígida de 7,75 mm y 4 orificios junto con la diáfisis del fémur, evitando tocar las articulaciones, y asegúrela en la posición alineada con pinzas.
- Utilice cuatro tornillos de titanio de 2 mm para fijar el hueso a la placa.
NOTA: Los tornillos utilizados en este protocolo tienen un diseño complejo y constan de 4 partes: la parte principal (se atornillará en el hueso), cabeza de tornillo (permite la extracción de los tornillos y la placa con la llave de caja cuadrada), cuello más estrecho (utilizado como punto de rotura una vez que el tornillo se aprieta en el hueso) y un mango de tornillo (utilizado para sujetar al destornillador y al dispositivo de guía de la sierra). - El orden de fijación de los tornillos es importante. Comience con los tornillos interiores primero y luego con los dos tornillos exteriores para asegurarse de que la placa esté alineada con el eje del hueso. Utilice un taladro manual para crear el primer orificio en el hueso para facilitar la inserción del tornillo, seguido de la colocación del1er tornillo. Taladre en el centro de la circunferencia ósea para evitar el hueso más delgado en un lado, lo que puede resultar en una fractura ósea espontánea. Utilice el riego con 0,7x PBS + 1% de pluma/estreptococo durante la perforación. No rompa el mango de los tornillos de la1ª (opcional:1ª y2ª).
- Aplique el dispositivo de guía de la sierra en el 1tornillo (opcional: 1punto y 2) y alinéelo con el hueso y la placa.
NOTA: En este protocolo, el mismo fabricante proporciona una placa, tornillos, un dispositivo de guía de sierra y una sierra y se optimizan para adaptarse entre sí. El dispositivo de guía de sierra puede venir en diferentes tamaños para ser compatible con diferentes placas y tamaños de sierra. - Utilice el dispositivo de guía de la sierra para perforar e insertar el resto de los tornillos. Asegúrese de alinear la placa con el hueso. Rompe las manijas de los tornillos.
- Coloque un trozo de película plástica (6-7 mm por 4-5 cm), esterilizado con etanol al 70% y luego esterilizado en autoclave o esterilizado con calor (140 °C durante 4 horas), debajo del fémur para evitar daños en los tejidos blandos durante el proceso de osteotomía.
NOTA: Para este propósito, se puede usar un trozo de película de plástico, cortado de una bolsa para la esterilización por calor. - Coloque la sierra de alambre Gigly entre el hueso y la película de protección.
- Corte el hueso con la sierra de hilo Gigly de 0,66 mm, creando un solo corte de 0,7 mm en el fémur. Utilice el riego constante con 0,7x PBS + 1% de pluma/estreptococo durante el aserrado para minimizar el daño y la fricción en los tejidos.
- Retire la sierra y la guía de la sierra y use un destornillador para separar los mangos de los tornillos.
- Retire la película protectora e irriga el sitio de la cirugía con 0.7x PBS + 1% Pen/Strep.
- Cubra la parte superior de la placa y los tornillos con cera de abeja de hueso estéril para proteger la piel y los músculos de la irritación por los bordes de los tornillos.
- Coloca los músculos y la piel encima del hueso de cera de abeja.
- Cierre el sitio de la incisión con una sutura sintética 7.0 (polipropileno/polietileno) usando puntos interrumpidos simples. La sutura sintética se utiliza para minimizar la contaminación con bacterias y hongos transmitidos por el agua.
3. Manejo postoperatorio
- Para despertar al animal, colóquelo en un tanque con agua fresca de estanque artificial, suplementada con 50 U/mL de penicilina, 20 μg/mL de estreptomicina y Butorfanol analgétic (0,5 mg/L de agua).
- Observe al animal para comenzar a mover las branquias, dar pasos y nadar, generalmente dentro de 1 hora después de la cirugía.
- Mantenga al animal durante 3 días en agua de estanque artificial con 50 U/mL de penicilina y 20 μg/mL de estreptomicina antes de devolverlo al tanque de retención. Para asegurar la analgesia, añadir Butorfanol (0,5 mg/L de agua).
- Asegúrese de que las suturas permanezcan en su lugar y que se produzca una cicatrización adecuada de la herida.
Resultados
El procedimiento quirúrgico descrito aquí (Figura 1) dura entre 20 min y 30 min y requiere un cirujano y un asistente. Opcionalmente, utilice un microscopio de disección binocular o un sistema de lupa.
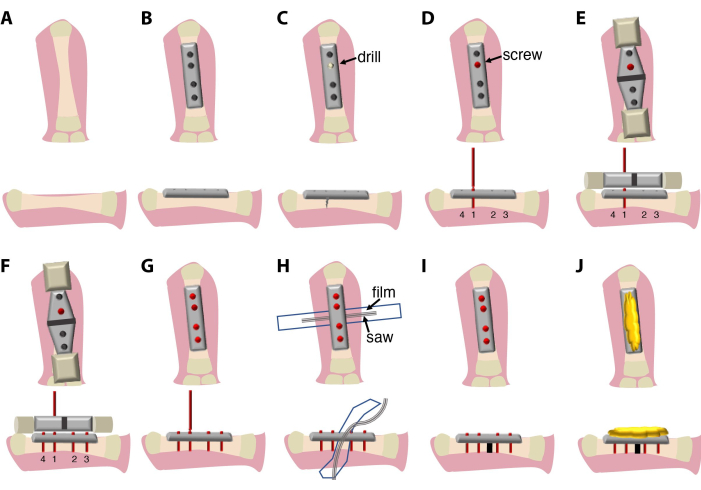
Figura 1: Esquemas del procedimiento quirúrgico y la configura...
Discusión
El método actualmente descrito de fijación de la placa de fémur y osteotomía permite su aplicación en animales acuáticos, como el Ambystoma mexicanum (axolotl). Este método quirúrgico se utilizó recientemente para comparar la cicatrización de fracturas y la regeneración de extremidades en ajolotes con la cicatrización de fracturas en ratones9. Al igual que en los ratones, se puede unir una placa fijadora de 4 orificios al hueso con tornillos a...
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Los autores desean agradecer a Sabine Stumpp por su excelente apoyo técnico y a Lidia Grösser por su asistencia en las cirugías. Esta investigación fue financiada por el Fondo Austriaco para la Ciencia [Hertha Firnberg Fellowship número T-1219], ERC [Advanced Grant, 742046 RegGeneMems], DFG [CRC 1444].
Materiales
| Name | Company | Catalog Number | Comments |
| 0.66 mm Gigly wire saw | RISystem | RIS.590.120 | |
| 7.0 Optilene suture | Braun | C3090538 | |
| Benzocaine | Sigma-Aldrich | E1501 | dilute to 0.03% prior to using |
| Butorphanol (Butomidor 10 mg/mL) | Richter Pharma AG | - | dilute to 0.5 mg/L prior to using |
| Drill bit 0.30 mm | RISystem | RIS.590.200 | |
| Dumont #5 Forceps - Standard/Inox | Fine Science Tools | 11251-20 | |
| Hand drill | RISystem | RIS.390.130 | better to have at least 3 pieces |
| Micro CT data analyzer | Bruker, Billerica, MA, USA | SkyScan NRecon software | |
| Micro CT specimen scanner | Bruker, Billerica, MA, USA | SkyScan 1172 | |
| Moria MC31b Iris forceps - smooth, curved, 10 cm | Fine Science Tools | 11373-12FST | 2 pieces |
| MouseFix Drill-&Saw guide 1.75 mm, rigid | RISystem | RIS.301.102 | |
| MouseFix plate 4 hole, rigid | RISystem | RIS.401.110 | |
| MouseFix screw, L =2.00 mm | RISystem | RIS.401.100 | need 4 per bone |
| Narrow Pattern Forceps | VWR | FSCI11002-12 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| Ring forceps | Fine Science Tools | 11103-09 | |
| scalpel #15 | B Braun, Thermo Fischer Scientific | 5518032 | |
| Square box wrench 0.50 mm | RISystem | RIS.590.111 | |
| Sterile bone wax, 2.5 g | Ethicon, Johnson & Johnson | W810 | |
| Student Fine Scissors - Straight/11.5cm | Fine Science Tools | 91460-11 |
Referencias
- Amamoto, R., et al. Adult axolotls can regenerate original neuronal diversity in response to brain injury. Elife. 5, 13998 (2016).
- Butler, E. G., Ward, M. B. Reconstitution of the spinal cord following ablation in urodele larvae. J Exp Zool. 160 (1), 47-65 (1965).
- Echeverri, K., Tanaka, E. M. Ectoderm to mesoderm lineage switching during axolotl tail regeneration. Science. 298 (5600), 1993-1996 (2002).
- Vargas-Gonzalez, A., Prado-Zayago, E., Leon-Olea, M., Guarner-Lans, V., Cano-Martinez, A. Myocardial regeneration in Ambystoma mexicanum after surgical injury. Arch Cardiol Mex. 75 (3), S321-S329 (2005).
- Vieira, W. A., Wells, K. M., McCusker, C. D. Advancements to the axolotl model for regeneration and aging. Gerontology. 66 (3), 212-222 (2020).
- Song, F., Li, B., Stocum, D. L. Amphibians as research models for regenerative medicine. Organogenesis. 6 (3), 141-150 (2010).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: Cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxf). 2 (2), 54-71 (2015).
- Einhorn, T. A., Gerstenfeld, L. C. Fracture healing: Mechanisms and interventions). Nat Rev Rheumatol. 11 (1), 45-54 (2015).
- Polikarpova, A., et al. The specialist in regeneration-the Axolotl-a suitable model to study bone healing. NPJ Regen Med. 7 (1), 35 (2022).
- Chen, X., et al. The axolotl fibula as a model for the induction of regeneration across large segment defects in long bones of the extremities. PLoS One. 10 (6), e0130819 (2015).
- Cosden-Decker, R. S., Bickett, M. M., Lattermann, C., MacLeod, J. N. Structural and functional analysis of intra-articular interzone tissue in axolotl salamanders. Osteoarthritis Cartilage. 20 (11), 1347-1356 (2012).
- Williams, J. N., Li, Y., Valiya Kambrath, A., Sankar, U. The generation of closed femoral fractures in mice: A model to study bone healing. J Vis Exp. (138), e58122 (2018).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21 (4), 685-690 (2003).
- Jiang, S., Knapstein, P., Donat, A., Tsitsilonis, S., Keller, J. An optimized protocol for a standardized, femoral osteotomy model to study fracture healing in mice. STAR Protoc. 2 (3), 100798 (2021).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40, S103-S109 (2009).
- Manassero, M., et al. Establishment of a segmental femoral critical-size defect model in mice stabilized by plate osteosynthesis. J Vis Exp. (116), e52940 (2016).
- Gunderson, Z. J., Campbell, Z. R., McKinley, T. O., Natoli, R. M., Kacena, M. A. A comprehensive review of mouse diaphyseal femur fracture models. Injury. 51 (7), 1439-1447 (2020).
- Riquelme-Guzman, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2022).
- Gentz, E. J., et al. Medicine and surgery of amphibians. ILAR J. 48 (3), 255-259 (2007).
- Lang, A., et al. Collagen I-based scaffolds negatively impact fracture healing in a mouse-osteotomy-model although used routinely in research and clinical application. Acta Biomater. 86, 171-184 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados