Formación de organoides de timo humano en hidrogeles de fibrina tridimensionales
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, describimos un protocolo para la formación de organoides de timo derivados de iPSC humanos cultivados en hidrogeles de fibrina 3D con el objetivo de apoyar la maduración y el mantenimiento prolongado de las células epiteliales tímicas (TEC), así como la timopoiesis in vitro.
Resumen
La generación de un repertorio de linfocitos T funcionales y autotolerantes es un proceso complejo que depende del microambiente tímico y, principalmente, de las propiedades de su matriz extracelular (MEC). Las células epiteliales tímicas (TEC) son cruciales en la timopoiesis, nutriendo y seleccionando las células T en desarrollo mediante el filtrado de clones autorreactivos. Se ha demostrado empíricamente que los TEC son particularmente sensibles a las pistas físicas y químicas suministradas por el ECM y el cultivo celular monocapa clásico conduce a una rápida pérdida de funcionalidad hasta su muerte. Debido a este delicado mantenimiento combinado con una relativa rareza, y a pesar de lo mucho que está en juego en el modelado de la biología del timo in vitro, todavía faltan modelos capaces de imitar fielmente el nicho de TEC a escala y a lo largo del tiempo. Aquí, describimos la formación de un modelo de organoide tímico humano multicelular, en el que el compartimento TEC se deriva de células madre pluripotentes inducidas humanas (iPSC) y se vuelve a agregar con progenitores primarios de timocitos tempranos en un hidrogel tridimensional (3D) basado en fibrina. Este modelo responde a las necesidades actuales de un sistema de cultivo escalable que reproduzca el microambiente tímico ex vivo y demuestre funcionalidad, es decir, la capacidad de producir células T y apoyar el crecimiento de organoides del timo durante varias semanas. Por lo tanto, proponemos un modelo práctico in vitro de la funcionalidad del timo a través de organoides derivados de iPSC que beneficiaría la investigación sobre la biología de TEC y la generación de células T ex vivo.
Introducción
El timo es un órgano linfoide primario que desempeña un papel esencial en la generación de un sistema inmunitario competente y tolerante 1,2,3. Los progenitores tímicos tempranos (ETP) migran de la médula ósea al timo, donde se expanden y se diferencian en células T funcionales 1,2,4,5. Esos procesos están mediados por una población especializada, las células epiteliales tímicas (TEC)2,6,7. Las TEC derivan de progenitores epiteliales tímicos (TET)8,9 y comprenden TEC corticales (cTEC) y METulares (mTEC) que desempeñan funciones específicas en la creación del microambiente 3D especializado necesario para la migración, expansión y maduración de las células T. Los TECs median el desarrollo de linfocitos T principalmente proporcionando factores de crecimiento y diferenciación 1,10,11 y seleccionando negativamente timocitos no funcionales y no tolerantes a través de la presentación de autoantígenos 5,7,12. Las complejas interacciones entre las células T en desarrollo y las TEC también juegan un papel central en la maduración y la organización 3D de las poblaciones TEC en un proceso conocido como diafonía tímica 1,11. Las interacciones entre las poblaciones celulares del timo dependen en gran medida del microambiente específico formado por la matriz extracelular (MEC). La MEC tímica se encuentra en un estado de reciprocidad dinámica con las poblaciones de células tímicas, lo que afecta a la regulación génica y se remodela constantemente a su vez por la secreción de enzimas o proteínas de la matriz13. La MEC influye en las células a través de la modificación de la biodisponibilidad de los factores de crecimiento y las citocinas, la señalización directa a través de receptores unidos a la membrana, como las integrinas, y la conformación de los citoesqueletos a través de fuerzas físicas14. Se ha demostrado que los componentes tímicos de la MEC, como los colágenos y la laminina, tienen una alta afinidad por los factores de crecimiento TGFb y FGF, que son cruciales para el mantenimiento de la TEC y para fijarlos mediante la formación de complejos. La plasticidad, el módulo elástico y la densidad de la ECM tímica también desempeñan un papel crucial en la instrucción del destino de la TEC y en la configuración de la compartimentación del timo, que es esencial para su funcionalidad. Estas pistas ponen de manifiesto la importancia de tener en cuenta la MEC y su estructura 3D para imitar el timo ex vivo. Este punto está respaldado por el hecho de que los TEC primarios se desdiferencian rápidamente, pierden su funcionalidad y finalmente mueren cuando se cultivan en configuraciones clásicas de cultivo celular 15,16,17.
Se han desarrollado modelos de cultivo para ampliar las poblaciones funcionales de TEC a partir de explantes tímicos humanos con el fin de conservar la estructura de la MEC y las pistas cruciales que proporciona a las TEC 18,19,20. Este sistema de cultivo fue capaz de expandirse y mantener con éxito una población de TECs funcionales in vitro, pero no pudo sostenerse más allá de 7 a 8 días de cultivo18. Por lo tanto, el desarrollo de un sistema de cultivo 3D accesible y práctico capaz de reproducir el microambiente tímico y su funcionalidad in vitro y a largo plazo es una apuesta crucial en el campo. Recientemente, el desarrollo de sistemas de cultivo 3D basados en hidrogel ha llevado a la aparición de varios sistemas de organoides tímicos artificiales, constituyendo un gran avance para el modelado tímico in vitro 15,16,21,22. Desarrollamos un sistema de cocultivo de organoides tímicos humanos (hTO) a través de la reagregación de ETPs primarios humanos con TEPs humanos derivados de células madre pluripotentes inducidas (iPSC) en esferoides y su siembra sobre un hidrogel de fibrina.
La elección del material y la configuración del hidrogel en este estudio tuvo como objetivo reproducir la estructura nativa de la MEC tímica, manteniendo al mismo tiempo la practicidad y la capacidad de escalar el proceso para obtener una fuente de material asequible y abundante para los experimentos15. Este sistema hTO muestra potencial de diferenciación multilinaje y puede soportar una timopoiesis productiva a partir de ETPs23. Este sistema de organoides constituye una herramienta fiable para el estudio de las interacciones celulares intratímicas y el modelado de la linfopoiesis humana normal y patológica. El uso de células iPS también introduce capacidades de edición de genes en el modelo. La diferenciación efectiva de iPSC en tejido tímico funcional ha sido un objetivo de larga data del campo durante los últimos 15 años, y se han logrado avances significativos en el desciframiento de la señalización del destino del linaje TEC 21,24,25,26,27. Para responder a la necesidad de un modelo tímico 3D in vitro de este tipo, esta nota técnica describe los métodos y detalles técnicos para la generación paso a paso de organoides de timo humano derivados de iPSC, centrándose en la formación de andamios de hidrogel, la reagregación y siembra de micromasas celulares, y el cultivo y la cosecha de organoides.
Protocolo
La línea hiPSC hiN.Fm.m.Lon71.019 se generó a partir de fibroblastos adultos masculinos y se reprogramó mediante transfección de ARNm. La línea hiPSC hiN.Fm.f.Lon80.002 se generó a partir de fibroblastos adultos femeninos y se reprogramó mediante transfección de ARNm. La línea hiPSC hiN.Fs.f.MIPS203.003 se generó a partir de fibroblastos adultos femeninos y se reprogramó a través de una infección recombinante por vector viral Sendai. Todas las líneas celulares fueron suministradas por la plataforma Nantes iPSC. Los pacientes dieron su consentimiento informado para que sus células fueran utilizadas con fines de investigación (colección anonimizada, Lonza, cat # CC-2511). Las ETPs primarias se aíslan por disociación de muestras tímicas humanas postnatales obtenidas como residuos desechados anonimizados de pacientes sometidos a cirugía cardíaca pediátrica en el Hospital de Nantes (CHU Nantes) el mismo día, de acuerdo con la normativa francesa CODECOH bajo la declaración DC-2017-2987.
1. Diferenciación dirigida de las iPSC hacia una identidad TEP
NOTA: Desde los primeros trabajos publicados por Lai y Jin que demostraban la diferenciación de células madre embrionarias murinas (EScs) hacia una identidad epitelial tímica28, varios estudios han desarrollado y optimizado protocolos que describen la diferenciación dirigida de células iPS humanas a una identidad TEP 21,24,25,26,27,29 . Estos estudios conducen a la diferenciación de TEPs que expresan marcadores de identidad epitelial tímicos como FOXN1 y PAX9 24,25,28,30, así como marcadores de funcionalidad como DLL4 y AIRE26, pero que carecen de marcadores de maduración TEC24,25. Se ha demostrado que dos enfoques apoyan la maduración de los TEPs diferenciados a una identidad TEC madura: el trasplante a un modelo in vivo como los ratones29, y la reagregación a sistemas de organoides tímicos 3D cultivados en una configuración de interfaz aire-líquido21. Ambos sistemas han demostrado el papel crucial que desempeña la estructura 3D en el mantenimiento y apoyo a la maduración de poblaciones TEC funcionales capaces de soportar linfopoyesis T in vivo o in vitro 15,24,25,31.
- Para el sistema de organoides tímicos utilizado en este estudio, se llevó a cabo la diferenciación de las células iPS hacia una identidad TEP siguiendo un protocolo desarrollado y detallado en Provin et al.23.
2. Aislamiento de ETPs primarios a partir de una muestra tímica pediátrica
NOTA: Las ETPs son progenitores originarios de la médula ósea que dan lugar al linaje de células T y a las células dendríticas dentro del timo y que presentan el siguiente fenotipo: CD3- CD4- CD8- CD14- CD19- CD56- CD45+ CD34+ CD7+32,33.
- Preparación de las perlas de agotamiento
- El día anterior, transfiera las perlas de aislamiento de celdas magnéticas (Tabla de materiales) a un tubo de 15 mL y lávese con 4 mL de tampón de aislamiento (PBS + 0.1% BSA + 2 mM EDTA).
- Coloque el tubo en el soporte magnético, retire el sobrenadante y agregue 2 ml de tampón de aislamiento.
- Añada a las perlas anticuerpos CD3, CD4 y CD8 antihumanos de ratón e incube durante 45 min a 4 °C bajo agitación. Coloque el tubo en el soporte magnético, lávelo varias veces en tampón de aislamiento y vuelva a suspenderlo en 20 ml de tampón de aislamiento.
- Disociación de la muestra de timo
- Transfiera muestras frescas de timo a una placa de Petri llena de RPMI1640 (Tabla de Materiales). Córtelo con tijeras de disección estériles y alicates en trozos de aproximadamente 1 mm3 de tamaño.
- Con una pipeta de 25 ml, enjuague el medio y los fragmentos varias veces (el medio debe volverse turbio), luego deje que los fragmentos se sedimenten y recoja la mitad del medio en un tubo de 50 ml. Agregue más medio y repita hasta que el medio permanezca claro.
- Recoja el medio en tantos tubos de 50 ml como sea necesario y gire los tubos a 200 x g durante 5 minutos.
- Retirar el sobrenadante y resuspender los gránulos en 10 mL de solución de lisis de glóbulos rojos (Tabla de Materiales). Incubar a temperatura ambiente (RT) durante 5 min y añadir 20 mL de tampón de lavado (PBS + 0,5% BSA + 4 mM EDTA + 1% penicilina/estreptomicina).
- Girar a 200 x g durante 5 min y retirar el sobrenadante. Vuelva a suspender los gránulos en 10 ml de tampón de lavado, cuele a través de un filtro de malla de 70 μm y cuente las células.
- Enriquecimiento de ETP
- Después de contar las células, ajuste el volumen a 10 ml por tubo con el tampón de lavado. Añadir la cantidad necesaria de perlas de aislamiento celular (por cada 200 millones de células, utilizar 500 μL de perlas en 20 mL de tampón de aislamiento) e incubar a 4 °C bajo agitación durante 30 min.
- Coloque el tubo en el soporte magnético durante 2 minutos y recoja cuidadosamente el sobrenadante en un tubo limpio. Retire el tubo y limpie las perlas con 20 mL de tampón de aislamiento. Agite el tubo, vuelva a colocarlo en el soporte magnético y recoja el sobrenadante. Repita este paso dos veces.
- Centrifugar los sobrenadantes a 200 x g durante 5 min. Vuelva a suspender los gránulos en 2 mL de tampón de aislamiento y cuente las células.
- Aislamiento ETP
- Ajuste la concentración a 200 millones de células por ml y recoja un pequeño volumen como control sin teñir.
- Etiquete las células con anticuerpos anti-humano Lineage (Lin) (CD3, CD4, CD8, CD14, CD19, CD56), CD7 y CD34 (use el mismo fluorocromo para todos los marcadores Lin). Incubar a 4 °C durante 45 min.
- Lave las celdas en un volumen igual de tampón de lavado. Gire las células a 200 x g durante 5 minutos, vuelva a suspender el pellet en 1 ml y cuente las células.
- Ajuste el volumen a una concentración de 50 millones de células por ml y cuele las células a través de un filtro de malla de 70 μm.
- Añada el marcador de viabilidad de su elección y clasifique las células vivas Lin-CD34+ CD7+ mediante citometría de flujo utilizando una boquilla de 70 μm.
3. 3D cultivo de organoides tímicos
- Preparación del TEP
- Inmediatamente después del aislamiento de ETP, controlar la calidad del cultivo de TEP a los días 13-15. Asegúrese de que las células alcancen la confluencia y formen una monocapa densa con protuberancias (Figura 1).
- Para cosechar los TEPs diferenciados, lavar las células con DPBS-/-, retirarlo, añadir 1 mL de TrypLE (Tabla de Materiales) por pocillo e incubar a 37 °C durante 5-7 min.
- Agregue 1 mL de XVIVO10 (Tabla de Materiales) por pocillo, enjuague varias veces para separar las celdas, transfiera a un tubo de 15 mL y centrifugue a 200 x g durante 5 min.
- Retire el sobrenadante, vuelva a suspender el pellet en 1 mL de XVIVO10 y cuente las células.
NOTA: Para evaluar la eficacia de la diferenciación con antelación, utilice un pozo de cultivo por separado y verifique la expresión de FOXN1 y PAX9 por RT-qPCR y el rendimiento de diferenciación por citometría de flujo (calculado como la fracción de células EPCAM+ CD205+, que debe estar por encima del 50%) (Figura 1). En esta etapa de diferenciación, casi todas las células EPCAM+ también son positivas para CD205, lo que atestigua su identidad precursora11.
- Preparación de ETP
- Inmediatamente después del aislamiento de ETP, gire el tubo de recolección a 200 x g durante 5 min. Vuelva a suspender el pellet en 1 mL de XVIVO10 y cuente las células.
- Agregación de organoides tímicos
- Pipetear los volúmenes adecuados y agrupar ambas suspensiones celulares a una concentración de 2,00,000 TEP y 40,000 ETP por mL, pipetear suavemente hacia arriba y hacia abajo una vez para homogeneizar.
- Añadir los suplementos adecuados según la Tabla 1 y colocar 100 μL de la suspensión de células mixtas por pocillo en placas de 96 pocillos de fondo U de baja fijación. Utilice una pipeta multicanal para aumentar el rendimiento; Sin embargo, una pipeta clásica de una sola punta limita la pérdida de volúmenes de células preciosas. Incubar las placas a 37 °C y 5% de CO2 durante la noche.
- Preparación de los hidrogeles
NOTA: La configuración experimental utilizada para la formación de hidrogel, la siembra de organoides y la distribución del medio de cultivo se muestra en la Figura 2.- Al día siguiente (día 1 de la fase de cultivo de organoides), descongelar las alícuotas de trombina (10 U/mL), aprotinina (26.000 U/mL) y fibrinógeno (8 mg/mL) (Tabla de materiales). Descongele la trombina y la aprotinina en hielo y el fibrinógeno en un baño de agua a 37 °C (no lo ponga en hielo, ya que precipitará). No haga vórtice, sino que coloque las alícuotas debajo del capó y homogeneícelas mediante un pipeteo suave.
- Prepare tantos insertos colgantes como sea necesario para el número de organoides producidos siguiendo las proporciones presentadas en la Tabla 2. Coloque los insertos en los pocillos de cultivo con alicates estériles y deje al menos una columna o fila vacía en la placa de cultivo.
- Prepare tantos tubos de 1,5 mL como geles para ser moldeados. En cada tubo, pipetee primero los volúmenes requeridos de fibrinógeno y aprotinina como se detalla en la Tabla 2.
- En una segunda vez, agregue el volumen de trombina requerido en un solo tubo, enjuague rápidamente 2 veces sin crear burbujas para homogeneizar los reactivos, luego extraiga todo el contenido del tubo y enjuague rápidamente la mezcla en el inserto colgante. Coloque la pipeta verticalmente sobre el centro del inserto y enjuague suavemente la mezcla de reactivos sin generar burbujas.
NOTA: En este paso, la velocidad de ejecución es crucial, ya que los reactivos se polimerizarán en unos segundos, y es importante mezclarlos correctamente para evitar la formación de grumos o una densidad desigual en el gel. Proceda de uno en uno utilizando un tubo diferente de 1,5 ml para cada pocillo (si se reutiliza un tubo para varios pocillos, los grumos de gel sólido restantes pueden bloquear la punta de la pipeta). Si la polimerización se produce demasiado rápido debido a la alta actividad de la trombina, utilice una dilución 1:2. Justo después de la fundición, los geles deben ser transparentes o ligeramente translúcidos y seguir fluyendo después de unos segundos cuando la placa se inclina verticalmente. - Incubar durante al menos 1 h a 37 °C hasta que la solución transparente se solidifique y se vuelva blanca opaca, y los geles permanezcan firmemente en su lugar cuando la placa se incline verticalmente (Figura 2A).
- Siembra de organoides
- Verifique la calidad del paso de agregación. Asegúrese de que las micromasas formen masas celulares esféricas, con un núcleo compacto rodeado por un halo de menor densidad de ETPs (Figura 3).
- Cortar la punta de un cono P200 y lavarlo con una solución antiadherente (Tabla de Materiales). Para recolectar las masas celulares, incline la placa a una posición casi vertical: las micromasas se hundirán hasta la pared inferior de los pocillos y se pueden recuperar fácilmente empujando progresivamente la punta de la pipeta hacia el fondo del pocillo mientras aspira.
- Siembre la masa en la parte superior de los hidrogeles depositándolos delicadamente sin tocar el gel con la punta de la pipeta, siguiendo las proporciones presentadas en la Tabla 1 (Figura 2B). Incluso si los organoides parecen flotar libremente en esta etapa, cuando se hinchan con el medio de cultivo, el gel se ablandará y los organoides anidarán en la capa superior. Compruebe al microscopio que no quede ningún organoide en los pocillos P96.
- Prepare el volumen requerido de medio de cultivo de acuerdo con la Tabla 1 y la Tabla 2, y en cada pocillo, agregue lentamente un cuarto del volumen en la parte superior de los hidrogeles sin tocarlos pipeteando a lo largo de las paredes del inserto y los tres cuartos restantes en el fondo del pocillo colocando la pipeta entre los brazos del inserto colgante (Figura 2C).
- Coloque 1 mL de PBS en los pocillos de cultivo vacíos para mantener la humedad en la placa. Incubar a 37 °C y 5% deCO2.
- Cultivo de organoides tímicos
- El día 2, compruebe si los organoides están bien sembrados: los hidrogeles deben haber permanecido en su lugar y los organoides no deben haberse sedimentado en la parte inferior del inserto.
- Prepare la cantidad requerida de medio de cultivo siguiendo la Tabla 1 y la Tabla 2. Retire el medio dirigiendo la punta del cono de aspiración entre los brazos del inserto colgante, asegurándose de no tocar el gel. Agregue el nuevo medio colocando la pipeta de la misma manera.
- Cambie el medio cada 2 días, cambiando al medio de segunda fase (Tabla 1) después de 2 a 4 días (el día 18 siguiente al inicio de la diferenciación de TEP).
NOTA: El lote de organoides se puede mantener en cultivo de esta manera hasta por 6 semanas.
- Recolección de organoides
- Prepare un tubo de 15 mL con 1 mL de TrypLE por pocillo para cosechar.
- Corta la punta de un cono P1000 y cúbrelo con una solución antiadherente. Pipetear suavemente el gel colocando la punta de la pipeta verticalmente en el centro de los insertos (tenga cuidado de no perforar la membrana) y transfiéralo al tubo TrypLE. Lave la membrana del inserto con TrypLE y transfiéralo también al tubo.
- Incubar a 37 °C durante 15 min, agitando suavemente en vórtice a intervalos de 5 min. Asegúrate de que los geles y organoides se disocien.
- Después de 15 minutos, cuele un filtro de malla de 70 μm y centrifugue a 200 x g durante 5 minutos. Vuelva a suspender el pellet en el tampón de lavado y proceda con el método analítico de elección.
Resultados Representativos
El flujo de trabajo del protocolo se resume en la Figura 4. Para este modelo de cultivo de organoides en 3D, adoptamos un hidrogel de trombina y fibrinógeno que había sido utilizado previamente por nuestro equipo para mantener los mTEC primarios de ratón durante un par de días, gracias a las señales físicas y mecánicas que proporcionaba34. Después de la polimerización, el gel debe mostrar una estructura de malla suelta, similar a una esponja (Figura 5).
Después de la fase inicial de siembra y fijación, los organoides crecieron y se desarrollaron progresivamente tanto en la superficie como dentro de las capas superiores del gel. Dependiendo de las propiedades del gel, las condiciones de siembra y el número de organoides sembrados en el gel, los organoides formaron estructuras esféricas a oblongas (Figura 6) y ocasionalmente se fusionaron para formar estructuras más grandes. Después de la primera semana de cultivo, se observaron dos subniveles particulares de la organización dentro de los organoides: en primer lugar, observamos estructuras largas, en forma de proyección en la superficie celular, formadas por células grandes que irradiaban desde los organoides y colonizaban el hidrogel en todas las direcciones (Figura 6 y Figura 7). En segundo lugar, observamos estructuras en forma de cúmulo formadas por células más pequeñas que se concentran alrededor de esas proyecciones celulares. Aunque no hemos sido capaces de aislar ambos tipos de células para confirmar la hipótesis del estudio, este fenómeno recuerda a los arreglos 3D encontrados dentro de la corteza tímica, formados por la interacción de cTECs individuales con un gran número de linfocitos T en desarrollo mucho más pequeños, conocidos como complejos de células nodrizas tímicas11 (Figura 8).
En varios momentos de la fase de cultivo de organoides, evaluamos la composición celular de los organoides tímicos mediante citometría de flujo e identificamos varios compartimentos clave: TEC (caracterizado como EPCAM+ CD45-), timocitos (EPCAM- CD45+ CD3+) (Figura 9), así como un compartimento EPCAM-CD45+ CD3- que comprende subconjuntos de hematopoyéticos tímicos no timocitos. Más detalles se pueden encontrar en Provin et al.23.
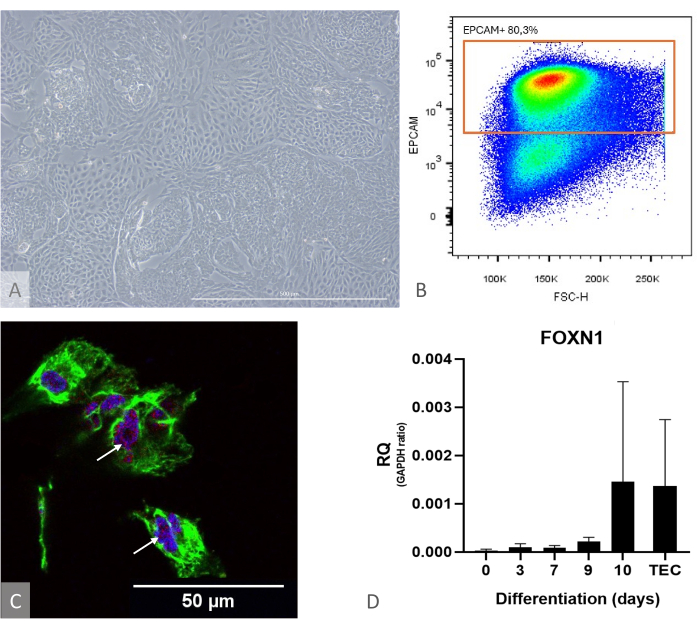
Figura 1: Caracterización de la diferenciación de iPSC a TEP. (A) Ejemplo de diferenciación de iPSC a TEP en D13, microscopio de contraste de fase invertida, 400x. Barra de escala: 500 μm. (B) Ejemplo de diagrama de puntos, la proporción de células EPCAM+ entre las células DAPI- en el día 14 de diferenciación, imagen de FlowJo 10.0.7. (C) Inmunotinción contra DAPI (azul), PAX9 (rojo) y KRT8 (verde), inmunofluorescencia e imágenes confocales en el día 16 de la diferenciación de iPSC a TEP. Las flechas blancas señalan ejemplos de tinción anti-PAX9. Barra de escala: 50 μm (D) Nivel de expresión de FOXN1 (RQ a GAPDH) durante la diferenciación de iPS a TEP. TEC: Referencia de control positivo, TEC humanos primarios aislados de muestras de timo pediátrico. Gráfico de Prism (GraphPad versión 8.0.1). Haga clic aquí para ver una versión más grande de esta figura.
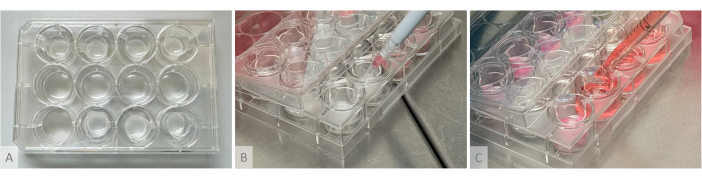
Figura 2: Configuración experimental para la formación de hidrogeles, la siembra de organoides y la distribución del medio de cultivo. (A) Placa de cultivo con hidrogeles fundidos en insertos colgantes colocados en las filas superior e inferior. (B) Siembra de organoides: el cono de pipeta cortado que contiene 1 organoide se coloca sobre el hidrogel sin tocarlo, y el organoide se siembra suavemente en la superficie del gel. (C) El medio de cultivo se deposita en el pozo de cultivo colocando la punta de la pipeta entre los brazos del inserto colgante. Haga clic aquí para ver una versión más grande de esta figura.
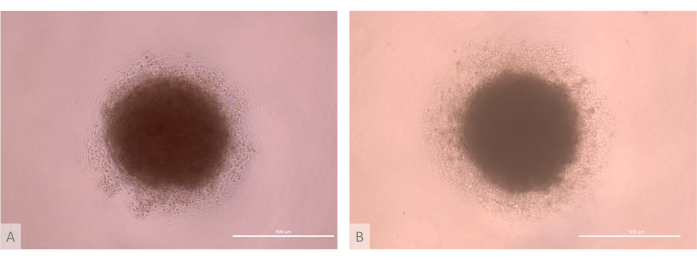
Figura 3: D0 de cultivo de organoides tímicos antes de la siembra (días 13-15 del protocolo completo). (A) organoide producido con TECs derivados de la línea Lon71.019 iPS. (B) Organoide producido con TECs derivados de la línea MIPS203.003 iPS. Microscopio de contraste de fase invertida, 1000x. Barras de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
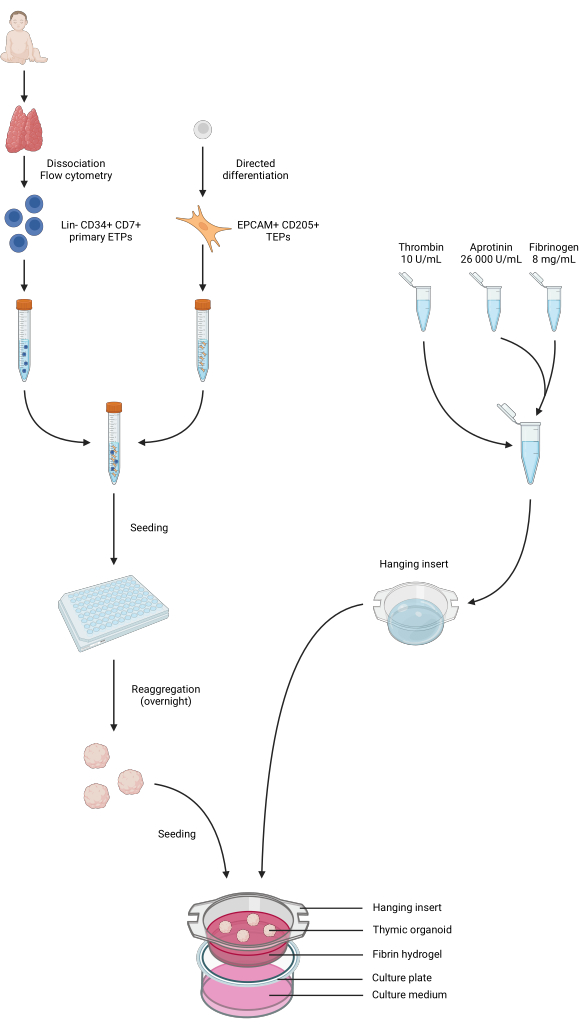
Figura 4: Representación resumida de todos los pasos del protocolo. Se recogieron y disociaron muestras de timo pediátrico, y se clasificaron las ETP primarias de Lin-CD34+ CD7+ mediante citometría de flujo. La diferenciación de las células iPS se llevó a cabo hacia una identidad TEP. Los ETPs y los TEPs derivados de iPS se agruparon y sembraron en placas de 96 pocillos de baja unión y se agregaron en organoides tímicos durante la noche. Los hidrogeles de fibrina se prepararon a partir de aprotinina, fibrinógeno y trombina y se fundieron en insertos colgantes. Después de la polimerización, los organoides se sembraron sobre los hidrogeles y se agregó el medio de cultivo de fase 1 a los pocillos. Los organoides se mantuvieron en cultivo hasta por 6 semanas. Creado en BioRender, licencia de publicación AG26EFCZOM. Haga clic aquí para ver una versión más grande de esta figura.
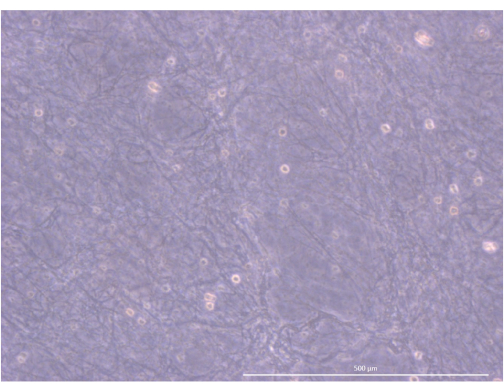
Figura 5: Organización y estructura del hidrogel. Microscopio de contraste de fase invertida, 1000x. Barra de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
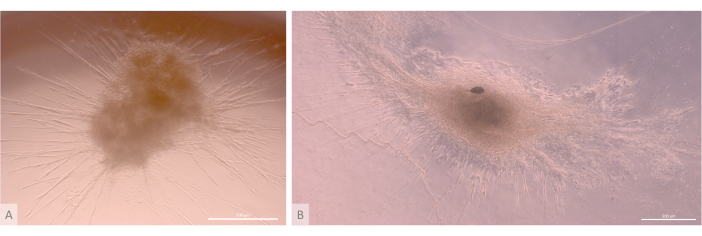
Figura 6: Organoides maduros y estructura tridimensional. (A) Organoide tímico en el día 24 de cultivo 3D, línea MIPS203.003 iPS. (B) Imagen compuesta de un organoide tímico en el día 32 de cultivo 3D, línea Lon71.019 iPS. Microscopio de contraste de fase invertida. Barras de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
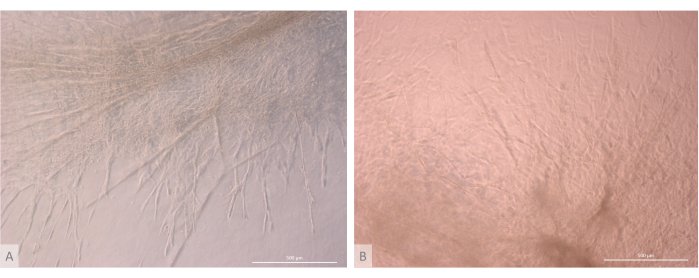
Figura 7: Detalle de la estructura de los organoides tímicos. (A) Organoide tímico en el día 32 del cultivo 3D, línea L71.019 iPS. (B) Organoide tímico en el día 27 de cultivo 3D, línea L80.002 iPS. Microscopio de contraste de fase invertida, 400x. Barras de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
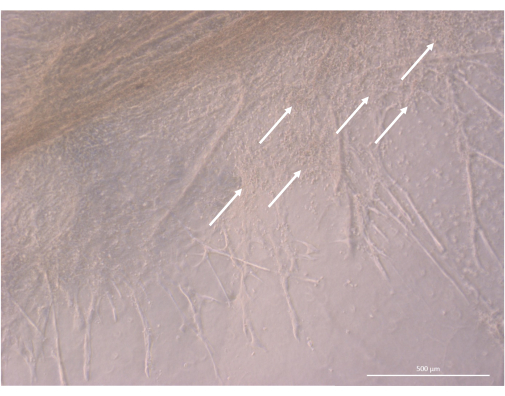
Figura 8: Detalle de la estructura de un organoide tímico en el día 32 de cultivo 3D. Las flechas blancas señalan grupos de pequeños timocitos que proliferan muy cerca de las células TEC. Microscopio de contraste de fase invertida, 400x. Barra de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
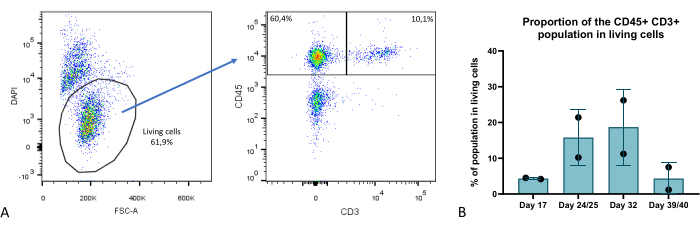
Figura 9: Proporción del compartimento de los linfocitos T dentro de los organoides tímicos. (A) Ejemplo de diagrama de puntos, proporción de células CD45+ CD3+ dentro de las células vivas (DAPI-) en organoides tímicos en el día 35 de cultivo 3D, imagen de FlowJo 10.0.7. La fracción CD45+ CD3- comprende células hematopoyéticas no timocitas. (B) La proporción de células CD45+ CD3+ dentro de las células vivas en organoides tímicos en los días 17, 24/25, 32 y 39/40 de cultivo 3D, n = 2 en duplicado o triplicado técnico, gráfico de Prism (GraphPad versión 8.0.1). Haga clic aquí para ver una versión más grande de esta figura.
| Unidad | Fase 1: medio: Día 14 hasta el Día 18 | Fase 2 medio Día 19 en adelante | |
| Base | XVIVO10 | XVIVO10 | |
| BMP4 | ng/mL | 50 | |
| FGF8 | ng/mL | 10 | |
| FGF10 | ng/mL | 10 | |
| IGF1 | ng/mL | 10 | |
| FEAG | ng/mL | 10 | |
| RANGO L | ng/mL | 50 | 50 |
| IL7 | ng/mL | 5 | 5 |
| FLT3 L | ng/mL | 5 | 5 |
| SCF | ng/mL | 10 | 10 |
| Glutamax | ng/mL | 1% | 1% |
Tabla 1: Suplementos y sus respectivas concentraciones.
| Aprotinina (μL) | Trombina (μL) | Fibrinógeno (μL) | Fase 1 medio | Organoides (unidad) | |
| Placa de 24 pocillos | 5 | 75 | 75 | 1 | De 3 a 5 |
| Placa de 12 pocillos | 9.2 | 138.2 | 138.2 | 1.8 | 5 |
| Placa de 6 pocillos | 16 | 240.8 | 240.8 | 3.2 | De 8 a 9 |
Tabla 2: Proporciones requeridas de componentes para la preparación de hidrogeles y la siembra de organoides en placas de 6, 12 y 24 pocillos.
Discusión
En comparación con el cultivo monocapa clásico en 2D o incluso con modelos 3D de última generación más avanzados, como el RTOC (cultivo de órganos de timo reagregado), el modelo que describimos aquí presenta mejoras significativas. Desde un punto de vista técnico, este modelo ofrece una escalabilidad y reproducibilidad mejoradas, ya que los TEC se derivan de células iPS que se renuevan automáticamente. También permite la edición de genes en la etapa de iPSC para facilitar los estudios de knock in o knock out en TEC. La capacidad de supervivencia de los organoides tímicos mostrados en este estudio es notable y proporciona una mejora significativa en comparación con los cultivos 2D o RTOC, con una generación de células T demostrada durante hasta 6 semanas (Figura 9). Por lo tanto, la reconstitución de la estructura tímica 3D y las propiedades de la MEC conducen a una funcionalidad tímica sostenida en nuestros organoides tímicos, es decir, la capacidad de generar células T a partir del compartimento de timocitos más maduro, emigrantes tímicos recientes alrededor de la semana 4 de cultivo 3D, con generación de células T CD4+ y CD8+23.
Debido a que el microambiente tímico apoya una intensa actividad de expansión y diferenciación, el intercambio gaseoso adecuado es un parámetro crucial en cualquier modelo de timo in vitro. De hecho, se han observado mejores resultados en modelos mantenidos en una atmósfera de dioxígeno enriquecida o en interfaces aire-líquido21,35. Nuestras observaciones apoyan este punto y resaltan la importancia de una correcta siembra de organoides en la parte superior del hidrogel, justo debajo de la interfaz aérea. Los defectos en la polimerización que conducen a hidrogeles viscosos a líquidos causarán el hundimiento de organoides en la parte inferior de los insertos y obstaculizarán su crecimiento. El cocultivo con células endoteliales on-chip es una alternativa prometedora que podría romper esta barrera añadiendo vascularización. El tamaño de los organoides del timo producidos en este estudio se limita a alrededor de 5 mm, supuestamente debido a la falta de intercambios de gases y nutrientes en las áreas centrales. Por lo tanto, la vascularización permitiría el escalado del cultivo y, combinada con la optimización del proceso, permitiría la producción de organoides que contienen millones de TEC y células T. La densidad del hidrogel también es un parámetro crucial, y su reproducibilidad en lotes es una de las principales limitaciones del protocolo, dada la sensibilidad de las enzimas a los ciclos de congelación y descongelación. El paso de fundición de hidrogel es un paso crítico en el protocolo; Recomendamos realizar una prueba lanzando un hidrogel 1 h antes de cualquier experimento planificado para comprobar la actividad de los reactivos. En caso de que la actividad enzimática sea insuficiente y se produzca un deterioro de la polimerización y dado el coste de los TEP derivados de iPSC, no aconsejamos solucionar ningún otro problema que volver a iniciar el protocolo con alícuotas de reactivos frescos. Los TEC son importantes productores de ECM; Sin embargo, dados los recientes avances en la comprensión del papel de los fibroblastos tímicos, podría ser interesante añadir una población de fibroblastos irradiados al modelo de organoide. Esta población podría segregar factores de crecimiento y MEC que participarían en la reproducción del ambiente tímico con efectos positivos en la diferenciación y mantenimiento de TEC y células T. Otra limitación importante de este modelo de organoide timo es la falta de una segregación corticomedular adecuada. Debido a que se ha demostrado que los fibroblastos capsulares del timo dan forma a la formación de la corteza, su adición al modelo de cultivo podría ayudar a abordar esta limitación. Así, este protocolo introduce las bases de modelos complejos in vitro del timo. Combina los avances recientes realizados en los campos de la diferenciación tímica de iPSC, los cultivos basados en hidrogel 3D y la linfopoyesis in vitro. Este modelo se puede refinar aún más para abordar la escalabilidad y aumentar su complejidad, por ejemplo, agregando compartimentos mesenquimales y vasculares. Por lo tanto, podría dar lugar a valiosas plataformas de investigación sobre inmunidad o aplicaciones en la terapia celular personalizada basada en células T.
Divulgaciones
Los autores declaran que no tienen ningún conflicto de intereses.
Agradecimientos
Queremos agradecer a los miembros de la instalación central de iPSC de Nantes, Francia, encabezada por Laurent David. Este trabajo ha sido financiado por el proyecto JTC2019 del programa JP-Rare Disease TARID (EJPRD19-208) financiado por la ANR (ANR-19-RAR40011-5) a M.G. por la subvención RFI Bioregate (ThymIPS) de la Région Pays de la Loire a M.G., por la ANR (ANR-22-CE15-0045) a M.G. y el proyecto "SATT Ouest Valorisation" OrgaTreg a M.G. N.P. fue apoyado por "la fondation d'entreprise ProGreffe". M.d.A. fue apoyado por "la Fondation pour la Recherche Médicale". Agradecemos a la instalación central de iPSC de Nantes, con el apoyo de IBiSA y Biogenouest, por el uso de sus recursos y soporte técnico. Este trabajo fue parcialmente financiado por el programa Labex IGO apoyado por la Agencia Nacional de Investigación a través de la inversión del programa futuro ANR-11-LABX-0016-01.
Materiales
| Name | Company | Catalog Number | Comments |
| Aprotinin | Sigma Aldrich | 616370 | |
| BMP4 | Miltenyi | 130-111-165 | |
| CCR7 (CD197) | BD Biosciences | PE | Clone: 3D12; Dilution: 1: 200 |
| CD14 | BD Biosciences | FITC | Clone: M5E2; Dilution: 1: 200 |
| CD19 | BD Biosciences | PE | Clone: HIB19; Dilution: 1: 200 |
| CD205 | BioLegend | FITC | Clone: MG38; Dilution: 1: 200 |
| CD3 | BD Biosciences | PE | Clone: HIT3a; Dilution: 1: 200 |
| CD34 | BD Biosciences | FITC | Clone: 8G12; Dilution: 1: 100 |
| CD4 | BD Biosciences | PE | Clone: RPA-T4; Dilution: 1: 100 |
| CD4 | BD Biosciences | BV711 | Clone: L200; Dilution: 1: 200 |
| CD45 | BD Biosciences | PerCP | Clone: HI30; Dilution: 1: 200 |
| CD56 | BD Biosciences | PE | Clone: B159; Dilution: 1: 200 |
| CD62L | BD Biosciences | BV605 | Clone: DREG-56; Dilution: 1: 200 |
| CD69 | BD Biosciences | BV510 | Clone: FN50; Dilution: 1: 200 |
| CD7 | BD Biosciences | APC | Clone: M-T701; Dilution: 1: 200 |
| CD8 | BD Biosciences | PeCy7 | Clone: RPA-T8; Dilution: 1: 200 |
| CD8 | BD Biosciences | PE | Clone: HIT8a; Dilution: 1: 200 |
| Dynabeads Pan Mouse IgG | Invitrogen | 11041 | |
| EGF | Miltenyi | 130-097-751 | |
| EPCAM (CD326) | BD Biosciences | PE | Clone: HEA-125; Dilution: 1: 200 |
| EPCAM (CD326) | Miltenyi | BV711 | Clone: EBA-1; Dilution: 1: 200 |
| FGF10 | Miltenyi | 130-127-858 | |
| FGF8 | Biotechne R&D | 423-F8 | |
| Fibrinogen | Sigma Aldrich | 341578 | |
| FLT3 L | Peprotech | AF-300-19 | |
| Glutamax | Gibco | 35050-61 | |
| IGF1 | Miltenyi | 130-093-886 | |
| IL7 | Peprotech | AF-200-07 | |
| RANK L | Biotechne R&D | 6449-TEC | |
| Red blood cell lysis solution | Miltenyi | 130-094-183 | |
| RPMI1640 | Gibco | 11875093 | |
| SCF | Peprotech | AF-300-07 | |
| Thrombin | Sigma Aldrich | 605190 | |
| TrypLE | Gibco | 2605010 | |
| XVIVO10 | Lonza | LONBE04-380Q |
Referencias
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu Rev Immunol. 21, 139-176 (2003).
- Carpenter, A. C., Bosselut, R. Decision checkpoints in the thymus. Nat Immunol. 11 (8), 666-673 (2010).
- Miller, J. F. A. P. The function of the thymus and its impact on modern medicine. Science. 369 (6503), (2020).
- Haddad, R., et al. Dynamics of thymus-colonizing cells during human development. Immunity. 24 (2), 217-230 (2006).
- Cumano, A., et al. New molecular insights into immune cell development. Annu Rev Immunol. 37, 497-519 (2019).
- Bautista, J. L., et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla. Nat Commun. 12 (1), 1096 (2021).
- Kadouri, N., Nevo, S., Goldfarb, Y., Abramson, J. Thymic epithelial cell heterogeneity: TEC by TEC. Nat Rev Immunol. 20 (4), 239-253 (2020).
- Alves, N. L., et al. Serial progression of cortical and medullary thymic epithelial microenvironments. Eur J Immunol. 44 (1), 16-22 (2014).
- Baik, S., Jenkinson, E. J., Lane, P. J. L., Anderson, G., Jenkinson, W. E. Generation of both cortical and Aire+ medullary thymic epithelial compartments from CD205+ progenitors. Eur J Immunol. 43 (3), 589-594 (2013).
- Tavian, M., Peault, B. Embryonic development of the human hematopoietic system. Int J Dev Biol. 49 (2-3), 243-250 (2005).
- Abramson, J., Anderson, G. Thymic epithelial cells. Annu Rev Immunol. 35 (1), 85-118 (2017).
- Anderson, M. S., et al. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298 (5597), 1395-1401 (2002).
- Sharma, H., Moroni, L. Recent advancements in regenerative approaches for thymus rejuvenation. Adv Sci. 8 (14), 2100543 (2021).
- Alenghat, F. J., Ingber, D. E. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE. 2002 (119), 6 (2002).
- Pinto, S., Schmidt, K., Egle, S., Stark, H. -. J., Boukamp, P., Kyewski, B. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190 (3), 1085-1093 (2013).
- Hun, M., Barsanti, M., Wong, K., Ramshaw, J., Werkmeister, J., Chidgey, A. P. Native thymic extracellular matrix improves in vivo thymic organoid T cell output, and drives in vitro thymic epithelial cell differentiation. Biomaterials. 118, 1-15 (2017).
- Asnaghi, M. A., et al. Thymus extracellular matrix-derived scaffolds support graft-resident thymopoiesis and long-term in vitro culture of adult thymic epithelial cells. Adv Funct Mater. 31 (20), 2010747 (2021).
- Villegas, J. A., et al. Cultured human thymic-derived cells display medullary thymic epithelial cell phenotype and functionality. Front Immunol. 9, 1663 (2018).
- Hauri-Hohl, M., Zuklys, S., Holländer, G. A., Ziegler, S. F. A regulatory role for TGF-β signaling in the establishment and function of the thymic medulla. Nat Immunol. 15 (6), 554-561 (2014).
- Campinoti, S., et al. Reconstitution of a functional human thymus by postnatal stromal progenitor cells and natural whole-organ scaffolds. Nat Commun. 11 (1), 6372 (2020).
- Ramos, S. A., et al. Generation of functional thymic organoids from human pluripotent stem cells. Stem Cell Reports. 18 (4), 829-840 (2023).
- Fan, Y., et al. Bioengineering thymus organoids to restore thymic function and induce donor-specific immune tolerance to allografts. Mol Ther. 23 (7), 1262-1277 (2015).
- Provin, N., et al. Combinatory differentiation of human induced pluripotent stem cells generates thymic epithelium that supports thymic crosstalk and directs dendritic- and CD4/CD8 T-cell full development. bioRxiv. 2023, 572664 (2023).
- Parent, A. V., et al. Generation of functional thymic epithelium from human embryonic stem cells that supports host T cell development. Cell Stem Cell. 13 (2), 219-229 (2013).
- Sun, X., et al. Directed differentiation of human embryonic stem cells into thymic epithelial progenitor-like cells reconstitutes the thymic microenvironment in vivo. Cell Stem Cell. 13 (2), 230-236 (2013).
- Inami, Y., et al. Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol. 89 (2), 314-321 (2011).
- Gras-Pena, R., et al. Human stem cell-derived thymic epithelial cells enhance human T cell development in a xenogeneic thymus. J Allergy Clin Immunol. 149 (5), 1755-1771 (2022).
- Lai, L., Jin, J. Generation of thymic epithelial cell progenitors by mouse embryonic stem cells. Stem Cells. 27 (12), 3012-3020 (2009).
- Ramos, S. A., et al. Generation of functional human thymic cells from induced pluripotent stem cells. J Allergy Clin Immunol. 149 (2), 767-781 (2022).
- Provin, N., Giraud, M. Differentiation of pluripotent stem cells into thymic epithelial cells and generation of thymic organoids: Applications for therapeutic strategies against APECED. Front Immunol. 13, 930963 (2022).
- Montel-Hagen, A., et al. In vitro recapitulation of murine thymopoiesis from single hematopoietic stem cells. Cell Rep. 33 (4), 108320 (2020).
- Park, J. -. E., et al. A cell atlas of human thymic development defines T cell repertoire formation. Science. 367 (6480), 3224 (2020).
- Flippe, L., et al. Rapid and reproducible differentiation of hematopoietic and T cell progenitors from pluripotent stem cells. Front Cell Dev Biol. 8, 577464 (2020).
- Padonou, F., et al. Aire-dependent transcripts escape Raver2-induced splice-event inclusion in the thymic epithelium. EMBO Rep. 23 (3), e53576 (2022).
- Han, J., Zúñiga-Pflücker, J. C. High-oxygen submersion fetal thymus organ cultures enable FOXN1-dependent and -independent support of T lymphopoiesis. Front Immunol. 12, 652665 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados