Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis de perlas sensibles al pH, cargadas de aceite de semilla negra, a base de alginato mediante la técnica de electropulverización
En este artículo
Resumen
Se presenta una técnica que emplea alto voltaje eléctrico y una emulsión dirigida y cargada de ingrediente activo para fabricar microperlas uniformes y sensibles al pH.
Resumen
El aceite de semilla negra (BSO), derivado de las semillas de la planta Nigella sativa , ha llamado la atención por sus posibles propiedades anticancerígenas, particularmente en el contexto del cáncer de colon. Su compuesto activo, la timoquinona, puede ayudar a inhibir el crecimiento de las células cancerosas e inducir la apoptosis en las células de cáncer de colon. Además, los efectos antiinflamatorios y antioxidantes del aceite de semilla negra podrían contribuir a un entorno intestinal más saludable, lo que podría reducir el riesgo de cáncer. Por lo tanto, este estudio sintetizó perlas de alginato sensibles al pH para administrar BSO en el colon de una manera de liberación controlada sin liberar el fármaco a pH 1.2 (estómago), proporcionando así un patrón de liberación bien definido a pH 6.8. El uso de la tecnología de electropulverización mejora el rendimiento del proceso al facilitar la formulación de perlas pequeñas y homogéneas con una mayor tasa de hinchazón y difusión en el medio gastrointestinal.
Las perlas formuladas se caracterizaron mediante una prueba de fuerza mucoadhesiva ex-vivo , tamaño de perla, factor de esfericidad (SF), eficiencia de encapsulación (EE), microscopio electrónico de barrido (SEM), comportamiento de hinchazón in vitro (SB) y liberación in vitro del fármaco en medios ácidos y tampón. Todas estas cuentas fabricadas demostraron tamaños modestos de 0,58 ± 0,01 mm y una forma esférica de 0,03 ± 0,00 mm en esta prueba. La formulación mostró prometedoras propiedades de flotación y liberación in vitro. Con un porcentaje acumulado muy bajo de perlas, el EE de aceite de 90.13% ± 0.93% fue alto, y el estudio de liberación demostró más del 90% en pH 6.8 con buena naturaleza flotante en el estómago. Además, las cuentas estaban espaciadas uniformemente por todo el intestino. El enfoque de electropulverización utilizado en este protocolo puede ser reproducible, lo que produce resultados consistentes. Por lo tanto, este protocolo se puede utilizar para la producción a gran escala con fines de comercialización.
Introducción
La semilla negra, y más especialmente la BSO, se ha utilizado durante siglos para curar una amplia gama de enfermedades debido a sus propiedades medicinales bien establecidas. La timoquinona es quizás uno de los fitoquímicos más importantes que se encuentran en BSO1. En los últimos años, los investigadores han estudiado los posibles beneficios terapéuticos de la timoquinona in vivo e in vitro, produciendo evidencia empírica que respalda el uso de BSO. Estos estudios han demostrado propiedades antihipertensivas, antibacterianas, antihistamínicas, antifúngicas, analgésicas, antidiabéticas, hipolipemiantes y antiinflamatorias para el BSO, que puede usarse para tratar síntomas como eccema, presión arterial alta, asma, tos, dolor de cabeza, influenza, fiebre, anticáncer, mareos y actividad 2,3.
La aplicación de recubrimientos relativamente delgados sobre pequeñas gotas de líquidos y dispersiones, o partículas de material sólido, se conoce como microencapsulación. Cuando se trata de aceite, el aceite microencapsulado suele ser bastante valioso porque algunas formas de aceite, como el BSO, se consideran alimentos nutritivos yofrecen ventajas medicinales. Sin embargo, la adición de aceites directamente a la matriz de los alimentos puede provocar volatilización, lo que puede hacer que las actividades desaparezcan rápidamente como resultado de la exposición al oxígeno y ala luz ultravioleta. Además, la falta de control sobre la tasa de liberación de los aceites da lugar a un efecto inmediato y transitorio. La creación de un recubrimiento polimérico alrededor del aceite esencial mediante microencapsulación o microesferificación es un método para superar estos inconvenientes6.
Las microcápsulas, también conocidas como microesferas, protegen los aceites de las condiciones ambientales dañinas7. Este proceso se ha utilizado ampliamente para aumentar la eficacia de los medicamentos, preservar el contenido de los medicamentos, permitir tabletas de liberación prolongada, mejorar el enmascaramiento del sabor, reducir la pérdida de sabor durante la vida útil del producto, prolongar la sensación en boca y separar los ingredientes incompatibles en una soladosis. La microencapsulación también ayuda a mantener la absorción metabólica, controlar la tasa de liberación de aceite y mantener las concentraciones adecuadas para producir el resultado deseado enun lugar en particular.
La encapsulación electrohidrodinámica es un método sencillo y adaptable. El principio activo se encuentra en el núcleo interno de una microcápsula, que está compuesto por una cubierta exterior. En este sentido, presenta una matriz bastante fuerte para garantizar que el componente activo se pueda diseminar de manera más efectiva en lugar de un núcleo claramente definido. Antes de la esfericiclación, la sustancia activa y la solución polimérica deben combinarse para producir las microesferas9. Por otro lado, debido a que el aceite es volátil, microencapsularlo puede ser extremadamente difícil y requiere un control cuidadoso de la temperatura.
Existen varios métodos para encapsular aceites. Por ejemplo, ciertos aceites deben encapsularse a bajas temperaturas para evitar la descomposición o volatilización de sus componentes bioactivos. Para crear estructuras de tamaño micro y nanométrico, la atomización electrohidrodinámica (EHDA) ha sido ampliamente estudiada por los investigadores10. En este sentido, las condiciones de procesamiento, que incluyen el caudal, el voltaje aplicado y el tamaño de la boquilla, así como las propiedades de distancia de recolección de la solución polimérica, son los dos factores principales que deben tenerse en cuenta para producir el tamaño de partícula o morfología deseado11,12.
En esta investigación, se utilizaron alginatos, un tipo de polisacáridos naturales aptos para la ingestión oral, para encapsular el BSO. Las algas pardas contienen alginato, un polímero aniónico que se produce de forma natural. Está formado por dos estructuras monoméricas: el ácido α-L-gulurónico (G) y el ácido 1-4βD-maniurónico (M)13. Su polímero no es tóxico14, tiene un alto grado de biocompatibilidad, es barato y se degrada eficazmente15. Por lo tanto, se emplea con frecuencia en los sectores de la biotecnología y la ingeniería.
Los alginatos son el material de elección para la encapsulación por gelificación iónica porque pueden crear una estructura reticulada entre los grupos G de varias cadenas de alginato mediante la formación de conexiones iónicas con cationes divalentes como los iones Sr2+, Ca2+ o Zn2+. El proceso de gelificación se puede caracterizar adecuadamente mediante el modelo de caja de huevos, que limita el catión divalente a dos grupos carboxilo en las moléculas de alginato lado a lado. Se ha sugerido que las características del hidrogel de las perlas de alginato de sodio pueden regular la liberación de macromoléculas y moléculas pequeñas. Las perlas de alginato de sodio pueden adherirse a la mucosa intestinal durante un período prolongado de tiempo debido a sus cualidades mucoadhesivas. Además, el alginato ofrece un escudo que puede proteger a los aceites de elementos externos como los medios ácidos16 y transfiere los aceites a los canales de entrega del tracto gastrointestinal17. Desde entonces, se ha empleado en la investigación para ayudar en la administración de medicamentos específicos del sitio a los tejidos mucosos18,19.
En este estudio se utilizó el enfoque electrohidrodinámico para investigar la viabilidad de emulsionar aceites comerciales para crear cápsulas20. Aquí, se utilizó el enfoque electrohidrodinámico para generar y analizar microesferas cargadas con alginatoBSO 20. Este estudio evaluó una serie de otros factores, incluyendo las propiedades SF de las microesferas, ex-vivo, mucoadhesivas, EE%, apariencia física, distribución de tamaño y potencial zeta; Se utilizó espectroscopía infrarroja de reflectancia total atenuada por transformada de Fourier (ATR-FTIR) para probar la compatibilidad química20.
Protocolo
1. Preparación de la emulsión de alginato-BSO
- Disperse el 10% p/v de BSO en una solución de alginato de sodio al 1% p/v que contenga 1, 3 y 5% p/v de lecitina en un vaso de precipitados de 50 mL.
- Obtención de una nanoemulsión mediante el uso de un homogeneizador ultrasónico. Ajuste el nivel de potencia al 20%. Haga funcionar el homogeneizador durante 55 s haciendo clic en el botón de inicio para completar el proceso.
2. Caracterización de la emulsión de alginato-BSO
- Analice el potencial zeta y la distribución del tamaño de partícula
- Tome 0,1 mL de la emulsión recién preparada en un vaso de precipitados de vidrio de 25 mL y dilúyalo con 9,9 mL de agua destilada.
- Tome 2,5 mL de esta solución diluida en una cubeta de cuarzo de 3 mL y coloque la cubeta en una cámara de medición.
- Abra la tapa y coloque la cubeta dentro del dispositivo, asegurándose de que la cubeta esté orientada correctamente con respecto a la trayectoria del haz de luz. Haga clic en el icono de medición .
- Saca la cubeta. Recupere la muestra o deséchela adecuadamente.
- Guarde los datos como un archivo pdf en una carpeta personal para su uso posterior.
- Determinar la estabilidad de la emulsión (ES)
- Tome 5 mL de emulsión recién preparada en tubos de centrífuga de 10 mL. Centrifugar las emulsiones (n = 3) durante 5 min a 894 × g.
- Utilizando la ecuación (1), determine el ES en función de la posición de la interfaz de separación de fases.
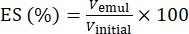 (1)
(1)
Donde Vemul es el volumen de emulsión restante después de la centrifugación y Vinitial es el volumen de la emulsión inicial.
- Preparación de cuentas
- Perlas de alginato BSO
- Prepare las perlas de alginato BSO utilizando la técnica de electrospray llamada EHDA. Emplee una emulsión de BSO de peso por volumen (p/v) que esté compuesta por una solución de 10% de BSO, 1% de alginato de sodio y 3% de lecitina).
- Usando una bomba de jeringa para regular el caudal, cargue la emulsión en una jeringa de plástico de 10 mL y empújela a través de una aguja de 22 G. Conecte la punta de la aguja al electrodo positivo de una fuente de alimentación de alto voltaje.
- Como colector, utilice un vaso de precipitados conectado a tierra con 50 ml de cloruro de calcio al 1% p/p (baño gelificante). Alternar el caudal de goteo entre 1 mL/min y 3 mL/min a voltajes de 3, 5 y 7 kV manteniendo una distancia de 10 cm sobre la superficie de la solución de cloruro de calcio.
- Para confirmar la gelificación completa, deje las perlas en el baño gelificante durante 30 minutos mientras las agita. Use un filtro de acero inoxidable para quitar las perlas del baño de gelificación y lave las perlas recogidas con agua destilada ultrapura.
- Deje que las perlas se sequen durante 16 horas a temperatura ambiente en una mesa de laboratorio. Utilice la ecuación (2) para calcular el rendimiento porcentual de las cuentas.
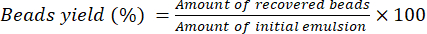 (2)
(2)
- Perlas de alginato sin BSO
- Prepare una solución al 1% p/v de alginato de sodio. Agregue lecitina a concentraciones de 1%, 3% y 5% p/v a la solución. Mezcle bien la solución hasta que la lecitina se disuelva por completo.
- Utilice la solución del paso 2.3.2.1 para preparar perlas de alginato sin BSO como se describe en los pasos 2.3.1.2-2.3.1.5. Calcule el rendimiento usando la ecuación (2).
- Perlas de alginato BSO
3. Caracterización de cordones
- Determinación del tamaño y la forma
- Para determinar el tamaño y la forma de las cuentas, utilice un analizador de imágenes. Tome fotos con una cámara digital de las cuentas húmedas y secas.
- A continuación, mida el diámetro del cordón utilizando la barra de escala preinstalada del instrumento. Usando los valores de diámetro, calcule el SF a partir de los valores de diámetro obtenidos usando la ecuación (3):
SF =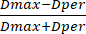 (3)
(3)
Donde Dmax representa el diámetro más grande que pasa por el centro de una cuenta (en mm), mientras que Dper se refiere al diámetro que es perpendicular a Dmax y pasa por el centro de la cuenta (en mm).
NOTA: Un SF de cero denota una cuenta idealmente esférica, y los valores de SF crecientes significan una mayor desviación de una forma esférica. Además, las cuentas se consideran esféricas si su SF es de 0,05 o menos.
4. Determinación del EE%
- Desintegre las perlas en solución salina tamponada con fosfato (PBS) para devolverlas a la emulsión. Mida la absorbancia de la emulsión resultante a 600 nm utilizando un espectrofotómetro UV-vis.
- Utilice el valor de absorbancia para representar la turbidez de la emulsión. Cree una curva estándar utilizando una cantidad conocida de BSO en la emulsión.
- Calcule el EE% usando la ecuación (4):
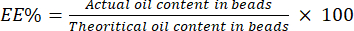 (4)
(4)
5. Microscopía electrónica de barrido (SEM)
NOTA: Utilice SEM para observar la microestructura y la morfología de la superficie de las perlas de alginato BSO.
- Para inspeccionar el interior de las cuentas secas, corte algunas de ellas. Localiza las cuentas cortadas en trozos de aluminio y pégalas con cintas adhesivas de carbono.
- Cubra las perlas con un módulo de pulverización catódica de carbono en un evaporador al vacío en una atmósfera de argón. Aplique un espesor de 100 Å y 50 Å para el recubrimiento de carbono.
- Adquiera imágenes de las perlas recubiertas a alto vacío con un acelerador de voltaje entre 10 kV y 15 kV.
6. Determinar la interacción fármaco-excipiente mediante ATR-FTIR
- Ajuste los números de onda del instrumento entre 4.000 cm-1 y 400 cm-1 utilizando aire ambiente como fondo y una resolución de 1 cm-1. Ver Archivo Complementario 1.
- Registre los espectros de BSO, alginato de sodio, lecitina, cloruro de calcio, perlas sin BSO, perlas de alginato-BSO y mezcla física de ingrediente activo y excipientes (alginato de sodio, lecitina, cloruro de calcio y BSO) por separado.
- Coloque la muestra (5-10 mg) en el área de muestreo. Ajuste 20 escaneos, resolución 4, fuerza manométrica 80, brazo de presión con punta plana. Verifique que el Incremento automático permanezca establecido en la opción En blanco para que el espectro se almacene automáticamente en la carpeta deseada.
- Para comenzar la medición de la muestra, haga clic en el botón [Muestra]. Después de seleccionar [Muestra], dado que no hay período de espera, asegúrese de tener la muestra lista y la pinza de presión reducida. Analice todas las muestras individualmente. Analice individualmente todos los espectros registrados mediante un software de espectroscopia.
7. Calorimetría diferencial de barrido (DSC)
NOTA: Las propiedades térmicas y la compatibilidad de las cuentas cargadas con BSO se investigaron utilizando DSC (Archivo Suplementario 1).
- Selle las perlas que pesan ~ 3.20 mg en una sartén de aluminio normal. Calentar las muestras a una velocidad de 10 °C/min mientras se analizan a una temperatura de 50-350 °C bajo una corriente de nitrógeno que fluye a una velocidad de 20 L/min.
8. Características de hinchamiento de las cuentas
- Prepare 100 mg de perlas de alginato seco-BSO.
- Prepare el fluido intestinal simulado (SIF) y el fluido gástrico simulado (SGF) en un recipiente de mezcla limpio y seco de un tamaño adecuado de 6 L, 10 L o 25 L. Agregue agua purificada hasta aproximadamente el 33% del volumen requerido (2 L, 3 L u 8 L) y transfiera el contenido de la botella de concentrado al recipiente. Enjuague la botella con agua purificada y agregue los enjuagues y el agua purificada al recipiente de mezcla para obtener el volumen requerido; Homogeneizar. Mida el pH y proceda si está dentro de las especificaciones; ajuste el pH si es necesario.
- Sumerja las perlas en 50 ml de medio que contenga líquido intestinal simulado (SIF) y fluido gástrico simulado (SGF). Mantener las condiciones durante 2 h a 37 ± 0,5 °C.
- Retire las cuentas infladas y fíltrelas a través de una malla metálica a intervalos predefinidos de 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 y 120 min o más. Use una toalla de papel para eliminar el exceso de líquido de las cuentas hinchadas.
- Mida el peso de las cuentas limpias utilizando una balanza analítica electrónica. Determine el porcentaje del índice de hinchamiento (%SI) utilizando la ecuación (5):
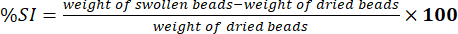 (5)
(5)
Resultados
Preparación de microesferas de alginato cargadas con BSO
La Figura 1 representa la configuración experimental para preparar microesferas de alginato cargadas con BSO. La cantidad de lecitina utilizada tuvo un impacto considerable en la estabilidad de la emulsión BSO. Las emulsiones elaboradas con las tres concentraciones de lecitina fueron comparativamente estables. En este experimento se utilizó el método de centrifugación (894
Discusión
Utilizando el proceso EHDA, se crearon microesferas de alginato cargadas con BSO como portador sensible al pH. La red de perlas exhibió una hinchazón dependiente del pH y un comportamiento de liberación de fármacos debido a la abundante presencia de grupos de ácido carboxílico. Se reveló que el fuerte enlace de hidrógeno intermolecular entre las cadenas poliméricas era la razón detrás de la disminución del carácter de hinchazón de las perlas cargadas con BSO a pH 1.2. Las p...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este estudio fue apoyado por el Proyecto de Apoyo a los Investigadores de la Universidad Princesa Nourah bint Abdulrahman (PNURSP2024R30), Universidad Princesa Nourah bint Abdulrahman, Riad, Arabia Saudita. Esta investigación fue financiada por el Proyecto de Apoyo a Investigadores número (RSPD2024R811) de la Universidad Rey Saud, Riad, Arabia Saudita.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
Referencias
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados