Method Article
Inyección intratecal lumbar de vectores de terapia génica para el sistema nervioso central dirigida en ratones y ratas
* Estos autores han contribuido por igual
En este artículo
Resumen
Una inyección intratecal lumbar representa una vía de administración traslacionalmente relevante para administrar terapia génica al sistema nervioso central. Este protocolo estandarizado integral para inyecciones intratecales lumbares en ratones y ratas neonatales, juveniles y adultos tiene como objetivo guiar a los investigadores en la adopción de esta técnica para estudios preclínicos de terapia génica.
Resumen
Un método para dirigirse al sistema nervioso central para tratar enfermedades neurológicas implica la utilización de la vía de administración intratecal lumbar. Este enfoque evita la barrera hematoencefálica para acceder directamente al líquido cefalorraquídeo y dirigirse preferentemente a las células del sistema nervioso central. Múltiples estudios preclínicos publicados que emplean la vía de inyección intratecal lumbar han contribuido al desarrollo de ensayos clínicos de terapia génica; Sin embargo, los protocolos descritos son variables y están dispersos en varios recursos. Aquí, se presenta un conjunto completo de protocolos para inyecciones intratecales lumbares en ratones y ratas neonatales, juveniles y adultos para estudios preclínicos de terapia génica. Con la formación adecuada, esta técnica de inyección puede realizarse de forma rápida y fiable. Además de detallar el protocolo de inyección en cada etapa del desarrollo, se discuten los parámetros asociados, como el volumen de inyección, que pueden influir en los resultados del estudio. Para demostrar la aplicación de inyecciones intratecales lumbares dirigidas al sistema nervioso central, se presenta la expresión del virus adenoasociado serotipo 9 en el cerebro, la médula espinal y los tejidos periféricos después de una inyección exitosa o fallida.
Introducción
Un desafío en el tratamiento de enfermedades neurológicas que requieren una administración global del sistema nervioso central (SNC), pero que por lo demás son buenos candidatos para la terapia génica, se ha atribuido en gran medida a la ineficiencia de la focalización del SNC y los tipos de células relevantes1. Se está llevando a cabo una cantidad sustancial de investigación para optimizar la focalización global de células y tejidos del SNC mediante la ingeniería de vehículos de administración 1,2. Sin embargo, aún se puede lograr una administración de vectores razonablemente generalizada con la tecnología actual de vectores de terapia génica, utilizando ciertas combinaciones de vectores virales y vías de administración 3,4. El estándar de oro actual para obtener una administración generalizada del SNC a partir de un tratamiento único es el uso del virus adenoasociado serotipo 9 (AAV9) junto con una inyección directa en el líquido cefalorraquídeo (LCR).
Existen tres vías típicas de administración para las inyecciones directas de LCR: intratecal lumbar (IT), intracerebroventricular (ICV) e intracisternal (ICM)5. Cada una de estas vías de administración da lugar a diferentes patrones de biodistribución en el SNC y en los tejidos periféricos, pero todas tienen la ventaja de eludir la barrera hematoencefálica (BHE) para llegar a las células del SNC que contribuyen a la patología y los fenotipos de las enfermedades neurológicas6. La inyección lumbar IT es el estándar para el uso clínico de la administración de fármacos en humanos, ya que el procedimiento clínico es rutinario y sencillo, con menos invasividad en comparación con las inyecciones de ICV e ICM.
La inyección lumbar es una técnica establecida que se utiliza fácilmente en los campos de la anestesia y los analgésicos, con el primer artículo publicado en 18857. El primer protocolo para las inyecciones lumbares de IT en ratones adultos se publicó en 19808, y desde entonces ha sido ampliamente adoptado y revisado9. Se han realizado ligeros ajustes o mejoras en estos protocolos 10,11,12, incluyendo una técnica de conservación del producto 13. Los protocolos para las inyecciones lumbares de IT en ratas adultas también se publicaron por primera vez en 1976, con cateterismo para la administración crónica14 e inyección directa para tratamientos únicos15. Más recientemente, los grupos han publicado protocolos para inyecciones lumbares de IT en ratones y ratas neonatos o juveniles16,17.
La amplia adopción y validación de esta técnica para evitar la BHE y las células diana en el SNC ha dado lugar a múltiples estudios preclínicos y clínicos exitosos de terapia génica para el tratamiento de enfermedades neurológicas. Los datos positivos de eficacia y seguridad en ratones, ratas y primates no humanos que modelan enfermedades neurológicas han despertado entusiasmo e interés en torno al potencial de beneficio clínico de estas enfermedades 18,19,20,21,22,23. Un puñado de estos estudios se encuentran ahora en ensayos clínicos (por ejemplo, clinicaltrials.gov identificadores NCT02362438, NCT04737460, NCT03381729 y NCT05518188)3,6. En este artículo se describe un protocolo sencillo para la inyección lumbar de IT en ratones y ratas de diferentes edades, sin extirpar el líquido cefalorraquídeo, que puede ser adoptado para proyectos de terapia génica traslacional. Este protocolo es similar a los protocolos ya disponibles que se han adoptado ampliamente; Sin embargo, es valioso citar estos protocolos relevantes en un solo lugar para facilitar el acceso y la referencia, junto con las imágenes de video que los acompañan. Este protocolo explica la inyección para ratones y ratas neonatos en el día postnatal (P) 0-1 y ratones y ratas juveniles P21, con resultados representativos de una inyección IT lumbar exitosa y fallida en P1 en ratones. En la discusión, se abordan los errores comunes y los detalles específicos que requieren una atención cuidadosa al realizar este procedimiento, así como las recomendaciones sobre cómo practicar estas inyecciones antes de comenzar un estudio preclínico.
Protocolo
Los procedimientos descritos en este documento fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC, por sus siglas en inglés) del Centro Médico Southwestern de la Universidad de Texas. Se utilizaron ratones machos y hembras C57BL6/J de tipo salvaje, de P1 a P28, para los protocolos con ratones. Se utilizaron ratas Sprague-Dawley macho y hembra de tipo salvaje, de P1 a P56, para los protocolos con ratas. Aparte de la cirugía de supervivencia descrita en la sección 3, se considera que todos los demás procedimientos causan solo molestias momentáneas y no requieren el uso de anestésicos o analgésicos. Las personas deben monitorear a los animales de laboratorio para detectar algo más que molestias momentáneas y buscar orientación de su IACUC y personal veterinario sobre la necesidad de anestésicos y analgésicos. Los detalles de los reactivos y equipos utilizados se proporcionan en la Tabla de Materiales.
1. Inyección IT lumbar en ratones >P21
- Preparación
- Prepare las soluciones inyectables, incluido el vector de terapia génica a las concentraciones deseadas y una solución de control (generalmente el tampón de formulación utilizado en la producción de vectores). Las soluciones inyectables deben ser estériles y permanecer estériles durante todo el procedimiento.
NOTA: Todas las soluciones deben mantenerse en hielo durante todo el procedimiento. - Reúna y desinfecte todos los materiales, incluida la jeringa y la aguja, la pipeta y la solución inyectable. Seguir los lineamientos institucionales con respecto al uso de cabinas de bioseguridad y la exposición a inyectantes. Los procedimientos aquí descritos se llevaron a cabo en un gabinete de bioseguridad de clase 2.
- Con una pipeta de microlitros, mida el volumen deseado de solución inyectable y transfiéralo a una película de parafina estéril. Un volumen de inyección de 5 μL se utiliza habitualmente y se trata como el volumen objetivo para ratones adultos >P21 (Tabla 1).
NOTA: El volumen se puede aumentar si es necesario; Sin embargo, los animales deben ser monitoreados de cerca para detectar reacciones adversas a volúmenes de inyección más grandes. Consulte la sección Discusión para obtener detalles sobre el volumen de inyección y las reacciones adversas. La solución también se puede transferir directamente de la punta de la pipeta a una jeringa, o se pueden usar jeringas de microlitros herméticas al gas calibradas para medir directamente el volumen de la solución inyectable. - Introduzca la solución en una jeringa de microlitros con una aguja de 30 G y 0,5", con cuidado de no sacar burbujas de aire.
NOTA: El calibre y la longitud de la aguja pueden afectar la penetración en la piel. Al considerar el tamaño de la jeringa que se utilizará, el volumen de inyección no debe ser inferior al 10% de la capacidad de la jeringa. Para volúmenes superiores al 50% de la capacidad de la jeringa, asegúrese de que el émbolo se pueda presionar fácilmente con el dedo índice. Si el émbolo no se puede presionar fácilmente, use una jeringa de mayor capacidad.
- Prepare las soluciones inyectables, incluido el vector de terapia génica a las concentraciones deseadas y una solución de control (generalmente el tampón de formulación utilizado en la producción de vectores). Las soluciones inyectables deben ser estériles y permanecer estériles durante todo el procedimiento.
- Restricción
- Con la mano dominante, sostenga al ratón consciente (no anestesiado) por la cola sobre una toalla de papel. La toalla de papel ayudará a contener, calmar y evitar que el ratón muerda. El ratón debe estar en posición neutra en decúbito prono con la cara lateral del cuerpo hacia ti.
NOTA: No es necesario entrenar o habituar a los ratones a esta restricción antes del procedimiento. Los ratones pueden tener dificultades debido a la restricción, pero no deben provocar una respuesta específica al dolor. Si se observan respuestas al dolor más que momentáneas, puede ser necesaria la administración de analgésicos; Busca orientación veterinaria. - Con la mano no dominante, dobla una porción de la toalla de papel sobre la cabeza y la parte superior del cuerpo del ratón y agarra firmemente la cintura pélvica entre el pulgar y el dedo índice no dominantes. Asegúrese de que la palma esté ahuecada, descansando alrededor de la cabeza del ratón. La cresta ilíaca del ratón debe ser palpable y estar situada en el centro de la falange distal de cada dedo (Figura 1A,B).
NOTA: La sujeción de la mano o de una toalla de papel no debe afectar la respiración. - Gire suavemente la base de la cola para asegurar la alineación adecuada de la columna vertebral. La pelvis del ratón debe ser cuadrada, de modo que las apófisis vertebrales de la columna lumbar sean perpendiculares a la superficie de trabajo.
- Frote la región lumbar dorsal del ratón con una almohadilla de preparación con alcohol al 70%.
- Separe el cabello ~ 2-6 mm craneal a la cresta ilíaca para ayudar a visualizar el lugar de la inyección.
- Siente el espacio intervertebral L4-L5 o L5-L6, ~2-6 mm craneal a la cresta ilíaca.
NOTA: La distancia exacta varía según el tamaño y la antigüedad del ratón.
- Con la mano dominante, sostenga al ratón consciente (no anestesiado) por la cola sobre una toalla de papel. La toalla de papel ayudará a contener, calmar y evitar que el ratón muerda. El ratón debe estar en posición neutra en decúbito prono con la cara lateral del cuerpo hacia ti.
- Inyección
- Con la mano dominante, sostenga el centro de la jeringa de microlitros y colóquela perpendicular a la columna vertebral del ratón en el espacio intervertebral L4-L5 o L5-L6. Asegúrese de que el émbolo de la jeringa se pueda presionar con el dedo índice sin mover excesivamente la mano. Con el bisel de la aguja mirando hacia la cabeza del ratón, perfore la piel sobre el espacio intervertebral.
- Cuando los bordes del hueso alrededor del espacio intervertebral se sientan en la punta de la aguja, reduzca el ángulo de la jeringa a 30-45 grados (Figura 1A).
- La aguja debe deslizarse en el espacio intervertebral causando un movimiento repentino de la cola, y debe sujetarse firmemente entre las vértebras.
- Teniendo cuidado de no desplazar la jeringa, presione el émbolo de manera constante para administrar la solución dentro de los 10 segundos.
- Sostenga la jeringa en su lugar durante 15-30 s después de presionar completamente el émbolo para permitir la disipación de la solución y evitar el reflujo.
- Retire suave y lentamente la jeringa del ratón en el mismo ángulo de entrada de 30-45 grados. A medida que se retira la aguja, gire la jeringa para evitar el reflujo.
NOTA: Tenga cuidado de no avanzar la aguja al girar la jeringa, ya que esto puede causar daño físico a la médula espinal. - Libere al ratón de la sujeción y devuélvalo a la jaula de inicio.
- Monitoree el ratón después de la inyección para detectar deambulación anormal, deterioro motor, anomalías respiratorias y coordinación. Consulte la Discusión para obtener detalles adicionales sobre las reacciones adversas.
- Limpie el equipo siguiendo las recomendaciones del fabricante. Para inyecciones múltiples, se recomiendan diferentes jeringas para cada vector de terapia génica y solución de control.
NOTA: Las agujas extraíbles se pueden limpiar, esterilizar y reutilizar varias veces; Sin embargo, no se deben usar agujas desafiladas, ya que pueden dañar al animal y aumentar la probabilidad de que se omitan las inyecciones. Una aguja desafilada no perforará la piel fácilmente y debe desecharse adecuadamente. Si las jeringas son limitadas, es aconsejable completar todas las inyecciones del vehículo antes de proceder al vector de terapia génica e inyectar la dosis más baja de terapia génica antes de administrar dosis más altas. - Seguir las pautas institucionales para la esterilización de equipos entre animales.
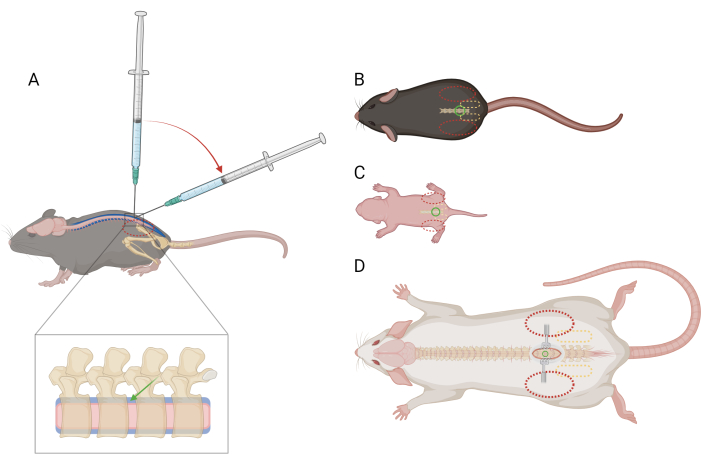
Figura 1: Esquema de la colocación del dedo y la jeringa para la inyección intratecal lumbar en ratones y ratas. (A) Vista lateral de un ratón >P21 que muestra la colocación de la aguja y la transición del ángulo de la jeringa durante una inyección lumbar IT. El óvalo rojo discontinuo indica la posición de los dedos sobre la cresta ilíaca del ratón. Una vista ampliada de la columna vertebral muestra el espacio intratecal (azul) con la colocación aproximada de la aguja (flecha verde) y la médula espinal (rosa). Vista dorsal de (B) un ratón >P21, (C) un ratón D) una rata >P21, con puntos de referencia para la colocación de la aguja (círculo verde), la cintura pélvica (óvalo amarillo discontinuo) y la colocación de los dedos (óvalo rojo discontinuo). El sitio de la incisión y los retractores también se representan en (D). Haga clic aquí para ver una versión más grande de esta figura.
2. Inyección lumbar IT en ratones y ratas
- Preparación
- Siga el paso 1.1. La única excepción es el volumen de inyección en el paso 1.1.3.
NOTA: Los volúmenes de inyección recomendados para ratones neonatos (P0-P1) no deben exceder los 3 μL, para ratones juveniles (P5-P7) no deben exceder los 5 μL, y para ratones juveniles (P10) no deben exceder los 10 μL. Los volúmenes de inyección recomendados para ratas neonatas (P0-P1) no deben exceder los 5 μL, para ratas juveniles (P5-P7) no deben exceder los 10 μL, y para ratas juveniles (P10) no deben exceder los 30 μL (Tabla 1).
- Siga el paso 1.1. La única excepción es el volumen de inyección en el paso 1.1.3.
- Restricción
- Con la mano dominante, sostenga al ratón o rata por la cola sobre una toalla de papel. El ratón/rata debe estar en la posición prona neutra con la cara lateral del cuerpo hacia ti.
NOTA: Los ratones/ratas pueden tener dificultades debido a la restricción, pero no deben provocar una respuesta específica al dolor. Si se observan respuestas al dolor más que momentáneas, puede ser necesaria la administración de analgésicos; Busca orientación veterinaria. - Agarre suave pero firmemente la cintura pélvica entre el pulgar no dominante y el dedo índice. La cresta ilíaca debe ser palpable y estar situada en el centro de la falange distal de cada dedo (Figura 1C).
NOTA: A esta edad, no hay preocupación por ser mordido, por lo que no es necesario envolver la toalla de papel sobre el ratón / rata. Puede ser necesario usar una toalla de papel en ratas P5-10 para mantener quietas a las crías de ratas más grandes. - Gire suavemente la base de la cola para asegurar la alineación adecuada de la columna vertebral. La pelvis del ratón/rata debe ser cuadrada para que las apófisis vertebrales de la columna lumbar queden perpendiculares a la superficie de trabajo.
- Frote la región lumbar dorsal del ratón/rata con una almohadilla de preparación con alcohol al 70%.
- Separe el cabello, si corresponde, ~ 1-3 mm craneal a la cresta ilíaca para ayudar a visualizar el lugar de la inyección. La visualización del área objetivo es más fácil en ratones/ratas más jóvenes. En los neonatos sin pelo, se puede ver una hendidura en el espacio intervertebral.
- Sentir o visualizar el espacio intervertebral L4-L5 o L5-L6, ~1-3 mm craneal a la cresta ilíaca.
NOTA: La distancia exacta varía según el tamaño y la edad del ratón/rata.
- Con la mano dominante, sostenga al ratón o rata por la cola sobre una toalla de papel. El ratón/rata debe estar en la posición prona neutra con la cara lateral del cuerpo hacia ti.
- Inyección
- Con la mano dominante, sostenga el centro de la jeringa de microlitros y colóquela en un ángulo de 30 a 45 grados con respecto al lomo del ratón/rata. Con el bisel de la aguja mirando hacia la cabeza del ratón/rata, perfore la piel aproximadamente 1-3 mm hasta el espacio intervertebral. Debido a la orientación angular de la jeringa, el punto de inserción en la piel es ligeramente caudal al espacio intervertebral.
NOTA: Esta distancia puede cambiar con la edad y el tamaño del ratón/rata. - El resto de los pasos son idénticos a los pasos 1.3.3-1.3.10 de los ratones >P21.
- Con la mano dominante, sostenga el centro de la jeringa de microlitros y colóquela en un ángulo de 30 a 45 grados con respecto al lomo del ratón/rata. Con el bisel de la aguja mirando hacia la cabeza del ratón/rata, perfore la piel aproximadamente 1-3 mm hasta el espacio intervertebral. Debido a la orientación angular de la jeringa, el punto de inserción en la piel es ligeramente caudal al espacio intervertebral.
3. Inyección lumbar IT en ratas >P21
NOTA: Existen múltiples procedimientos de inyección IT descritos en la literatura, que van desde técnicas no anestesiadas hasta abordajes quirúrgicos más extensos14,15. Se describe un procedimiento de inyección directa mediante una técnica mínimamente invasiva que utiliza anestesia ligera y una pequeña incisión en la piel. El uso de anestesia, como el gas isoflurano, puede ayudar con la restricción, relajar la musculatura y prevenir el movimiento durante la inyección. Hacer una pequeña incisión en la piel sobre el sitio de la inyección mejora la precisión de la inyección al permitir la visualización del espacio intervertebral y eliminar la necesidad de perforar la piel gruesa. Debido a la incisión, se requiere el uso de anestésicos y analgésicos. Con la práctica, es posible realizar inyecciones lumbares IT en ratas mayores de P21 sin anestesia ni incisión, a criterio del usuario y dependiendo de los requisitos institucionales15. Siga las pautas y consideraciones institucionales con respecto a la anestesia, los analgésicos apropiados y la cirugía de supervivencia para animales de laboratorio.
- Preparación
- Siga el paso 1.1. Las únicas excepciones son el volumen de inyección en el paso 1.1.3 y el tamaño de la aguja en el paso 1.1.4. Los volúmenes de inyección para ratas pueden variar mucho según la edad y el tamaño corporal. Consulte la sección de Discusión para obtener más información sobre el volumen de inyección a diferentes edades (Tabla 1).
NOTA: Se recomienda una aguja de 27 G x 1" para ratas adultas, ya que las agujas de menor calibre pueden doblarse y las agujas más cortas pueden no penetrar adecuadamente en el espacio intratecal. Se puede usar una aguja más larga (1.25-1.5") si lo desea. - Anestesiar a la rata con el anestésico preferido y aprobado (siguiendo los protocolos aprobados institucionalmente).
NOTA: Para los procedimientos aquí descritos, las ratas fueron anestesiadas con gas isoflurano y una mezcla 1:1 de lidocaína: se utilizó bupivacaína como anestésico local. La temperatura corporal debe mantenerse utilizando una fuente de calor externa aprobada durante todo el procedimiento y la recuperación. - Siga la preparación aséptica estándar del sitio quirúrgico para cada animal. Afeita brevemente la región lumbar dorsal y prepara la piel con un exfoliante quirúrgico, betadine y alcohol isopropílico al 70 %.
- Siga el paso 1.1. Las únicas excepciones son el volumen de inyección en el paso 1.1.3 y el tamaño de la aguja en el paso 1.1.4. Los volúmenes de inyección para ratas pueden variar mucho según la edad y el tamaño corporal. Consulte la sección de Discusión para obtener más información sobre el volumen de inyección a diferentes edades (Tabla 1).
- Procedimiento quirúrgico
- Coloca a la rata en posición prona neutra con la cara lateral del cuerpo hacia ti.
- Palpar la cintura pélvica, identificando la cresta ilíaca y la unión lumbosacra. En las ratas >P21, los procesos vertebrales se pueden identificar fácilmente.
- Con un bisturí, haga una incisión de 1 cm sobre el espacio intervertebral L4-L5 o L5-L6. La incisión solo debe involucrar la piel y la fascia subyacente, dejando el músculo intacto.
NOTA: Es útil usar retractores para mantener la piel abierta durante el resto del procedimiento. - Agarre suave pero firmemente la cintura pélvica entre el pulgar no dominante y el dedo índice. La cresta ilíaca debe ser palpable y estar situada en el centro de la falange distal de cada dedo (Figura 1D). Use pinzas para mosquitos para sondear a lo largo de la línea media de la espalda para ubicar el espacio intervertebral.
- Inyección
- Con la mano dominante, sostenga el centro de la jeringa de microlitros y colóquela perpendicular a la columna vertebral de la rata en el espacio intervertebral L4-L5 o L5-L6. Asegúrese de que el émbolo de la jeringa se pueda presionar con el dedo índice sin mover excesivamente la mano. Con el bisel de la aguja mirando hacia la cabeza de la rata, perfore el músculo con la aguja sobre el espacio intervertebral.
- Avance la aguja en el espacio intervertebral.
NOTA: La aguja puede tener una ligera resistencia a medida que pasa entre las apófisis vertebrales, y es posible que sea necesario ajustar ligeramente el ángulo de la jeringa para pasar a través de este espacio. Sin embargo, debe permanecer aproximadamente a 90 grados, perpendicular a la columna vertebral. Se sentirá un chasquido cuando la aguja entre en el espacio intratecal. Dependiendo de los parámetros anestésicos, un movimiento de la cola o de la pata puede ser perceptible o no. La aguja debe estar firmemente sujeta entre las vértebras. - Teniendo cuidado de no mover la jeringa fuera de su posición, presione el émbolo para administrar la solución dentro de los 30 segundos.
NOTA: A diferencia de las inyecciones en ratones, es posible que no sea posible reducir el ángulo de la jeringa en ratas >P21 utilizando este método. Los volúmenes más grandes deben inyectarse a un ritmo más lento para evitar la acumulación excesiva de presión. - Mantenga la jeringa en su lugar durante 30-60 s después de presionar completamente el émbolo para permitir la disipación de la solución y evitar el reflujo.
- Retire suavemente la jeringa de la rata. A medida que se retira la aguja, gire la jeringa para evitar el reflujo.
NOTA: Tenga cuidado de no avanzar la aguja al girar la jeringa, ya que esto puede causar daño físico a la médula espinal. - Cierre la incisión en la piel con un método aprobado, como suturas o clips para heridas. Para las ratas utilizadas en este protocolo, la piel se cerró en un patrón intradérmico continuo o interrumpido simple utilizando una sutura 5-0 PDS II.
- Recupera la rata de la anestesia.
- Siga los pasos 1.3.9-1.3.10 y todas las pautas de cuidados postoperatorios.
Resultados
Aunque muchos factores pueden influir en la transducción de vectores de terapia génica, la tinción histológica del tejido sigue siendo el método más preciso para determinar el éxito de las inyecciones intratecales (IT) lumbares. La distribución amplia y uniforme del vector de terapia génica dentro del sistema nervioso central (SNC) después de la inyección es indicativa de un procedimiento exitoso. La figura 2C representa una inyección exitosa de una terapia génica autocomplementaria mediada por AAV9 que impulsa una expresión transgénica débil y ubicua bajo el promotor JeT a una dosis de 1,3 × 1011 vg/ratón en ratones neonatos (P1), 4 meses después de la inyección. El análisis de ARNoscopio, que utiliza una sonda dirigida al transgén administrado por la terapia génica, revela una amplia distribución en la médula espinal lumbar, la médula espinal cervical y el cerebro. Se incluye una sección del hígado y el corazón para resaltar que, incluso con la inyección directa de líquido cefalorraquídeo (LCR), el vector de la terapia génica aún puede distribuirse a los tejidos periféricos.
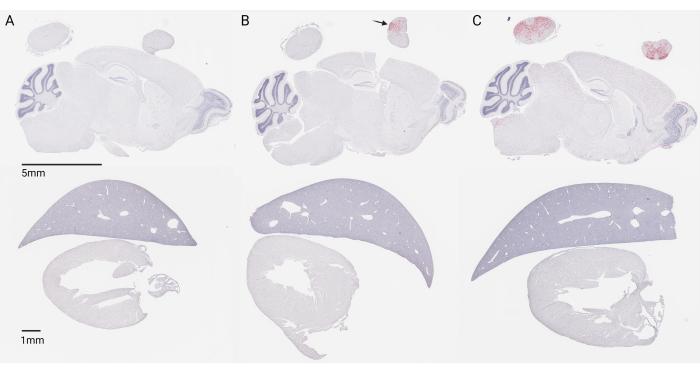
Figura 2: Secciones de tejido de 5 micras teñidas del SNC de ratón y tejido periférico 4 meses después de la inyección en P1. La tinción roja indica la expresión de transgenes a través del ARNoscilo, y la contratinción azul de los núcleos se realiza a través de la hematoxilina. (A) Inyección con un tampón de formulación de control. (B) Inyección intraparenquimatosa fallida con un vector AAV9 (DDX3Xopt-SpA scAAV9_JeT-h). (C) Inyección IT lumbar exitosa con un vector AAV9 (DDX3Xopt-SpA de scAAV9_JeT-h). El vector de terapia génica utilizado en (B) y (C) se administró a una dosis traslacionalmente relevante de 1,3E11 vg/ratón. Barra de escala: panel superior (5 mm); Panel inferior (1 mm). Haga clic aquí para ver una versión más grande de esta figura.
La expresión concentrada en la médula espinal lumbar junto con una falta de expresión en el cerebro, como se muestra en la Figura 2B, puede indicar una inyección intraparenquimatosa de la médula espinal y debe considerarse una inyección fallida. Esto sucede cuando la aguja se inserta demasiado adentro de la columna vertebral, más allá del espacio intratecal y dentro de la médula espinal. Además, la expresión muy baja o nula en la médula espinal y el cerebro (no mostrada) también debe considerarse una inyección fallida fuera del objetivo, suponiendo que se está utilizando un vector y una dosis donde se espera una distribución amplia del SNC. Esto puede deberse a que no se insertó la aguja lo suficientemente lejos o a que es lateral a la línea media.
Los patrones de expresión observados a partir de inyecciones exitosas pueden diferir debido a los siguientes ocho factores como ejemplos: (1) edad en el momento de la inyección, (2) inmunidad preexistente, (3) velocidad de infusión, (4) vector de terapia génica, (5) dosis de terapia génica, (6) proteínas de la superficie celular, (7) tropismo y (8) si corresponde, una elección de promotor adecuada para impulsar la expresión de transgenes6. Si bien los patrones de expresión pueden diferir, la distribución amplia, uniforme y generalizada será universal siempre que la dosis sea lo suficientemente alta con un vector efectivo, como AAV9.
Las principales limitaciones del uso del análisis histológico para confirmar el éxito de la inyección IT lumbar son los extensos tiempos de espera (esperar hasta el final de un estudio, después de que se realizan las necropsias y se recolecta el tejido) y los amplios recursos necesarios para procesar tejido de todos los ratones en un estudio grande de terapia génica. Desafortunadamente, nuestra experiencia ha sido que los indicadores inmediatos y directos de una inyección positiva o negativa pueden ser poco confiables; Sin embargo, el reflejo de movimiento de la cola cuando la aguja entra en el espacio intratecal es un buen indicador de un posicionamiento exitoso en tiempo real y probablemente indica una inyección exitosa. No confunda un espasmo cuando la aguja perfora la piel en un ratón/rata no anestesiado con una respuesta de movimiento de la cola a la aguja que entra en el espacio intratecal. Se ha reportado que el uso de agentes farmacológicos como NMDA, sustancia P y lidocaína, ya sea en entrenamiento o mezclados con la solución inyectable experimental, proporciona una indicación más inmediata del éxito de la inyección 9,11,24. Si se consideran estos agentes, es importante evaluar su compatibilidad con el vector de terapia génica.
Discusión
La inyección lumbar IT es un procedimiento rápido y mínimamente invasivo que administra de forma fiable un vector de terapia génica en el LCR para el tratamiento de enfermedades del SNC 5,6. El procedimiento es relevante desde el punto de vista traslacional, y el protocolo descrito aquí detalla cómo realizar esta vía de administración en ratones y ratas de todas las edades, desde neonatos hasta adultos. Es importante definir este protocolo para ratones y ratas de todas las edades, junto con proporcionar videos de apoyo, para ayudar a los investigadores en la adopción de este método para la administración de terapia génica. La experiencia de nuestro laboratorio es que este protocolo puede implementarse de manera consistente en múltiples usuarios y estudios a lo largo del tiempo 18,25,26,27,28,29,30.
Existen diferencias importantes al realizar la inyección lumbar IT en ratones/ratas más jóvenes en comparación con ratones/ratas mayores, sobre todo el ángulo en el que se inserta la aguja en la columna vertebral y el volumen recomendado que se inyecta. Los volúmenes reportados de inyecciones IT lumbares varían considerablemente entre estudios y especies31. La consideración del volumen de inyección es importante para evitar elevaciones duraderas de la presión intracraneal (PIC), que pueden comprometer el flujo de LCR y sangre cerebral, causar molestias y provocar complicaciones neurológicas crónicas, incluyendo hidrocefalia, isquemia, lesión celular y muerte32,33. La PIC está determinada por el volumen del líquido cefalorraquídeo, la sangre cerebral y el tejido del SNC, que no se puede correlacionar directamente con el peso corporal. En el funcionamiento normal, la PIC está autorregulada por muchos factores, incluyendo el volumen de LCR, el volumen de sangre cerebral, la respiración, la posición del cuerpo, la tasa de producción de LCR y la tasa de drenaje de LCR en la sangre33,34. Por lo tanto, los volúmenes de inyección de IT deben determinarse en función de las propiedades del LCR (Tabla 1) en lugar del peso corporal 25,27,28,30. Los volúmenes recomendados para inyectar a cada edad en cada especie se indican en negrita.
| Volumen de inyección de TI | Valores de LCR en adultos | |||||||
| P0-1 (μL) | P5-7 (μL) | P10 (μL) | >P21 (μL) | Volumen total (μL) | Tasa de producción (μL/min) | Volumen de negocios (h) | Presión intracraneal (mm Hg) | |
| Ratón | 3 | 5 | 5-10 | 5-20 | 30-4025,30 | 0,32-0,3525,30 | 1.7-225,30 | 5,0 +/- 0,528 |
| Ratas | 5 | 5-10 | 10-30 | 10-200 (20-75) | 15025 | 1,7-2,825 | 2-2.6625 | 8,6 +/- 1,7,27 |
Tabla 1: Resumen de los volúmenes de inyección IT lumbar en ratones y ratas a diferentes edades. Se recomiendan valores en negrita y se han entregado de forma segura. Los volúmenes máximos posibles no han sido evaluados formalmente. Se incluye información adicional sobre los parámetros conocidos del LCR (volumen total, tasa de producción, renovación y presión intracraneal) en ratones y ratas como referencia.
Existe una falta de conocimiento en todo el campo con respecto al umbral superior para los volúmenes de inyección IT en bolo único. En humanos adultos, ratas y ratones donde se conoce el volumen de LCR, un aumento del 30% en el volumen total de LCR no parece causar lesiones crónicas o enfermedades 31,33,35,36. La falta de volúmenes conocidos de LCR en ratones juveniles o neonatos hace imposible una extrapolación similar. Algunos grupos están empezando a analizar el volumen y la producción de peste porcina clásica en animales más jóvenes37. Hasta que se confirmen investigaciones adicionales en estas áreas, el volumen de inyección continuará sujeto a los valores informados por los investigadores.
Los ratones y las ratas, especialmente cuando se tratan a edades más tempranas o con altos volúmenes de inyección, pueden provocar flexión de los músculos, extensión de las extremidades, respiración rápida o parálisis temporal de las extremidades posteriores que debería resolverse por sí sola en unos pocos minutos. En casos extremos, las elevaciones agudas de la PIC pueden causar anomalías cardiovasculares y respiratorias, que pueden ser mortales32,33. Si después de 24 horas persiste alguna anomalía posterior al procedimiento, los ratones/ratas deben ser retirados del estudio y sacrificados de forma humanitaria. La parálisis persistente de las extremidades posteriores puede ocurrir si la aguja se inserta demasiado lejos, impactando la médula espinal. Esto puede deberse a un error común al realizar la inyección lumbar IT: el movimiento de la jeringa después del movimiento de la cola mientras se presiona el émbolo. Se debe evitar el movimiento de la jeringa y la aguja. Si no se puede adquirir la posición correcta con el pinchazo inicial, se puede hacer un segundo intento en el mismo lugar. Si el segundo intento tampoco tiene éxito, intente modificar la posición de la aguja para dirigirse al siguiente espacio intervertebral. Tenga en cuenta que varios pinchazos con aguja pueden provocar fugas de una inyección exitosa posterior.
Llegar a ser competente en la inyección lumbar puede llevar tiempo. Para practicar las inyecciones como un procedimiento terminal, siga el protocolo anterior utilizando una solución de colorante aprobada, como el azul de Evans o el colorante verde McCormick filtrado de 0,2 micras (Figura 3) o con los agentes farmacológicos abordados en la sección de Resultados representativos. Se recomienda el uso de tinte para solucionar problemas y dominar la inyección porque es fácil saber si una inyección fue un éxito o un fracaso en 1 minuto. La práctica con el tinte es solo para procedimientos que no son de supervivencia, ya que los animales pueden desarrollar una reacción al tinte cuando se administra directamente al SNC. Esta reacción puede ocurrir dentro de un minuto después de una inyección exitosa y se caracteriza por movimientos rápidos de picazón y retorcimiento. Los animales deben ser sacrificados inmediatamente una vez que se observe esta reacción para minimizar las molestias. Después de una práctica exitosa de inyección de tinte, el tinte permanecerá localizado en la columna vertebral (sin tinte en el tejido periférico cercano) y ascenderá por la columna vertebral hasta el cerebelo, el cerebro y los bulbos olfativos. En P1, la piel es lo suficientemente transparente como para que se pueda ver que el tinte se mueve por la columna vertebral en la cola. Si el tinte no llega al cerebro en unos minutos, la inyección falla.

Figura 3: Tinte verde McCormick en el cerebro después de practicar con éxito inyecciones lumbares IT. Todos los cerebros son de ratones P21 inyectados con tinte de 5 μL y se muestran en la vista ventral. Haga clic aquí para ver una versión más grande de esta figura.
Para obtener información adicional sobre los parámetros asociados relevantes para el diseño de ensayos preclínicos, como el título y las dosis virales, consulte las revisiones publicadas anteriormente 3,6,31.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Nos gustaría agradecer a la instalación central de vectores virales AAV de UT Southwestern por fabricar el vector AAV9 y a Yuhui Hu, científico investigador en el Gray Lab, por procesar y teñir el tejido presentado en la Figura 2.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 micron filter | Electron Microscopy Sciences | 67005 | Used to filter dye solution |
| 0.5 to 10 µL Pipette | Eppendorf | TI13690026 | Used to measure injection solution |
| 1.5 mL Microtube | Eppendorf | 22364111 | Used to store injection solutions |
| 10 µL Syringe | Hamilton | 7635-01 | Injection volume should not be less than 10% of syringe capacity |
| 10 to 100 µL Pipette | Eppendorf | TI13690029 | Used to measure injection solution |
| 10µl Pipette Tips | USA Scientific Inc | 11203810 | Used to measure injection solution |
| 100 µL Syringe | Hamilton | 7638-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 100 µL Pipette Tips | USA Scientific Inc | 11231840 | Used to measure injection solution |
| 25 µL Syringe | Hamilton | 7636-01 | Ideal for 5-10 µL injections. Injection volume should not be less than 10% of syringe capacity |
| 27 Gauge Needle(s) | Hamilton | 7803-01 | For rat >21 only. 27 gauge, Small Hub RN Needle, 1 in, point style 4 at 12°, 6/PK |
| 30 Gauge Needle(s) | Hamilton | 7803-17 | 30 gauge, Small Hub RN Needle, 0.5 in, point style 4 at 12°, 6/PK |
| 50 µL Syringe | Hamilton | 7637-01 | For rat >21 only. Injection volume should not be less than 10% of syringe capacity |
| 70% Ethanol | Pharmco | 111000140 | Used to sanitize workspace and equipment |
| 70% Isopropyl Alcohol Prep Pads | PDI | B60307 | Used to prepare injection site |
| Analgesic | For rat >21 only. | ||
| Anesthetic (Isoflurane) | Piramal Critical Care | 66794001725 | For rat >21 only. |
| Betadine | Purdue Products | 6906606 | For rat >21 only. Used for skin prep |
| Control Solution | Injection solution | ||
| Dye Solution (green) | McCormick | For practice, non-survival only | |
| Gloves | Kimberly-Clark | 19-149-863B | PPE |
| Ice bucket with ice | Fisher Scientific | 03-395-150 | Maintain viral vector solution on ice |
| Mosquito Forceps (curved or straight) | Fine Science Tools | 13009-12 | For rat >21 only. Used to palpate intervertebral space. |
| Needle Holders | Fine Science Tools | 12002-12 | For rat >21 only. Used for skin closure with suture |
| Paper Towel | Berkshire | 18-998-123 | Used to restrain adult mice during injection |
| Parafilm | StatLab | PM996 | Used to draw solution into syringe |
| Retractors | Stoelting | 52124P | For rat >21 only. Used to hold skin incision open |
| Scalpel Blade | Fine Science Tools | 10015-00 | For rat >21 only. Used for incision |
| Scalpel Blade Handle | Fine Science Tools | 10003-12 | For rat >21 only. Used for incision |
| Sterile Syringe | Fisher Scientific | 14-955-459 | Used to filter dye solution |
| Surgical Scrub (Skin Prep) | Medline Industries Inc. | MDS098720 | For rat >21 only. Used for skin prep |
| Suture or Wound Clips | Stoelting | 50483 | For rat >21 only. Used for skin closure. |
| Syringe / Needle Cleaning Solution | Hamilton | 18311 | Can use alternative cleaning solution |
| Thumb Forceps | Fine Science Tools | 11019-12 | For rat >21 only. Used throughout surgical approach and closure |
| Vector Solution | Injection solution |
Referencias
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: Progress and prospects. Nat Rev Drug Discov. 17 (9), 641-659 (2018).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Ling, Q., Herstine, J. A., Bradbury, A., Gray, S. J. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 22 (10), 789-806 (2023).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. J Neurodev Disord. 10 (1), 16 (2018).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-associated virus-based gene therapy for CNS diseases. Hum Gene Ther. 27 (7), 478-496 (2016).
- Chen, X., et al. Biodistribution of adeno-associated virus gene therapy following cerebrospinal fluid-directed administration. Hum Gene Ther. 34 (3-4), 94-111 (2023).
- Corning, J. L. Spinal anesthesia and local medication of the cord. NY Med. J. , 483-485 (1885).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: A new technique. Eur J Pharmacol. 67 (2-3), 313-316 (1980).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Adv Drug Deliv Rev. 55 (8), 1007-1041 (2003).
- Choi, S. E., et al. High-frequency ultrasound-guided intrathecal injections in a young mouse model: Targeting the central nervous system in drug delivery. J Neurosci Methods. 386, 109778 (2023).
- Li, D., Li, Y., Tian, Y., Xu, Z., Guo, Y. Direct intrathecal injection of recombinant adeno-associated viruses in adult mice. J Vis Exp. 144, e58565 (2019).
- Njoo, C., Heinl, C., Kuner, R. In vivo SiRNA transfection and gene knockdown in spinal cord via rapid noninvasive lumbar intrathecal injections in mice. J Vis Exp. 85, e51229 (2014).
- Vulchanova, L., et al. Differential adeno-associated virus-mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain. 6, 31 (2010).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Mestre, C., Pelissier, T., Fialip, J., Wilcox, G., Eschalier, A. A method to perform direct transcutaneous intrathecal injection in rats. J Pharmacol Toxicol Methods. 32 (4), 197-200 (1994).
- Donsante, A., Rasmussen, S. A., Fridovich-Keil, J. L. Intrathecal vector delivery in juvenile rats via lumbar cistern injection. J Vis Exp. 205, e66463 (2024).
- Lu, X., Jiang, Y. H. Intrathecal injection of newborn mouse for genome editing and drug delivery. J Vis Exp. 205, e65761 (2024).
- Chen, X., et al. Intrathecal AAV9/AP4M1 gene therapy for hereditary spastic paraplegia 50 shows safety and efficacy in preclinical studies. J Clin Invest. 133 (10), JCI164575 (2023).
- Deschenes, N. M., et al. Biochemical correction of GM2 ganglioside accumulation in AB-variant GM2 gangliosidosis. Int J Mol Sci. 24 (11), ijms24119217 (2023).
- Hwang, S. M., Rahman, M. M., Go, E. J., Kim, Y. H., Park, C. K. Specific transcription factors Ascl1 and Lhx6 attenuate diabetic neuropathic pain by modulating spinal neuroinflammation and microglial activation in mice. Biomed Pharmacother. 173, 116392 (2024).
- Kagiava, A., et al. Gene replacement therapy in two Golgi-retained CMT1X mutants before and after the onset of demyelinating neuropathy. Mol Ther Methods Clin Dev. 30, 377-393 (2023).
- Wong, H., et al. CNS-dominant human FMRP isoform rescues seizures, fear, and sleep abnormalities in Fmr1-KO mice. JCI Insight. 8 (11), 169650 (2023).
- Laoharawee, K., et al. Prevention of neurocognitive deficiency in mucopolysaccharidosis type ii mice by central nervous system-directed, AAV9-mediated iduronate sulfatase gene transfer. Hum Gene Ther. 28 (8), 626-638 (2017).
- Aanonsen, L. M., Wilcox, G. L. Phencyclidine selectively blocks a spinal action of N-methyl-D-aspartate in mice. Neurosci Lett. 67 (2), 191-197 (1986).
- Bailey, R. M., Armao, D., Nagabhushan Kalburgi, S., Gray, S. J. Development of intrathecal AAV9 Gene therapy for giant axonal neuropathy. Mol Ther Methods Clin Dev. 9, 160-171 (2018).
- Bailey, R. M., Rozenberg, A., Gray, S. J. Comparison of high-dose intracisterna magna and lumbar puncture intrathecal delivery of AAV9 in mice to treat neuropathies. Brain Res. 1739, 146832 (2020).
- Chen, X., et al. AAV9/MFSD8 gene therapy is effective in preclinical models of neuronal ceroid lipofuscinosis type 7 disease. J Clin Invest. 132 (5), JCI146286 (2022).
- Karumuthil-Melethil, S., et al. Intrathecal administration of AAV/GALC vectors in 10-11-day-old twitcher mice improves survival and is enhanced by bone marrow transplant. J Neurosci Res. 94 (11), 1138-1151 (2016).
- Ling, Q., Rioux, M., Hu, Y., Lee, M., Gray, S. J. Adeno-associated viral vector serotype 9-based gene replacement therapy for SURF1-related Leigh syndrome. Mol Ther Methods Clin Dev. 23, 158-168 (2021).
- Sinnett, S. E., Boyle, E., Lyons, C., Gray, S. J. Engineered microRNA-based regulatory element permits safe high-dose miniMECP2 gene therapy in Rett mice. Brain. 144 (10), 3005-3019 (2021).
- Rahman, M. M., Lee, J. Y., Kim, Y. H., Park, C. K. Epidural and Intrathecal Drug Delivery in Rats and Mice for Experimental Research: Fundamental Concepts, Techniques, Precaution, and Application. Biomedicines. 11 (5), 11051413 (2023).
- Allen, C. H., Ward, J. D. An evidence-based approach to management of increased intracranial pressure. Crit Care Clin. 14 (3), 485-495 (1998).
- Belov, V., et al. Large-volume intrathecal administrations: Impact on CSF pressure and safety implications. Front Neurosci. 15, 604197 (2021).
- Moazen, M., et al. Intracranial pressure changes during mouse development. J Biomech. 49 (1), 123-126 (2016).
- Rieselbach, R. E., Di Chiro, G., Freireich, E. J., Rall, D. P. Subarachnoid distribution of drugs after lumbar injection. N Engl J Med. 267, 1273-1278 (1962).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opin Drug Deliv. 13 (7), 963-975 (2016).
- Ghersi-Egea, J. F., Babikian, A., Blondel, S., Strazielle, N. Changes in the cerebrospinal fluid circulatory system of the developing rat: quantitative volumetric analysis and effect on blood-CSF permeability interpretation. Fluids Barriers CNS. 12, 8 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados