Espectroscopia infrarroja
Visión general
Fuente: Vy M. Dong y Zhiwei Chen, Departamento de química, Universidad de California, Irvine, CA
Este experimento demostrará el uso de espectroscopia de infrarrojo (IR) (también conocido como Espectroscopía Vibracional) para aclarar la identidad de un compuesto desconocido mediante la identificación de la functional group(s) presente. Espectros IR se obtiene en un espectrómetro de IR usando la reflexión total atenuada técnica de muestreo (ATR) con una cuidada muestra de lo desconocido.
Principios
Un enlace covalente entre dos átomos puede considerarse como dos objetos con masas m1 y m2 que están conectados con un resorte. Naturalmente, este vínculo se extiende y comprime con cierta frecuencia vibracional. Esta frecuencia 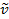 está dada por la ecuación 1, donde k es la constante de fuerza del resorte, c es la velocidad de la luz, y μ es la masa reducida (ecuación 2). La frecuencia se mide típicamente en wavenumbers, que se expresan en centímetros inversos (cm-1).
está dada por la ecuación 1, donde k es la constante de fuerza del resorte, c es la velocidad de la luz, y μ es la masa reducida (ecuación 2). La frecuencia se mide típicamente en wavenumbers, que se expresan en centímetros inversos (cm-1).
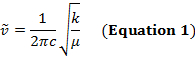
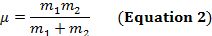
De la ecuación 1, la frecuencia es proporcional a la fuerza de la primavera e inversamente proporcional a las masas de los objetos. Por lo tanto, C-H, N-H, O-H bonos y tiene estirando más frecuencias que C-C y C O bonos, como el hidrógeno es un átomo de luz. Doble y triple enlaces puede considerarse como resortes más fuertes, por lo que un enlace doble de C-O tiene una frecuencia más alta que de un solo enlace de C-O. Luz infrarroja es la radiación electromagnética con longitudes de onda de 700 nm a 1 mm, que es coherente con las fuerzas de enlace relativo. Cuando una molécula absorbe luz infrarroja con una frecuencia que es igual a la frecuencia natural de vibración de un enlace covalente, la energía de la radiación produce un aumento de la amplitud de la vibración del enlace. Si la electronegatividad (tendencia para atraer electrones) de los dos átomos en un enlace covalente son muy diferentes, una separación de carga produce que se traduce en un momento de dipolo. Por ejemplo, en un enlace doble de C-O (grupo carbonilo), los electrones pasan más tiempo alrededor del átomo de oxígeno que el átomo de carbono porque el oxígeno es más electronegativo que el carbono. Por lo tanto, es un momento de dipolo neto, dando por resultado una carga parcial negativa en el oxígeno y una carga parcial positiva sobre el carbono. Por otro lado, un alquino simétrico no tiene un momento dipolar neto debido a los dos momentos de dipolo individuales en cada lado cancelar mutuamente. La intensidad de la absorción infrarroja es proporcional al cambio en el momento de dipolo cuando el bono estira o comprime. Por lo tanto, un estiramiento del grupo carbonilo se mostrará una banda intensa en el IR, y un alquino interno simétrico va a mostrar un pequeño, si no invisible, banda de estiramiento del enlace C-C triple (figura 1). La tabla 1 muestra algunas frecuencias de absorción característico. La figura 2 muestra el espectro IR de un éster de Hantzsch. Observe el pico a 3.343 cm-1 para el N-H solo enlace y el pico a 1.695 cm-1 para los grupos carbonilo. En este experimento, se utiliza la técnica de muestreo de ATR, donde la luz infrarroja se refleja en la muestra que está en contacto con un cristal ATR varias veces. Por lo general, se utilizan materiales con un alto índice de refracción, como seleniuro de germanio y el zinc. Este método permite examinar directamente los analitos sólidos o líquidos sin más preparación.
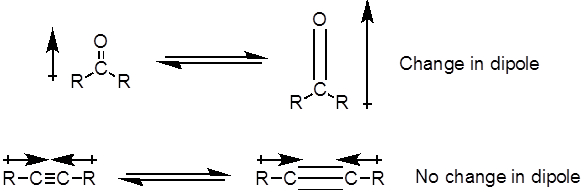
Figura 1. Diagrama que muestra C–O doble y C-tramos de enlace triple C y el cambio resultante en el momento de dipolo.
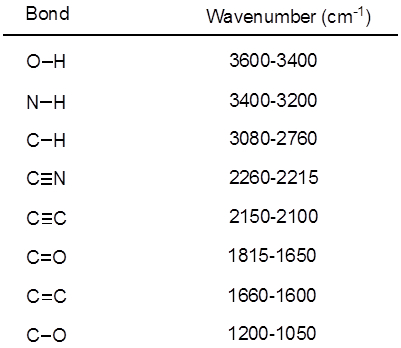
Tabla 1. Frecuencias características de IR de enlaces covalentes en moléculas orgánicas.
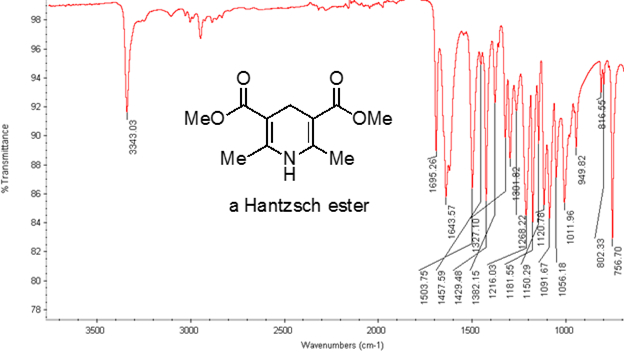
Figura 2. Espectro de IR de un éster de Hantzsch.
Procedimiento
- Encienda el espectrómetro IR y deje que se caliente para arriba.
- Obtener una muestra desconocida de la instructora y grabar la letra y el aspecto de la muestra.
- Recoge un espectro de fondo.
- Usando una espátula de metal, coloque una pequeña cantidad de muestra debajo de la sonda.
- Gire la sonda hasta que encaje en su lugar.
- Registrar el espectro de IR de la muestra desconocida.
- Repetir si es necesario para obtener un buen espectro.
- Registrar las frecuencias de absorción de los grupos funcionales presentes.
- Limpiar la sonda con acetona.
- Apague el espectrómetro.
- Analizar el espectro obtenido. La figura 3 muestra a los posibles candidatos para la muestra desconocida. Indicar la probable identificación de la muestra desconocida.

Figura 3. Diagrama que muestra las posibles identidades de lo desconocido.
Resultados
Tabla 2: apariencia y frecuencias observadas del IR de los compuestos enumerados en Figura 3.
| Número compuesto | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Aspecto | líquido claro | sólido blanco | líquido claro | líquido claro | líquido claro | líquido claro | líquido amarillo | sólido blanco | sólido blanco | líquido claro |
| Frecuencias observadas (cm-1) | 1691, 1601, 1450, 1368, 1266 |
2773, 2730, 1713, 1591, 1576 |
2940, 2867, 1717, 1422, 1347 |
3026, 2948, 2920, 1605, 1496 |
2928, 2853, 1450, 904, 852 |
3926, 3315, 2959, 2120, 1461 |
3623, 3429, 3354, 2904, 1601 |
3408, 3384, 3087, 1596, 1496 |
3226, 2966, 1598, 1474, 1238 |
3340, 2959, 2861, 1468, 1460 |
Aplicación y resumen
En este experimento, hemos demostrado cómo identificar una muestra desconocida basada en su espectro IR característico. Diferentes grupos funcionales dan diferentes frecuencias de estiramientos, que permiten la identificación de los grupos funcionales presentes.
Como se muestra en este experimento, espectroscopía IR es una herramienta útil para el químico orgánico identificar y caracterizar una molécula. Además de química orgánica, espectroscopia IR tiene aplicaciones útiles en otras áreas. En la industria farmacéutica, esta técnica se utiliza para análisis cuantitativo y cualitativo de las drogas. En ciencia de los alimentos, la espectroscopia IR se utiliza para estudiar las grasas y aceites. Por último, la espectroscopia IR se utiliza para medir la composición de gases de efecto invernadero, es decir, CO2, CO, CH4y N2O en los esfuerzos para entender los cambios climáticos globales.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Espectroscopia infrarroja
Organic Chemistry II
215.2K Vistas

Limpieza de cristalería
Organic Chemistry II
123.7K Vistas

Sustitución nucleófila
Organic Chemistry II
99.6K Vistas

Agentes de reducción
Organic Chemistry II
43.1K Vistas

Reacción de Grignard
Organic Chemistry II
149.1K Vistas

Titulación de n-butilitio
Organic Chemistry II
47.9K Vistas

Aparato de Dean-Stark
Organic Chemistry II
100.4K Vistas

Ozonólisis de alquenos
Organic Chemistry II
67.0K Vistas

Organocatálisis
Organic Chemistry II
16.8K Vistas

Acoplamiento cruzado catalizado por paladio
Organic Chemistry II
34.5K Vistas

Síntesis en fase sólida
Organic Chemistry II
41.1K Vistas

Hidrogenación
Organic Chemistry II
49.6K Vistas

Polimerización
Organic Chemistry II
94.3K Vistas

Punto de fusión
Organic Chemistry II
149.9K Vistas

Polarímetro
Organic Chemistry II
100.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados