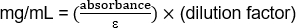Generación de anticuerpos: Producción de anticuerpos monoclonales mediante hibridomas
Fuente: Frances V. Sjaastad1,2, Whitney Swanson2,3y Thomas S. Griffith1,2,3,4
1 Programa de Posgrado en Microbiología, Inmunología y Biología del Cáncer, Universidad de Minnesota, Minneapolis, MN 55455
2 Centro de Inmunología, Universidad de Minnesota, Minneapolis, MN 55455
3 Departamento de Urología, Universidad de Minnesota, Minneapolis, MN 55455
4 Centro De Cáncer Masónico, Universidad de Minnesota, Minneapolis, MN 55455
Los anticuerpos policlonales se definen como una colección de anticuerpos dirigidos contra diferentes determinantes antigénicos de un antígeno o varios antígenos (1). Si bien los anticuerpos policlonales son herramientas poderosas para identificar moléculas biológicas, hay una limitación importante: son incapaces de distinguir entre antígenos que comparten determinantes antigénicos. Por ejemplo, cuando se utiliza albúmina sérica bovina para inmunizar a un animal, las células B con diferentes superficies Ig responderán a diferentes determinantes antigénicos en la albúmina sérica bovina. El resultado es una mezcla de anticuerpos en el antisuero. Debido a que la albúmina sérica bovina comparte algunos epítopos con albúmina sérica humana en regiones evolutivamente conservadas de la proteína, este antisuero de albúmina sérica antibovina también reaccionará con albúmina sérica humana. Por lo tanto, este antisuero no será útil para distinguir entre albúminas de suero bovino y humano.
Se han adoptado varios enfoques para superar el problema de especificidad de los antisueros policlonales. Una es absorbiendo los anticuerpos no deseados pasando el antisuero a través de una columna de cromatografía de antígenos inmovilizados (2). Este método es tedioso y con frecuencia incapaz de eliminar completamente los anticuerpos no deseados. Otro enfoque es aislar las células B productoras de anticuerpos individuales y expandirlas en cultivo. Sin embargo, como la mayoría de las células no transformadas normales, las células B no sobreviven en el cultivo a largo plazo.
Para superar la incapacidad de las células B para sobrevivir en el cultivo, un enfoque es preparar un hibrioma de células mieloma-B. En 1847, Henry Bence-Jones descubrió que los pacientes con mieloma múltiple, un tumor linfoide, producían una gran cantidad de anticuerpos (3). Las células B de estos pacientes se han vuelto malignas y crecen incontrolablemente. Dado que las células B malignas se derivan de un solo clon, son idénticas y producen un solo tipo de anticuerpo(es decir,un anticuerpo monoclonal o mAb). Sin embargo, la mayoría de estas células del mieloma producen anticuerpos de especificidades desconocidas. En 1975, al fusionar una célula de mieloma a una célula B, Cesar Milstein y Georges Kohler lograron producir un hibrioma que se puede cultivar indefinidamente in vitro y produce un número ilimitado de anticuerpos monoclonales de especificidad antigénica conocida (4). La razón de trás de su enfoque es combinar las propiedades inmortales de la célula del mieloma y el anticuerpo que produce propiedades de la célula B. Su técnica revolucionó la producción de anticuerpos y proporciona un poderoso medio para la identificación y purificación de moléculas biológicas utilizando anticuerpos monoclonales.
Generalmente, preparar un anticuerpo monoclonal requiere varios meses. El procedimiento general incluye los siguientes pasos:
- Inmunización y cribado del título de anticuerpos
- Fusión de células B productoras de anticuerpos y células de mieloma
- Crecimiento selectivo del hybridoma
- Detección de los hibridatos para producir el anticuerpo monoclonal deseado
- Clonación mediante la limitación de la dilución - un proceso por el que las células se diluyen a una concentración para permitir estadísticamente que se agregue menos de 1 célula a los pozos de una placa de 96 pocillos. Algunos pozos terminarán con 0 células y algunos tendrán 1 célula. Los pozos con sembrados con 1 célula eventualmente crecerán en una población monoclonal de células.
- Crecimiento del hibridado y preparación de anticuerpos monoclonales
Este protocolo se centra en el último paso : el crecimiento del hibrioma y la preparación del anticuerpo monoclonal. El anticuerpo se purifica del sobrenadante de cultivo mediante precipitación de sulfato de amonio (a menudo conocida como salazón) - un método comúnmente utilizado para eliminar proteínas de una solución. Las proteínas en solución forman enlaces de hidrógeno, junto con otras interacciones hidrófilas, con el agua a través de sus grupos polares e iónicos expuestos. Cuando se añaden concentraciones de iones pequeños y altamente cargados (como amonio o sulfato), estos grupos compiten con las proteínas para unirse al agua. Esto elimina las moléculas de agua de la proteína y disminuye su solubilidad, lo que resulta en la precipitación de la proteína.
Nota: La técnica de cultivo celular estéril debe mantenerse al manipular las células del hibrioma y los medios de comunicación de una manera estéril (por ejemplo, en un gabinete de bioseguridad) hasta que la purificación de anticuerpos sea pisada.
1. Descongelar las células de hibrido congelado
- Incubar el vial que contiene las células de hibrioma congeladas en un baño de agua a 37oC hasta que solo se descongele (aproximadamente 2 minutos).
Utilizando este protocolo, hemos obtenido los siguientes resultados con varios hibridadores diferentes:
Hibridama: RB6-BC5 (rat anti-ratón Ly6C/Ly6G (Gr1) IgG2b, mAb)
OD280 - 1.103
(1.103/1.43) (20) á 15,42 mg/ml
Hibridama: GK1.5 (rat antiratón CD4 IgG2b, mAb)
OD280 - 0.485
(0.485/1.43) (20) 6,78 mg/ml
El procedimiento descrito anteriormente es una forma sencilla y directa de purificar los anticuerpos monoclonales del sobrenadante del cultivo del híbrido. Es importante recordar, sin embargo, que el sulfato de amonio precipitará otras proteínas que pueden estar en el cultivo sobrenadante. En consecuencia, las concentraciones de anticuerpos determinadas a partir de las mediciones de absorbancia son estimaciones. El usuario puede evaluar la pureza de la muestra dializada ejecutando una pequeña cantidad en un gel de po...
- Lipman NS, Jackson LR, Trudel LJ, Weis-Garcia F. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR Journal, 46 (3), 258-268 (2005).
- Arora S, Ayyar BV, O'Kennedy R. Affinity chromatography for antibody purification Methods Mol Biol. 1129, 497-516 (2014).
- Henry BJ. On a new substance occurring in the urine of a patient with mollities ossium. Philosophical Transactions of the Royal Society of London. 138, 55-62 (1848).
- Köhler G and Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity". Nature. 256, 495-497 (1975).
Saltar a...
Vídeos de esta colección:

Now Playing
Generación de anticuerpos: Producción de anticuerpos monoclonales mediante hibridomas
Immunology
42.7K Vistas

Citometría de flujo y clasificación de células activadas por fluorescencia (FACS): Aislamiento de linfocitos B esplénicos
Immunology
91.5K Vistas

Clasificación celular activada magnéticamente (MACS): Aislamiento de linfocitos T del timo
Immunology
22.2K Vistas

Ensayos ELISA: Indirecto, Sándwich y Competitivo
Immunology
233.3K Vistas

Ensayo ELISPOT: Detección de esplenocitos secretores de IFN-γ
Immunology
27.8K Vistas

Inmunohistoquímica e Inmunocitoquímica: Imágenes de tejidos a través de microscopía óptica
Immunology
77.3K Vistas

Microscopía de Inmunofluorescencia: Tinción de inmunofluorescencia de secciones de tejido incrustado en parafina
Immunology
52.7K Vistas

Microscopía de Fluorescencia Confocal: Una Técnica para Determinar la Localización de Proteínas en Fibroblastos de Ratón
Immunology
42.4K Vistas

Técnicas basadas en inmunoprecipitación: purificación de proteínas endógenas mediante perlas de agarosa
Immunology
86.8K Vistas

Análisis del ciclo celular: Evaluación de la proliferación de células T CD4 y CD8 después de su estimulación mediante tinción CFSE y citometría de flujo
Immunology
23.7K Vistas

Transferencia celular adoptiva: Introducción de cenocitos de un ratón donante a un ratón huésped y evaluación del éxito a través de FACS
Immunology
21.6K Vistas

Ensayo sobre la muerte celular: Ensayo de liberación de cromo de la capacidad citotóxica
Immunology
151.1K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados