Análisis del ciclo celular: Evaluación de la proliferación de células T CD4 y CD8 después de su estimulación mediante tinción CFSE y citometría de flujo
Visión general
Fuente: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unidad de Linfinfoesis, Departamento de Inmunología, Instituto Pasteur, París, Francia
2 INSERM U1223, París, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, París, Francia
4 Flow Cytometry Platfrom, Citometría y Biomarcadores UtechS, Centro de Ciencias Traslacionales, Instituto Pasteur, París, Francia
El ciclo celular es un proceso universal de vida. Durante el ciclo celular, una célula sufre varias modificaciones para dividir en dos células hijas. Este mecanismo se produce a lo largo de la vida de un organismo en respuesta a sus necesidades. Las divisiones celulares y el desarrollo embrionario producen un organismo completo a partir de un cigoto unicelular. Durante la edad adulta, el ciclo celular es fundamental para muchos procesos biológicos críticos, como reparaciones de tejidos.
Los mecanismos de división celular son eventos estrechamente controlados donde la célula sufre modificaciones escalonadas antes de la división final. Las celdas que aún no están en el ciclo se describen como en la fase de brecha 0 (G0). Durante esta etapa la célula se considera en reposo. Cuando la célula comienza a ciclo, se reconocen cuatro fases distintas: Brecha 1 (G1), Síntesis (S), Brecha 2 (G2)y Mitosis (M). La fase G1 es un punto de control de los recursos necesarios por la célula para la síntesis de ADN. Luego, se produce la fase S, y se inicia la replicación de ADN, seguida de la interfase G2, otro punto de control que controla todos los elementos necesarios para que la célula se divida. Finalmente, la célula ingresa mitosis y se divide en dos células hijas.
La división celular es un parámetro muy informativo en muchos sistemas biológicos diferentes. En el campo de la inmunología, el análisis de la proliferación de leucocitos puede indicar el mecanismo de la respuesta inmunitaria. Otros dominios de investigación también se basan en el análisis del ciclo celular. Por ejemplo, el análisis del ciclo celular durante el desarrollo del tumor ha mejorado nuestra comprensión del cáncer.
Muchos colorantes fluorescentes ahora están disponibles para el seguimiento de la proliferación celular. Estos tendededes difieren en sus propiedades químicas y espectrales. Existen dos clases diferentes de colorantes: los colorantes proteicos se combinan permanentemente con las proteínas mediante la formación de un enlace covalente, y los colorantes de membrana se intercalan de forma estable dentro de las membranas celulares a través de fuertes asociaciones hidrofóbicas. Los estudios in vitro e in vivo de la proliferación de células inmunitarias por citometría de flujo se encuentran entre las aplicaciones más comunes de ambas clases de destenciones de seguimiento celular (1, 2).
CFSE (Carboxyfluorescein succinimidyl ester) es un tinte fluorescente que marca las células divisorias. Inicialmente, todas las células reciben la misma cantidad de tinte; dividiendo las células uniformemente dividir el tinte que recibieron entre sus dos células hijas. Por lo tanto, el ciclo celular puede ser seguido por la disminución progresiva de la intensidad del tinte en las células. La tinción CFSE es seguida por la citometría de flujo multiparamétrica convencional, una tecnología de alto rendimiento basada en fluorescencia que permite la caracterización fenotípica y funcional de las células en función de su grado de tinción CFSE (3).
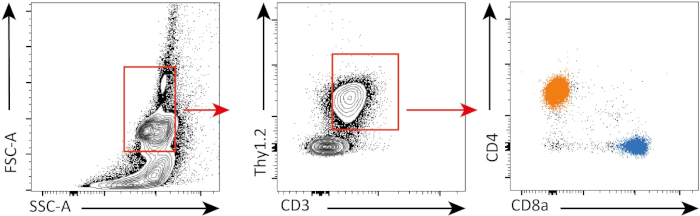
En el siguiente experimento, evaluamos la proliferación de células CD4+ y CD8+ T in vitro,después de la estimulación CD3, utilizando tinción CFSE y citometría de flujo.
Procedimiento
1. Preparación
- Antes de comenzar, ponte guantes de laboratorio y la ropa protectora adecuada.
- Esterilice todas las herramientas de disección, primero con un detergente y luego con 70% de etanol y luego seque bien.
- Preparar 50 ml de la solución salina equilibrada de Hank (HBSS) que contiene un 2% de suero de becerro fetal (FCS).
2. Disección
- Usando un sistema de administración de dióxido de carbono, eutanasia el rat
Resultados
En este experimento, seguimos la proliferación de células esplénicas CD4+ y CD8+ T en cultivo in vitro. Después de 3 días, no vimos fuerte proliferación en las células CD4+ y CD8+ T con o sin estimulación. Esto se puede ver en el panel superior de la Figura 2 donde los picos de CSFE no están disminuyendo. Sin embargo, después de 5 días, comenzamos a ver proliferación en ambas poblaciones, que es...
Aplicación y resumen
Los ensayos de proliferación se utilizan a menudo en diferentes campos, como la inmunología, para determinar el grado de activación de las células. También se realiza en el diagnóstico oncológico para determinar la agresividad tumoral en pacientes. La tinción CFSE es una técnica útil para seguir la proliferación de las poblaciones de células inmunitarias a lo largo del tiempo. Otros métodos permiten la caracterización del ciclo celular. BrdU, un equivalente de CFSE se incorpora sólo en células divisorias....
Referencias
- Lyons, A. B. and Parish, C. R. Determination of lymphocyte division by flow cytometry. Journal of Immunological Methods. 171 (1): 131-37, (1994).
- Lyons, A. B. Analyzing cell division in vivo and in vitro using flow cytometric measurement of CFSE dye dilution. Journal of Immunological Methods. 243 (1-2), 147-154, (2000).
- Quah, B. J., Warren H. S., and Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nature Protocols. 2 (9): 2049-56, (2007).
Saltar a...
Vídeos de esta colección:

Now Playing
Análisis del ciclo celular: Evaluación de la proliferación de células T CD4 y CD8 después de su estimulación mediante tinción CFSE y citometría de flujo
Immunology
24.3K Vistas

Citometría de flujo y clasificación de células activadas por fluorescencia (FACS): Aislamiento de linfocitos B esplénicos
Immunology
93.2K Vistas

Clasificación celular activada magnéticamente (MACS): Aislamiento de linfocitos T del timo
Immunology
23.0K Vistas

Ensayos ELISA: Indirecto, Sándwich y Competitivo
Immunology
239.0K Vistas

Ensayo ELISPOT: Detección de esplenocitos secretores de IFN-γ
Immunology
28.7K Vistas

Inmunohistoquímica e Inmunocitoquímica: Imágenes de tejidos a través de microscopía óptica
Immunology
79.1K Vistas

Generación de anticuerpos: Producción de anticuerpos monoclonales mediante hibridomas
Immunology
43.6K Vistas

Microscopía de Inmunofluorescencia: Tinción de inmunofluorescencia de secciones de tejido incrustado en parafina
Immunology
53.9K Vistas

Microscopía de Fluorescencia Confocal: Una Técnica para Determinar la Localización de Proteínas en Fibroblastos de Ratón
Immunology
43.3K Vistas

Técnicas basadas en inmunoprecipitación: purificación de proteínas endógenas mediante perlas de agarosa
Immunology
87.8K Vistas

Transferencia celular adoptiva: Introducción de cenocitos de un ratón donante a un ratón huésped y evaluación del éxito a través de FACS
Immunology
22.5K Vistas

Ensayo sobre la muerte celular: Ensayo de liberación de cromo de la capacidad citotóxica
Immunology
151.4K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados