Microscopía de Inmunofluorescencia: Tinción de inmunofluorescencia de secciones de tejido incrustado en parafina
Fuente: Thomas Chaffee1, Thomas S. Griffith2,3,4y Kathryn L. Schwertfeger1,3,4
1 Departamento de Medicina y Patología de Laboratorio, Universidad de Minnesota, Minneapolis, MN 55455
2 Departamento de Urología, Universidad de Minnesota, Minneapolis, MN 55455
3 Centro De Cáncer Masónico, Universidad de Minnesota, Minneapolis, MN 55455
4 Centro de Inmunología, Universidad de Minnesota, Minneapolis, MN 55455
Los análisis patológicos de las secciones tisulares se pueden utilizar para obtener una mejor comprensión de la estructura normal del tejido y contribuir a nuestra comprensión de los mecanismos de la enfermedad. Las biopsias de tejido, ya sea de pacientes o de modelos experimentales in vivo, a menudo se conservan fijando en formalina o paraformaldehida e incrustando en cera de parafina. Esto permite el almacenamiento a largo plazo y la sección de los tejidos. Los tejidos se cortan en secciones delgadas (5 m) utilizando un microtome y las secciones se adhieren a los portaobjetos de vidrio. Las secciones de los tejidos se pueden teñir con anticuerpos, que permiten la detección de proteínas específicas dentro de las secciones de tejido. La tinción con anticuerpos conjugados con fluoróforos (también conocidos como fluorocromos) - compuestos que emiten luz a longitudes de onda específicas cuando excitan por un láser - se conoce como inmunofluorescencia. La capacidad de detectar proteínas dentro de una sección puede proporcionar información como la heterogeneidad del tipo celular dentro del tejido, la activación de vías de señalización específicas y la expresión de biomarcadores. Dependiendo de los fluoróforos utilizados y el tipo de microscopio disponible para el análisis, se pueden utilizar múltiples colores, lo que permite el análisis multiplexado de los objetivos.
El siguiente protocolo describe los pasos básicos involucrados en la tinción de inmunofluorescencia de las secciones de tejido incrustado de parafina. Es importante tener en cuenta que este protocolo no incluirá ningún detalle sobre la fijación del tejido, el proceso de incrustación de parafina o la sección de los tejidos. Una vez que los tejidos han sido seccionados y colocados en diapositivas de vidrio, se rehidratan a través de una serie de incubaciones de etanol calificado (EtOH). Las secciones se incuban con un reactivo de bloqueo para reducir la unión no específica de anticuerpos a la sección tisular. Las secciones se incuban con un anticuerpo primario que puede o no ser etiquetado directamente con un fluoróforo. Si el anticuerpo primario no está etiquetado directamente, las secciones se incuban con un anticuerpo secundario etiquetado con un fluoróforo. Diferentes anticuerpos pueden requerir diferentes condiciones de tinción, por lo que se incluyen sugerencias para la optimización de los anticuerpos. Después del lavado para eliminar todos los anticuerpos no unidos, las diapositivas se montan con medios que contienen DAPI para etiquetar fluorescentemente el núcleo. Una vez que el medio de montaje se ha secado, las diapositivas se pueden crear imágenes utilizando un microscopio con láseres que pueden detectar los diferentes fluoróforos.
1. Configuración
- El protocolo de tinción típico implica los siguientes pasos:
- Rehidratar las secciones de tejido en las diapositivas utilizando una serie de etanoles clasificados.
- Incubar las secciones tisulares con un tampón de bloqueo, lo que ayudará a bloquear la unión no específica de anticuerpos al tejido y reducir la fluorescencia de fondo.
- Extracción del tampón de bloqueo e incubación de la sección en anticuerpo primario, momento en el que el anticuerpo unir
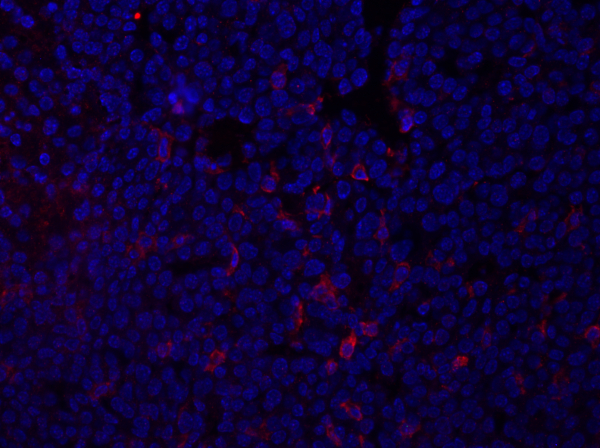
Figura 1:Tinción F4/80 de una sección tumoral mamaria. Después de la fijación, un tumor mamario del ratón fue seccionado y manchado con anti-F4/80 y montado usando un medio de montaje que contiene DAPI. La tinción se muestra mediante la mancha de superficie celular F4/80 en rojo. Hag...
La inmunofluorescencia permite la investigación de la expresión proteica y la localización en el contexto de una sección tisular. Esta técnica se puede utilizar para entender cómo los tejidos cambian en el contexto de la enfermedad mediante el examen de la localización de proteínas o el número celular en los tejidos normales y enfermos. Los cambios en la localización o en los patrones de expresión se pueden determinar y vincular a atributos específicos de los ejemplos.
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
Saltar a...
Vídeos de esta colección:

Now Playing
Microscopía de Inmunofluorescencia: Tinción de inmunofluorescencia de secciones de tejido incrustado en parafina
Immunology
52.7K Vistas

Citometría de flujo y clasificación de células activadas por fluorescencia (FACS): Aislamiento de linfocitos B esplénicos
Immunology
91.5K Vistas

Clasificación celular activada magnéticamente (MACS): Aislamiento de linfocitos T del timo
Immunology
22.2K Vistas

Ensayos ELISA: Indirecto, Sándwich y Competitivo
Immunology
233.3K Vistas

Ensayo ELISPOT: Detección de esplenocitos secretores de IFN-γ
Immunology
27.8K Vistas

Inmunohistoquímica e Inmunocitoquímica: Imágenes de tejidos a través de microscopía óptica
Immunology
77.3K Vistas

Generación de anticuerpos: Producción de anticuerpos monoclonales mediante hibridomas
Immunology
42.7K Vistas

Microscopía de Fluorescencia Confocal: Una Técnica para Determinar la Localización de Proteínas en Fibroblastos de Ratón
Immunology
42.4K Vistas

Técnicas basadas en inmunoprecipitación: purificación de proteínas endógenas mediante perlas de agarosa
Immunology
86.8K Vistas

Análisis del ciclo celular: Evaluación de la proliferación de células T CD4 y CD8 después de su estimulación mediante tinción CFSE y citometría de flujo
Immunology
23.7K Vistas

Transferencia celular adoptiva: Introducción de cenocitos de un ratón donante a un ratón huésped y evaluación del éxito a través de FACS
Immunology
21.6K Vistas

Ensayo sobre la muerte celular: Ensayo de liberación de cromo de la capacidad citotóxica
Immunology
151.1K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados