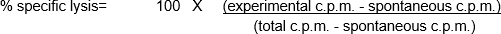Ensayo sobre la muerte celular: Ensayo de liberación de cromo de la capacidad citotóxica
Fuente: Frances V. Sjaastad1,2, Whitney Swanson2,3y Thomas S. Griffith1,2,3,4
1 Programa de Posgrado en Microbiología, Inmunología y Biología del Cáncer, Universidad de Minnesota, Minneapolis, MN 55455
2 Centro de Inmunología, Universidad de Minnesota, Minneapolis, MN 55455
3 Departamento de Urología, Universidad de Minnesota, Minneapolis, MN 55455
4 Centro De Cáncer Masónico, Universidad de Minnesota, Minneapolis, MN 55455
Una de las principales funciones de las células del sistema inmunitario es eliminar las células diana que han sido infectadas con virus o han sufrido transformación en una célula tumoral. Los ensayos in vitro para medir la capacidad citotóxica de las células inmunitarias han sido un elemento básico en los laboratorios durante muchos años. Estos ensayos se han utilizado para determinar la capacidad de las células T, células NK, o cualquier otra célula inmune para matar las células diana de una manera específica de antígeno o -no específico. Los ligandos de la muerte (por ejemplo, Fas ligando o TRAIL), las citoquinas (por ejemplo, IFNg o TNF) o gránulos citotóxicos (es decir, perforin/granzyme B) expresados por las células efectoras son algunas formas en que se puede inducir la muerte celular diana. Con la explosión en la investigación de inmunoterapia tumoral en los últimos años, hay un creciente interés en encontrar agentes para aumentar la actividad citotóxica de las células inmunitarias para mejorar los resultados del paciente. Por el contrario, algunas enfermedades se caracterizan por la actividad excesivamente exuberante de la actividad citotóxica de las células inmunitarias, lo que resulta en esfuerzos para identificar agentes para templar estas respuestas. Por lo tanto, tener un ensayo en el que el usuario puede integrar fácilmente cualquier número de diferentes células efectoras, células diana y / o modificadores de respuesta en el diseño experimental puede servir como un medio valioso de evaluar rápidamente la capacidad citotóxica de las células efectoras y / o la capacidad de respuesta de la célula objetivo.
Estos ensayos in vitro implican la mezcla de diferentes poblaciones celulares, así como el uso de un número relativamente bajo de células efectoras y dianas. Por lo tanto, una necesidad del ensayo es etiquetar las celdas de destino de una manera que pueda ser fácilmente detectada y cuantificada, permitiendo al usuario determinar el 'porcentaje específico de lisis' mediado por las células del efector. La radiactividad - especialmente, cromo 51(51Cr) en forma de Na251CrO4- es una manera económica de etiquetar rápida e inespecíficamente las proteínas celulares dentro de las células diana (1). El etiquetado corto y los tiempos totales de ensayo reducen el potencial de cambios significativos en el número y/o fenotipo de las células diana, lo que podría influir en el resultado del ensayo. Tras la pérdida de la integridad de la membrana de las células diana como resultado de la actividad citotóxica de las células efectoras, las 51proteínas celulares etiquetadas con Cr dentro de las células diana se liberan en el sobrenadante del cultivo, Cuantificación. Al igual que con cualquier ensayo que examine la función de las células inmunitarias in vitro,hay una serie de consideraciones importantes a considerar la mejora del rendimiento del experimento. Una de las características más críticas es utilizar células efectora saludable (para la máxima actividad citotóxica) y células diana (para máxima capacidad de respuesta y mínima muerte espontánea / liberación de51Cr). Se requiere contacto de células objetivo y efector (lo que lleva al uso común de placas de 96 pocillos de fondo redondo para fomentar el contacto con células celulares) (2). Por último, el análisis de datos depende de la inclusión de poblaciones de células objetivo de control positivo y negativo.
El siguiente protocolo describirá los pasos para realizar un ensayo de liberación estándar de 51Cr para medir la capacidad citotóxica de una población de células efectoras, aunque recientemente se ha desarrollado una versión no radioactiva con Europium. 51 Cr es un emisor de radiación de gran alcance. En consecuencia, el uso de este ensayo requiere un entrenamiento adecuado de seguridad de la radiación, un espacio de laboratorio dedicado, un contador gamma y la eliminación de muestras radiactivas.
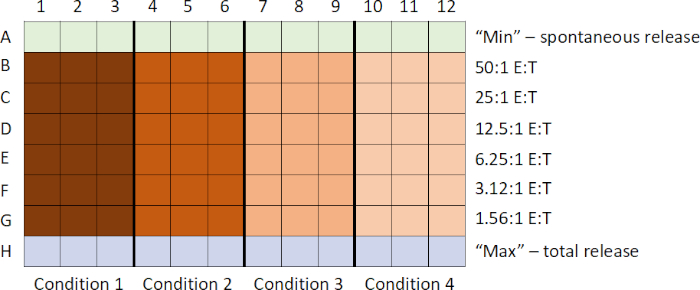
La secuencia general de eventos en este ensayo es: 1) preparar 51objetivos con etiqueta Cr; 2) preparar las células efectoray y añadir a la placa mientras las células objetivo están etiquetando; 3) añadir objetivos etiquetados a la placa; 4) placa de incubación; 5) cosechar supernatantes; y 6) analizar los datos después de ejecutar muestras en el mostrador. Las muestras se preparan comúnmente en triplicado, y luego se promedian para tener en cuenta cualquier diferencia sutil de pipeteo.
El EPP adecuado es importante para este ensayo. Específicamente, el usuario debe usar una capa de laboratorio y guantes. Es posible que se requieran gafas de seguridad en función del laboratorio o la institución. Debe haber un amplio blindaje de plomo para el almacenamiento seguro y el uso de la 51Cr durante todos los pasos. Por último, debe haber espacio de laboratorio dedicado y equipo reservado para el uso de 51Cr, incluyendo toda la señalización adecuada para indicar dónde se guardan muestras con 51Cr y un contador Geiger equipado con sonda gamma para inspeccionar el espacio para Contaminación.
En este ejercicio de laboratorio, determinaremos la capacidad de las células mononucleares de sangre periférica humana (PPBCM), (CpG estimulado frente a no estimulado) para matar las células del melanoma, utilizando la línea celular de melanoma humano WM793 como modelo y el ensayo de liberación de cromo.
Descripción general del procedimiento
El típico ensayo de liberación de 51Cr para medir la muerte celular implica los siguientes pasos:
- En primer lugar, las celdas de destino se etiquetan con Na2[51Cr]O4. Esto los distingue de las células efectoras en el ensayo.
- Mientras que las células diana están etiquetando, las células efectoras se recogen y, utilizando la técnica de dilución en serie, se genera una valoración
En este ejemplo, las células efectoras estimuladas con CpG (Figura 1, círculos negros)mataron las células diana de manera más efectiva, a medida que aumentaba la proporción de células efectoras con las células objetivo. Este aumento no se observó en los PASTRO no estimulados(círculos blancos),lo que indica que la estimulación del CpG es necesaria para el aumento observado de la lisis de las células diana.
El ensayo descrito aquí tiene una flexibilidad considerable, ya que se puede utilizar una variedad de células efector y diana dependiendo de la pregunta que se haga. Por ejemplo, la especificidad de las células efectoras se puede determinar mediante el uso de diferentes células diana o el mecanismo de muerte de células efectoras se puede determinar mediante el uso de células deficientes en proteínas específicas o el uso de inhibidores específicos de proteínas. Un problema importante con el ensayo de liberación...
- Brunner, K. T., Mauel, J., Cerottini, J. C. and Chapuis. B. Quantitative assay of the lytic action of immune lymphoid cells on 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology, 14 (2):181-196, (1968).
- Kemp, T. J., B. D. Elzey, and T. S. Griffith. Plasmacytoid dendritic cell-derived IFN-alpha induces TNF-related apoptosis-inducing ligand/Apo-2L-mediated antitumor activity by human monocytes following CpG oligodeoxynucleotide stimulation. The Journal of Immunology, 171 (1): 212-218, (2003).
Saltar a...
Vídeos de esta colección:

Now Playing
Ensayo sobre la muerte celular: Ensayo de liberación de cromo de la capacidad citotóxica
Immunology
151.1K Vistas

Citometría de flujo y clasificación de células activadas por fluorescencia (FACS): Aislamiento de linfocitos B esplénicos
Immunology
91.5K Vistas

Clasificación celular activada magnéticamente (MACS): Aislamiento de linfocitos T del timo
Immunology
22.2K Vistas

Ensayos ELISA: Indirecto, Sándwich y Competitivo
Immunology
233.3K Vistas

Ensayo ELISPOT: Detección de esplenocitos secretores de IFN-γ
Immunology
27.8K Vistas

Inmunohistoquímica e Inmunocitoquímica: Imágenes de tejidos a través de microscopía óptica
Immunology
77.3K Vistas

Generación de anticuerpos: Producción de anticuerpos monoclonales mediante hibridomas
Immunology
42.7K Vistas

Microscopía de Inmunofluorescencia: Tinción de inmunofluorescencia de secciones de tejido incrustado en parafina
Immunology
52.7K Vistas

Microscopía de Fluorescencia Confocal: Una Técnica para Determinar la Localización de Proteínas en Fibroblastos de Ratón
Immunology
42.4K Vistas

Técnicas basadas en inmunoprecipitación: purificación de proteínas endógenas mediante perlas de agarosa
Immunology
86.8K Vistas

Análisis del ciclo celular: Evaluación de la proliferación de células T CD4 y CD8 después de su estimulación mediante tinción CFSE y citometría de flujo
Immunology
23.7K Vistas

Transferencia celular adoptiva: Introducción de cenocitos de un ratón donante a un ratón huésped y evaluación del éxito a través de FACS
Immunology
21.6K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados