12.11 : Osmose et pression osmotique des solutions
Un certain nombre de matériaux naturels et synthétiques présentent une perméation sélective, ce qui signifie que seules des molécules ou des ions d'une certaine taille, forme, polarité, charge, etc., sont capables de traverser (pénétrer) le matériau. Les membranes cellulaires biologiques fournissent des exemples élégants de perméation sélective dans la nature, tandis que les tubes de dialyse utilisés pour éliminer les déchets métaboliques du sang sont un exemple technologique plus simpliste. Peu importe la façon dont ils peuvent être fabriqués, ces matériaux sont généralement appelés des membranes semi-perméables.
Prenons l'exemple d'un appareil en forme de U, dans lequel des échantillons de solvant pur et une solution sont séparés par une membrane que seules les molécules de solvant peuvent traverser. Les molécules de solvant se diffusent à travers la membrane dans les deux sens. Étant donné que la concentration de solvant est plus élevée dans le solvant pur que dans la solution, ces molécules se diffusent à partir du côté de la membrane où se trouve le solvant vers le côté de la solution à une vitesse plus rapide qu'elles ne le font dans le sens inverse. Le résultat est un transfert net de molécules de solvant à partir du solvant pur vers la solution. Le transfert par la diffusion de molécules de solvant à travers une membrane semi-perméable est un processus connu sous le nom d'osmose.
Lorsque l'osmose est réalisée dans un appareil décrit ci-dessus, le volume de la solution augmente au fur et à mesure qu'elle est diluée par l'accumulation de solvant. Cela entraîne l'élévation du niveau de la solution, augmentant sa pression hydrostatique (en raison du poids de la colonne de la solution dans le tube) et entraînant un transfert plus rapide des molécules de solvant vers le côté du solvant pur. Lorsque la pression atteint une valeur qui produit une vitesse de transfert inverse du solvant égale à la vitesse d'osmose, le transfert global du solvant cesse. Cette pression est appelée la pression osmotique (Π) de la solution. La pression osmotique d'une solution diluée est liée à la molarité de son soluté, M, et à sa température absolue, T, selon l'équation
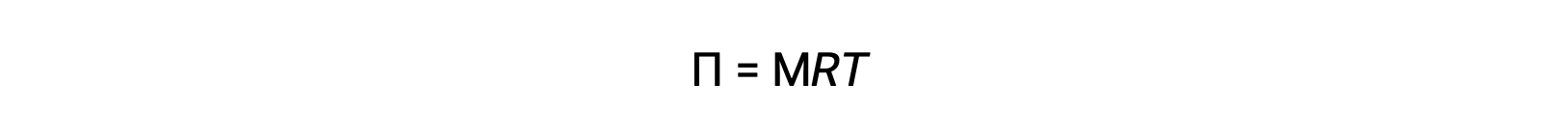
où R est la constante universelle des gaz.
Si une solution est placée dans un tel appareil, l'application d'une pression supérieure à la pression osmotique de la solution inverse l'osmose et pousse les molécules de solvant de la solution dans le solvant pur. Cette technique d'osmose inverse est utilisée pour la désalinisation à grande échelle de l'eau de mer et à plus petite échelle pour produire de l'eau du robinet très pure destinée à la consommation d'eau.
Ce texte est adapté de Openstax, Chimie 2e, Section 11.4 : Propriétés colligatives.
Du chapitre 12:

Now Playing
12.11 : Osmose et pression osmotique des solutions
Solutions et colloïdes
39.0K Vues

12.1 : Formation de la solution
Solutions et colloïdes
31.2K Vues

12.2 : Forces intermoléculaires dans les solutions
Solutions et colloïdes
33.0K Vues

12.3 : Enthalpie de solution
Solutions et colloïdes
24.7K Vues

12.4 : Solutions aqueuses et enthalpie d'hydratation
Solutions et colloïdes
14.3K Vues

12.5 : Équilibre et saturation de la solution
Solutions et colloïdes
18.4K Vues

12.6 : Propriétés physiques affectant la solubilité
Solutions et colloïdes
22.4K Vues

12.7 : Exprimer la concentration d'une solution
Solutions et colloïdes
58.2K Vues

12.8 : Abaissement de la pression de vapeur saturante
Solutions et colloïdes
26.0K Vues

12.9 : Solutions idéales
Solutions et colloïdes
19.1K Vues

12.10 : La loi de l'ébulliométrie et la loi de la cryométrie
Solutions et colloïdes
34.1K Vues

12.12 : Électrolytes : facteur de van 't Hoff
Solutions et colloïdes
32.8K Vues

12.13 : Colloïdes
Solutions et colloïdes
17.3K Vues