La dégradation des métaux due aux processus électrochimiques naturels est connue sous le nom de corrosion. La formation de rouille sur le fer, le ternissement de l'argent et la patine bleu-vert qui se développe sur le cuivre sont des exemples de corrosion. La corrosion implique l'oxydation des métaux. Parfois, elle est protectrice, comme dans le cas de l'oxydation du cuivre ou de l'aluminium où une couche protectrice d'oxyde métallique ou de ses dérivés se forme à la surface, protégeant le métal sous-jacent de toute oxydation ultérieure. Dans d'autres cas, la corrosion endommage le métal, comme la rouille du fer.
Réaction redox indésirable : la rouille du fer
La rouille est due à l'exposition du fer à l'oxygène et à l'eau. La formation de rouille implique la création d'une cellule galvanique à la surface du fer, ce qui entraîne la production de fer(II). Les réactions redox concernées qui se produisent dans les régions anodiques (oxydation du fer) et cathodiques (réduction de l'oxygène) formées à la surface du fer sont les suivantes :
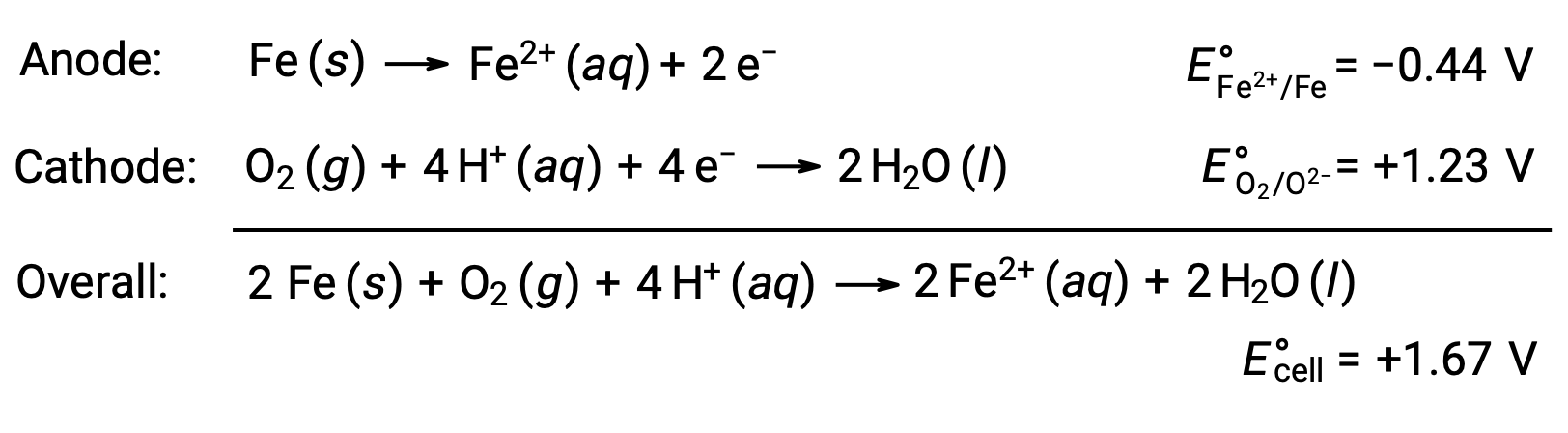
Le fer(II) réagit davantage avec l'air humide, formant un oxyde de fer(III) hydraté, qu'on appelle généralement rouille.
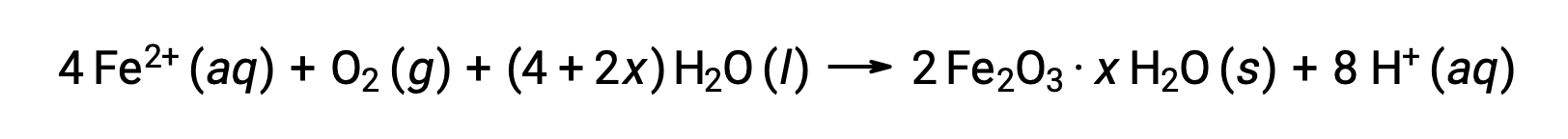
La stœchiométrie de l'hydrate varie en fonction de la quantité d'eau à laquelle le fer(II) est exposé, comme indiqué par l'utilisation de x dans la formule du composé. L'humidité, la présence d'acides et d'électrolytes augmente la vitesse de formation de la rouille. Contrairement à la patine sur le cuivre, la formation de la rouille ne crée pas de couche protectrice, et ainsi la corrosion du fer continue à mesure que la rouille s'écaille et expose à l'atmosphère du nouveau fer.
Prévention de la corrosion
Différentes méthodes peuvent être utilisées pour empêcher la corrosion. Une façon est de maintenir la surface métallique peinte pour éviter tout contact avec l'eau et l'oxygène. L'alliage des métaux, comme le mélange du fer avec de petites quantités de chrome dans l'acier inoxydable, est une autre méthode efficace pour empêcher la corrosion. Le chrome s'accumule près de la surface et subit une oxydation, ce qui par conséquent protège efficacement le fer de la corrosion.
Le fer et les autres métaux peuvent également être protégés de la corrosion par galvanisation, un procédé dans lequel le métal à protéger est recouvert d'une couche d'un métal plus facilement oxydé, généralement du zinc. Lorsque la couche de zinc est intacte, elle empêche l'air d'entrer en contact avec le fer sous-jacent et empêche ainsi la corrosion. Si la couche de zinc est percée par la corrosion ou l'abrasion mécanique, le fer peut toujours être protégé contre la corrosion par un procédé de protection cathodique, décrit dans le paragraphe suivant.
La protection cathodique utilise le principe de la conversion du métal à protéger à une cathode dans une réaction électrochimique. Pour ce faire, on connecte le métal protégé à un métal plus actif ou facilement oxydé comme le zinc ou le magnésium, connu sous le nom d'anode consommable. L'anode se corrode et est utilisée pour protéger le métal qui sert de cathode. La protection cathodique est le plus souvent utilisée dans les appareils ménagers tels que les chauffe-eau et les réservoirs souterrains de stockage d'eau. Il est important de noter que la protection cathodique peut être utilisée pour d'autres métaux que le fer.
Ce texte est adapté de OpenStax, Chimie 2e, Chapitre 17.6 : Corrosion.