Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Hétérotopique et orthotopique transplantation trachéale chez des souris utilisées comme modèles pour étudier le développement de maladies des voies respiratoires oblitérante
Dans cet article
Résumé
Cette vidéo montre et compare deux modèles expérimentaux pour étudier le développement de maladies des voies respiratoires oblitérante (OAD) chez la souris, le modèle orthotopique transplantation hétérotopique et la trachée.
Résumé
Oblitérante des voies respiratoires maladie (OAD) est la complication majeure après transplantation pulmonaire qui limite la survie à long terme (1-7).
Pour étudier la physiopathologie, le traitement et la prévention des OAD, différents modèles animaux de la transplantation de la trachée chez les rongeurs ont été développés (1-7). Ici, nous utilisons deux modèles établis de la trachée de transplantation, le modèle orthotopique et hétérotopique et démontrer leurs avantages et leurs limites.
Pour le modèle hétérotopique, la trachée donneur est enveloppé dans le grand épiploon du destinataire, alors que la trachée donateurs est anastomosée à la fin-en-bout anastomose dans le modèle orthotopique.
Dans les deux modèles, le développement des lésions histologiques oblitérante similaires à ADO clinique a été démontrée (1-7).
Cette vidéo montre comment effectuer les deux, le hétérotopique ainsi que la technique de transplantation orthotopique de la trachée chez des souris, et compare le cours du temps de développement ADO dans les deux modèles en utilisant l'histologie.
Protocole
- Homme souris Balb / C (8-12 semaines) sont achetés auprès de Charles River Laboratories (Sulzfeld, Allemagne). Les souris sont logées dans des conditions classiques, nourri des souris standard de la nourriture et eau ad libitum.
- Isofluran 2% est utilisée pour l'anesthésie.
PRÉPARATION DES DONATEURS
- Raser les poils abdominaux et désinfecter la zone en utilisant betaisodona.
- Sous vue microscopique, effectuer une incision médiane cervicale au niveau du larynx au sternum.
- Retirez la graisse sous-cutanée et les muscles sangle pour obtenir une vue claire de la trachée.
- Disséquer la trachée de tout les tissus environnants, comme l'œsophage, les nerfs, les artères et les tissus conjonctifs.
- Retirez l'ensemble trachée (à partir du larynx à la bifurcation).
- Rincer la greffe avec une solution saline froide et conserver la greffe à 4 ° C.
- Le donneur est euthanasié par dislocation cervicale après la récolte de la trachée.
DESTINATAIRE: transplantation hétérotopique
- Raser les poils abdominaux dans une large marge autour du site d'incision et de désinfecter la zone à trois reprises en utilisant betaisodona (bétadine), suivi par l'alcool. Les yeux doivent être lubrifiés avec un produit pommade ophtalmique pour éviter les cornées de s'assécher.
- Effectuer une laparotomie médiane et le lieu de l'intestin dans un stérile, gants moistured.
- Passez le grand omentum attentivement. Placez le greffon dans le centre et fixer avec une suture simple en utilisant 8-0 (Prolène, Ethicon, Allemagne).
- Couvrir entièrement la greffe avec le grand omentum et fixer la greffe avec une suture simple 8-0 (Prolène, Ethicon, Allemagne).
- Relocaliser les intestins dans l'abdomen et rincer à chaud, une solution saline stérile avant la fermeture.
- Près de 2 couches - paroi abdominale et la couche de la peau avec un motif en continu en utilisant 7-0 Prolène pour le muscle et 7-0 Vicryl pour la peau.
DESTINATAIRE: LA TRANSPLANTATION orthotopique
- Raser les poils abdominaux dans une large marge autour du site d'incision et de désinfecter la zone à trois reprises en utilisant betaisodona (bétadine), suivi par l'alcool. Les yeux doivent être lubrifiés avec un produit pommade ophtalmique pour éviter les cornées de s'assécher.
- Diviser les muscles dragonne pour visualiser l'ensemble du complexe laryngo-trachéale.
- Soigneusement disséquer la trachée des tissus environnants, prendre soin de préserver les nerfs laryngé récurrent.
- Diviser les trois anneaux trachée caudale du cricoïde. L'animal maintient la respiration physiologique via la trachéotomie.
- S'assurer que le nettoyage des bords de la trachée chez le destinataire, ainsi que dans le greffon.
- Le greffon est interposé entre les défauts bénéficiaires de la trachée et orienté à maintenir la polarité anatomique.
- En utilisant 8-0 (Prolène, Ethicon, Allemagne) s'anastomosent greffon du donneur avec le distal (médiastin) trachée. La face postérieure de l'anastomose est réalisée à la mode fonctionnement continu. La face antérieure est ensuite complétée en utilisant points séparés.
- Retirez toutes les sécrétions des voies aériennes.
- L'anastomose proximale est ensuite complétée de la même manière que celui distale.
- Assurer l'intégrité des voies aériennes et adéquate, la respiration spontanée.
- Relocaliser les muscles et fermer la sangle de tissu sous-cutané et la couche de peau en utilisant des sutures 6-0 (Vicryl, Ethicon, Allemagne) avec le modèle continu.
- Utilisez une anesthésie par injection pour le destinataire, donc l'animal conserve respiration physiologique à travers la trachée. Une combinaison de 75/1/0.2 mg / kg de propofol, du fentanyl et de la médétomidine, respectivement, est utilisée pour l'anesthésie ip chez la souris.
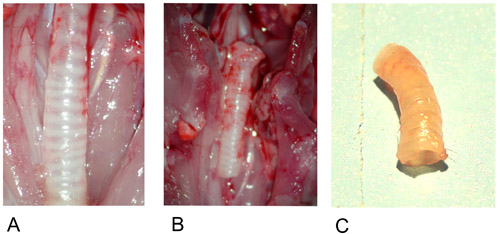
Figure 1: Donateur trachée.
1A: Donateur trachée in situ après la préparation.
1B: la trachée donateurs excisées.
1C: Donateur trachée après l'explantation.
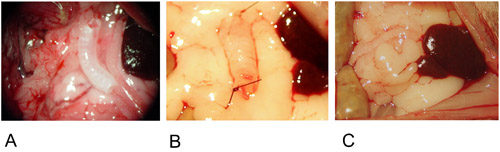
Figure 2: Modèle hétérotopique.
2A: Le greffon est positionné au centre du grand épiploon.
2B: La greffe est fixée aux deux extrémités par une suture simple.
2C: Le greffon est enveloppé dans le grand épiploon et fixé avec une suture simple.
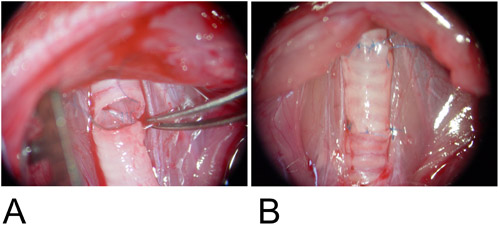
Figure 3: modèle orthotopique.
3A: Le greffon est interposé entre les bénéficiaires de la trachée et les défauts de la paroi postérieure est anastomosée à la mode fonctionnement continu.
3B: La paroi antérieure est terminée à l'aide d'une suture simple.
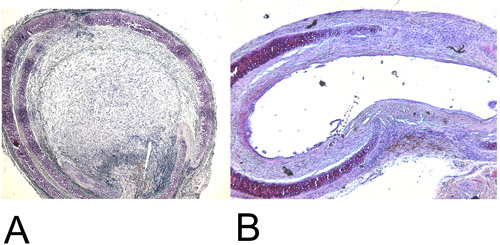
Figure 4: Histologie.
4A: Réformé trachée hétérotopique transplanté après 28 jours dans la sta H + EMINIER (15x). Notez l'effacement de 100% luminal.
4B: Réformé orthotopique trachée transplantée après 60 jours dans la coloration H + E (15x). Maximal anéantissement atteint luminale est d'environ 45%.
| Hétérotopique modèle de transplantation trachéale | Orthotopique modèle de transplantation trachéale | |
| Avantages | + Facile à exécuter + Effacement Luminal avec une occlusion complète des voies aériennes après 28 jours + Pas d'affection physique des animaux par ADO | Ventilation + physique de la greffe + Administration des médicaments inhalés possibles + Forte réactions immunologiques telles que la production d'anticorps IgM alloréactives + Milieu physiologique thoraciques + Trachéale-trachéale anastomose imite le contexte clinique |
| Inconvénients | - Pas de ventilation de la trachée transplantée - Aucune évaluation des agents pathogènes inhalés possibles - Inhibition de la clairance mucociliaire et les sécrétions retenues - Microenvironnement péritonéal, au lieu du milieu thoraciques | - La formation chirurgicale nécessaire - L'effacement Luminal avec l'occlusion luminale app. 45% après 60 jours - Les animaux peuvent développer des symptômes de ADO |
Tableau 1: Avantages et inconvénients de la transplantation orthotopique et hétérotopique trachéales.
Discussion
Les souris sont disponibles en différentes transgeneic et le modèle KO, et convient donc d'étudier des questions liées aux mécanistes ADO (4).
Les deux modèles de la transplantation trachéale montré dans cette vidéo peut être utilisé comme modèles fiables pour étudier le développement ADO.
Cependant, chaque modèle démontre les avantages et les limites.
La transplantation hétérotopique trachéale est facile à réaliser et ne nécessite pas...
Déclarations de divulgation
Sonja Schrepfer a reçu une subvention de recherche de la Deutsche Forschungsgemeinschaft (DFG) (SCHR992/3-1).]
Tous les animaux ont reçu des soins humains en conformité avec les Principes de protection des animaux de laboratoire, des expériences sur les animaux ont été effectuées en conformité avec les directives et règlements établis par la Société nationale pour la recherche médicale et le Guide pour les soins et l'utilisation des animaux de laboratoire publié par le National Institutes of Health (Instituts nationaux de santé de publication 85-23, révisée en 1985).
Tous les animaux ont été obtenus à partir de Charles River Laboratories (Sulzfeld, Allemagne) et ont été maintenus dans les installations de soins aux animaux de l'Hôpital universitaire Eppendorf à Hambourg. Les animaux ont reçu la norme chow et eau ad libitum.
Remerciements
Les auteurs remercient Christiane Pahrmann (Lab Manager).
Références
- Adams, B., Berry, G., Huang, X., Shorthouse, R., Brazelton, T., Morris, R. Immunosuppressive therapies for the prevention and treatment of obliterative airway disease in heterotopic rat trachea allografts. Transplantation. 69, 2260-2266 .
- Adams, B., Brazelton, T., Berry, G., Morris, R. The role of respiratory epithelium in a rat model of obliterative airway disease. Transplantation. 69, 661-665 .
- Deuse, T., Schrepfer, S., Reichenspurner, H., Hoyt, G., Fischbein, M., Robbins, R., Pelletier, M. Techniques for experimental heterotopic and orthotopic tracheal transplantations – when to use which model; Transplant Immunology 17. , 255-261 (2007).
- Hele, D., Yacoub, M., Belvisi, M. The heterotopic tracheal allograft as an animal model of obliterative bronchiolitis. Respiratory Research. 2, 169-183 .
- Hertz, M., Jessurun, J., King, M., Savic, S., Murray, J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American Journal of Pathology. 142, (1993).
- McDyer, J. Human and murine obliterative bronchiolitis in transplant. Proceedings of the American Thoracic Society. 4, 37-43 .
- Schrepfer, S., Deuse, T., Hoyt, G., Sheikh, A., Hoffmann, J., Reichenspurner, H., Robbins, R., Pelletier, M. Experimental orthotopic tracheal transplantation: the stanford technique. Microsurgery. 27, 187-189 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon