Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In vivo-like organotypiques Culture Wholemount murin rétiniennes
Dans cet article
Résumé
Cet article vidéo démontre la mise en place de cultures organotypiques rétine wholemount et une procédure d'analyse des cytospin effets induits de manière exogène. Organotypiques rétine cultures wholemount imiter la In vivo La situation et faciliter considérablement l'accessibilité des rétines de souris pour les manipulations expérimentales en contournant les inconvénients de modèles animaux murins classiques.
Résumé
Ablations ciblées de gènes et l'analyse des modèles animaux est la stratégie classique pour s'inscrire fonction spécifique du gène de la rétine. Toutefois, transgéniques, la rétine spécifiques ou conditionnelle des modèles de souris KO présentent souvent létalité précoce ou qui souffrent de malformations graves, empêchant une analyse au-delà embryonnaire ou postnatale premiers stades.
Culture de cellules primaires est une alternative à étudier les effets de facteurs exogènes appliqués recombinante, la surexpression de gènes ou de siRNA inactivation génique à médiation dans un environnement contrôlé. Culture de cellules dissociées a l'avantage que les signaux endogènes atteindre les cellules cibles sont réduites, facilitant ainsi l'identification des effets exogènes déclenché après la manipulation pharmacologique. Toutefois, d'importantes interactions entre cellules sont initialement détruits par la digestion enzymatique ou de dissociation mécanique, même si réagrégées cultures retinospheroid 1 sont utilisées.
En revanche, les cultures organotypiques rétine wholemount fournir un système proche de la situation in vivo physiologiques avec des interactions neuronales et de connexions 2-5 encore préservée.
Dans cet article nous proposons une vidéo démonstration étape par étape (1) de l'établissement d'in vivo-rétinienne, comme organotypiques cultures wholemount notamment particularités dissection de l'embryon, postnatale et adulte yeux murin et (2) une procédure de dissociation et cytospin pour l'analyse des neurones l'apoptose et la prolifération des cellules rétiniennes chez échantillons entiers organotypiques, par exemple après la culture, en présence de facteurs exogène appliquée recombinantes.
Protocole
Tout le matériel et les réactifs doivent être achetés stérile ou doit être la chaleur ou stérilisé à la vapeur ou stérilisé avec de l'EtOH 70%.
Les auteurs indiquent que les expériences sur les animaux ont été effectuées en conformité avec les Communautés européennes la directive du Conseil (86/609/CEE), suivant les directives du NIH concernant les soins et l'utilisation d'animaux pour des procédures expérimentales et les règlements énoncés par le comité institutionnel soin et l'utilisation comité (IACUC) à l'Université de Duisburg-Essen (Allemagne).
Partie 1: énucléation des yeux murins de différents stades de développement
Énucléation des yeux embryonnaire
- Accouplements Temps enceintes sont mis en place et le matin du jour où un bouchon vaginal est détecté dans l'accouplement des femelles est désigné 0 jours de gestation.
- La femme enceinte est sacrifiée par dislocation cervicale lorsque le développement de l'embryon a atteint le stade désiré (ici: jour embryonnaire (E) 15) et fixé sur une cire conseil 6.
- La paroi abdominale est humidifiée avec de l'EtOH 70%, couper le long de la ligne médiane et les lambeaux cutanés sont fixés latéralement par les broches 6.
- Le uterusses sont retirés de l'abdomen, détaché et transféré dans un bécher avec du PBS froid 6.
- Les embryons sont séparés, transféré à une boîte de Pétri et paroi de l'utérus et les membranes embryonnaires sont retirés avec soin par l'utilisation de forceps 6.
- Les embryons sont tués par décapitation.
- Les yeux sont énucléés être l'utilisation de fines pinces courbes, "éplucher" les yeux de l'orbite de l'œil.
Énucléation des yeux postnatale et adulte
- Jeunes chiots sont tués par décapitation, les chiots plus âgés et les adultes par dislocation cervicale.
- Jusqu'à l'étape postnatale P15, le point de temps où les souris ouvrent leurs yeux, des fentes oculaires doivent être mécaniquement ouverte par l'utilisation de forceps et agrandi par deux coupes transversales des paupières avec des ciseaux à ressort.
- Les yeux sont énucléés à l'aide de forceps courbés, appliquant une pression sur l'orbite.
Remarque: Comme au jour postnatal 2, les os orbital sont encore cartilagineux, il est important de ne pas appliquer trop de pression tout en essayant d'enlever les yeux.
En revanche, chez les souris adultes, l'os orbital sont fermes. Ainsi, afin d'énucléer les yeux, il suffit d'appliquer une pression sur l'orbite sans agrandir les fentes oculaires à l'avance.
Partie 2: Dissection de l'embryon, postnatale et adulte rétines murin
Dissection de la rétine
- Les yeux sont placés dans une petite boîte de Petri avec du PBS stérile et les couches entourant l'œil sont éliminés sous un microscope à dissection.
- Pour enlever les couches externe de l'œil, dans les étapes post-natale et des yeux d'adulte le nerf optique doit être coupé à l'aide de ciseaux printemps ou pincé par forceps que près de la base que possible.
- Tournez les yeux, de sorte que la face arrière avec le trou où le nerf optique à l'origine résidait est face à vous. Entrez l'espace sous-rétinien, entre la rétine et l'épithélium pigmentaire avec les bouts des deux pinces très fines sur le site où le nerf optique pénétré les couches les yeux.
Remarque: Habituellement, l'épithélium pigmentaire peut être facilement identifié par sa couleur foncée. Dans certaines souches de souris mutantes - en particulier dans les animaux albinos - cette couche pigmentaire peut toutefois ne pas être de couleur et ne peuvent donc être facilement à détecter. - Retirer l'épithélium pigmentaire avec la choroïde et la sclère attachée par déchirer soigneusement de chaque côté à la fois avec une pince.
- Décollez les couches au niveau de la cornée, puis tournez la tasse de l'œil vers l'objectif et de supprimer la cornée avec l'épithélium pigmentaire, choroïde et la sclère, tout en retenant la tasse restante de la rétine par la pince d'autres.
- Saisir le vitré avec la petite lentille et tout déchirer avec une pince, garder le wholemount rétine en place avec la seconde pince.
Remarque: Lors de la dissection yeux embryonnaire, assurez-vous d'enlever complètement la forme triangulaire, en forme de tente plexus capillaire sous le corps vitré en collaboration avec le corps vitré.
Dans l'œil adulte, le corps vitré doit être saisie sur les côtés et le soin doit être pris pour ne pas percer le corps vitré avec les pointes de la pince que son contenu est visqueux et adhère à la pince, ce qui entrave son enlèvement. - Pour la culture organotypique wholemount les coupes rétiniennes sont recueillies dans une plaque de 96 puits contenant 200 pl de milieu Eagle modifié par Dulbecco (voir ci-dessous).
Note: Entre la dissection des rétines individuels, garder la plaque de collecte de 96 puits contenant le milieu de culture dans l'incubateur que le pH du milieu de culture est déclenchée par le CO 2 via le système carbonate.
Partie 3: murins wholemount organotypiques rétiniennesla culture
- Préparez 500 ml de culture par des moyens de pondération 7,8 g de Dulbecco modifié Eagle / mélange nutritif F-12 HAM (DMEM) et 0,6 g de NaHCO 3 et de dissoudre la fois dans l'eau MiIliQ. Ajuster le pH à 7,15. Ajouter 50mg apo-transferrine, 50 pl putrescine (stock: 60mg/ml), 50 pl de sodium sélénite (stock: 52μg/ml), la progestérone (stock: 60μg/ml), et 2,5 ml gentamicine (200 mm) sous le capot. Mélanger et filtrer à travers un filtre bouchon de bouteille. Immédiatement avant l'utilisation de la glutamine ajouter 10 ul (200 mm) par un milieu de culture ml.
Note: Ce milieu sans sérum et sans insuline peuvent être conservés à 4 ° C pendant 2 semaines et utilisé pour des expériences induction de l'apoptose que l'insuline ne contrecarre les effets. Si l'incubation des échantillons entiers pendant plus de 24h est désirée et les taux de mort cellulaire ne seront pas évalués, le taux sérique d'insuline (par exemple sérum de veau foetal; FCS) ou les suppléments doivent être ajoutés pour améliorer les taux de survie. - Avant de commencer la culture, les échantillons entiers rétiniens sont pré-incubées pendant 15 min à 37 ° C avec 200 pi au chaud, au pH équilibré DMEM contenant hyaluronidase 0.5mg/ml de pré-digérer les hyaluronidase contenant intérieur et extérieur de la membrane limitante M ller glie cellules, facilitant la pénétration des substances appliquées de manière exogène.
- Rétines sont transférés à une plaque de 24 puits avec comme hyaluronidase peu que possible et cultivée que dans les échantillons entiers organotypiques 2ml milieu chimiquement défini Eagle modifié par Dulbecco.
Remarque: Pour transférer les rétines, l'utilisation d'une pipette de 1 ml et couper l'extrémité de la pipette quelques millimètres à élargir l'ouverture. Pour les yeux embryonnaire, une astuce 200 pipettes ul est suffisante. Les arêtes de coupe doivent être blanchis par l'insertion et la torsion d'une seconde extrémité de la pipette.
Pour 24-48 heures court terme les cultures, toutes les étapes peuvent être réalisées sur le banc, mais si la contamination des cultures se révèle être un problème, on doit travailler sous le capot. - Les cultures sont maintenues pendant 24 - 48 h à 37 ° C dans une atmosphère de CO 2 par exemple, 5% et soumis à un traitement pharmacologique avec des facteurs recombinants.
Partie 4: Dissociation des échantillons entiers cultivés rétiniennes
- Après le temps de culture souhaitée, rétines sont collectés dans des tubes Eppendorf 2 ml à fond rond contenant 850 ul de PBS et 50 ul d'albumine sérique bovine (BSA; 30 mg / ml).
- Placer les tubes Eppendorf avec rétines dans un bloc de chauffage, chauffer à 37 ° C.
- Ajouter 25 ul de la collagénase (200 U / ml) et 25 ul hyaluronidase (20mg/ml) dans chaque tube Eppendorf et commencer à dissocier les rétines en suspension seule cellule par 3 passe à travers une pipette Pasteur siliconée.
- Ajouter 10 ul de trypsine (1mg/ml), attendre 3-5 minutes, puis lentement la pipette 3-5 fois monter et descendre avec une pipette Pasteur siliconée mécaniquement dissocient le tissu.
- Ajouter 10 ul de DNase I (5mg/ml), encore une fois d'attendre pendant 3-5 min, puis lentement la pipette 3-5 fois monter et descendre avec siliconé pipette Pasteur.
Remarque: Le temps d'incubation de la dissociation enzymatique varie et dépend de la taille des yeux et du stade de développement, respectivement. Vérifiez la phase de digestion enzymatique du tissu par un léger pipetage de haut en bas. - Si la suspension de cellules n'est pas homogène maintenant mais contient encore des agrégats de cellules grandes, ajoutez supplémentaire de 10 trypsine ul et 10 ul de DNase I.
- Lorsque la suspension cellulaire est homogène, la digestion du tissu est arrêtée par addition de 10 ul d'EDTA (0,5 M), des tubes Eppendorf sont retirés du radiateur et les suspensions cellulaires sont fixés pour 1h par addition de 1ml frais, glaces paraformaldéhyde 8% à froid (PFA) à température ambiante sur un agitateur de rotation.
Partie 5: Lavage des suspensions de cellules dissociées
- La suspension cellulaire est centrifugée 5 min à 4 ° C et à 0,2 fcr dans une centrifugeuse de refroidissement.
- Le surnageant est écarté et le culot est remis en suspension dans 1ml de PBS contenant de la BSA 3mg/ml.
- Après avoir répété ces étapes deux lavages, le culot est finalement remis en suspension dans 500 ul de PBS contenant de la BSA 3mg/ml, 5mM EDTA et de l'azide de sodium à 0,1%.
Remarque: L'addition d'acide de sodium permettent le stockage de la suspension cellulaire pendant plusieurs jours à 4 ° C. Toutefois, si un marquage immunocytochimique suivront, ne pas ajouter d'acide de sodium dans le tampon de resuspension, car cela entraîne une perte de qualité de la coloration.
Partie 6: Cytospin des suspensions cellulaires de l'apoptose et l'analyse quantitative de prolifération
- Une lame de microscope dépolies-end, un filtre cytospin avec un ou deux trous et d'un entonnoir cytospin sont insérés dans un clip glisser cytospin. Le clip clapet coulissant est fermé et placé dans le rotor cytospin.
- La suspension de cellules dissociées est homogénéisé par pipetage doucement de haut en bas.
Remarque: Selon le stade de développement de la rétine, la suspension cellulaire de la procédure de dissociation peut être nécessaire deêtre diluée avec du PBS pour obtenir un nombre fini de cellules. - Une aliquote (100 pi) de la suspension cellulaire est appliqué à un entonnoir cytospin.
Remarque: Lorsque le pipetage de la suspension cellulaire à l'entonnoir, l'extrémité de la pipette devrait atteindre tout le chemin vers le fond de l'entonnoir. Il est important de ne pas pousser à travers le deuxième point de poussée de la pipette car cela crée des bulles d'air, qui sera visible dans la tache de cellules après la cytospin et entrave comptages cellulaires. - La suspension cellulaire est déposée sur une lame à 700 rpm pendant 7 min.
- Pour la détermination de l'effet de facteurs exogènes appliqués sur les niveaux apoptose des cellules peut être teinté avec 4 ',6-diamidino-2-phénylindole (DAPI; 2μg/ml), monté avec fluorescentes milieu de montage. Les changements dans l'apoptose des cellules peut être déterminé en comptant au moins 1000 cellules (comprenant au moins 10 noyaux pycnotiques) dans les spots de cellules cytospin et le taux de mort cellulaire est calculée en pourcentage du nombre total de cellules compte 3,4.
Note: Alternativement, la répartition des noyaux apoptotiques peuvent être évalués dans flatmounts 3 ou cryostat sections4 des échantillons entiers de culture de la rétine par la TdT médiée étiquetage dUTP Nick fin (TUNEL). - Pour la détection de la prolifération cellulaire, BrdU (5 uM) peuvent être ajoutés 6h avant la fin de la culture et l'incorporation de BrdU visualisées dans cytospins d'homogénats de cellules par coloration immunocytochimique utilisant un anticorps anti-BrdU (par exemple les études de développement de la Banque d'hybridome, Iowa, USA).
- L'effet du traitement sur les différents types de cellules rétiniennes peuvent être visualisées dans cytospins par les anticorps spécifiques comme Brn3a neurone (marqueur des cellules ganglionnaires) ou opsine (photorécepteur marqueur) et une contre-coloration au DAPI.
Partie 7: Résultats Représentant
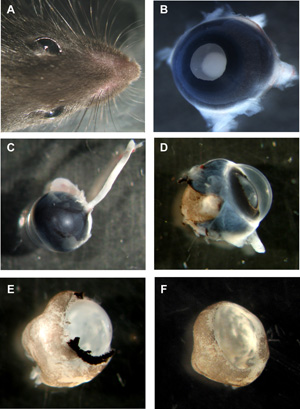
Figure 1: Étapes de préparation des échantillons entiers murin organotypiques rétiniennes
Un chef de la souris avec les deux yeux. B murins avec des yeux jusqu'à côté de l'objectif, toutes les couches encore en place. Oculaire C murin de l'arrière avec le nerf optique encore attaché. D oeil murins avec la sclère et l'épithélium pigmentaire partiellement enlevé. E rétine murine avec l'épithélium cornée, la sclère et pigment complètement enlevée, mais l'objectif et vitreux toujours en place. F murin tasse de rétine wholemount avec lentille et vitreux enlevé. S'il vous plaît cliquez ici pour voir une version agrandie de la figure 1.
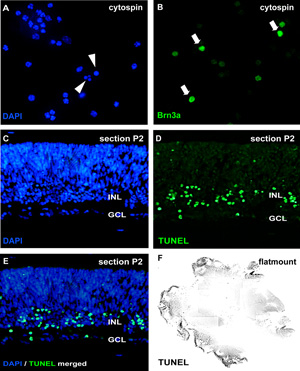
Figure 2: Analyse des cultures organotypiques rétine wholemount par cytospin et les sections
Pour l'analyse de l'apoptose, cytospins de suspensions cellulaires dissociées sont colorés par le DAPI et des noyaux pycnotiques peuvent être distingués par la fragmentation nucléaire ou condensation de la chromatine (pointes de flèches en A). Alternativement, les articles wholemount (CE; jour rétine murin postnatal (P) 2) ou flatmount rétiniennes (F) peut être soumis à un essai TUNEL et contre-colorées avec du DAPI (E). L'effet du traitement sur les différents types de cellules rétiniennes peuvent être visualisées dans cytospins par les anticorps spécifiques des neurones comme le marqueur de cellules ganglionnaires Brn3a (flèches en B) GCL, couche des cellules ganglionnaires;. INL, prospective couche nucléaire interne. S'il vous plaît cliquez ici pour voir une version agrandie de la figure 2.
Discussion
L'avantage de 2-5 murin organotypiques rétine cultures wholemount plus de dissociation, monocouche, retinospheroid ou ré-agrégées 3D cultures sphéroïde 1 réside dans la préservation des interactions neuronales et de connexions, imitant la situation in vivo. En comparaison avec les anciens rapports 2, notre article vidéo fournit une démonstration détaillée des particularités de l'énucléation des yeux murin et la dissection des rétines de différen...
Remerciements
Les auteurs tiennent à remercier E. de la Rosa et AI Valenciano de l'aide initiale avec la mise en place des cultures organotypiques et U. Laub et U. Gerster d'assistance technique.
matériels
| Name | Company | Catalog Number | Comments | |
| Mice | Animal | Charles River Laboratories | ||
| Dissection microscope | Tool | Carl Zeiss, Inc. | ||
| PBS | Reagent | Sigma-Aldrich | PBS should be cold (> 4°C) and sterile | |
| Dulbecco`s modified eagle`s medium / nutrient mixture F-12 Ham | Reagent | Sigma-Aldrich | D 8900 | DMEM / F-12 |
| Apo-transferin | Reagent | Sigma-Aldrich | T 1147 | |
| Putrescin | Reagent | Sigma-Aldrich | P 5780 | |
| Sodium selenite | Reagent | Sigma-Aldrich | S 9133 | |
| Progesterone | Reagent | Sigma-Aldrich | P 6149 | |
| Gentamicine | Reagent | Invitrogen | ||
| L-Glutamine | Reagent | Invitrogen | 25030-024 | 200 mM (100X), liquid |
| Bovine serum albumine (BSA) | Reagent | Carl Roth Gmbh | 8076.3 | 30 mg/ml |
| Collagenase | Reagent | Sigma-Aldrich | C 0773 | 200 U/ml |
| Trypsin | Reagent | Sigma-Aldrich | T4799 | From porcine pancreas; 1 mg/ml |
| Hyaluronidase | Reagent | Sigma-Aldrich | H 3884 | 200 mg/ml |
| DNase I | Reagent | Roche Group | 1 284 932 | 10 mg/ml |
| EDTA | Reagent | Sigma-Aldrich | E 6511 | |
| Silicone solution | Reagent | SERVA Electrophoresis | 35130 | |
| Paraformaldehyde (PFA) | Reagent | Sigma-Aldrich | P6148 | 8% PFA in 0.1M phosphate buffer (pH 7.4). |
| 4’,6-diamidino-2-phenylindole dihydrochloride | Reagent | Sigma-Aldrich | D 0542 | DAPI |
| Fluorescent Mounting Medium | Reagent | Dako | S3023 | |
| BrDU | Reagent | Sigma-Aldrich | B 9285 | |
| 96-well plates | Tool | Falcon BD | 3072 | |
| 24-well plates | Tool | Falcon BD | 3047 | |
| Pasteur pipettes | Tool | Brand GmbH | 747720 | |
| Forceps DUMONT #5 | Tool | Fine Science Tools | 11252-30 | bevelled very fine shanks (0.05 mm x 0.02 mm tip) |
| Forceps DUMONT #7 | Tool | Fine Science Tools | 11271-30 | curved shanks (0.07 mm x 0.10 mm tip) |
| Spring scissors,straight, 8cm | Tool | Fine Science Tools | 15000-00 | fine, small straight blades |
| Standard scissors, straight, sharp/blunt | Tool | Fine Science Tools | 14007-14 | Use for decapitation or cervical dislocation |
| Eppendorf tubes | Tool | Eppendorf | 2ml; round bottom for better precipitation of pellet during centrifugation /cytospin | |
| Cooling centrifuge | Tool | Eppendorf | ||
| Rotation shaker | Tool | CAT | ||
| Cytospin | Tool | Thermo Fisher Scientific, Inc. |
Références
- Rieke, M., Gottwald, E., Weibezahn, K. -. F., Layer, P. G. Tissue reconstruction in 3D-spheroids from rodent retina in a motion-free, bioreactor-based microstructure. Lab. Chip. 8, 2006-2213 (2008).
- Donovan, S. L., Dyer, M. A. Preparation and square wave electroporation of retinal explant cultures. Nature Protocols. 1, 2710-2718 (2006).
- Duenker, N., Valenciano, A. I., Franke, A., Hernandez-Sanchez, C., Dressel, R., Behrendt, M., de Pablo, F., Krieglstein, K., de la Rosa, E. J. Balance of pro-apoptotic transforming growth factor-beta and anti-apoptotic insulin effects in the control of cell death in the postnatal mouse retina. Eur. J. Neurosci. 22, 28-38 (2005).
- Franke, A. G., Gubbe, C., Beier, M., Duenker, N. Transforming growth factors beta and Bone morphogenetic proteins: Cooperative players in chick and murine programmed retinal cell death. J. Comp. Neurol. 495, 263-278 (2005).
- de la Rosa, E. J., Díaz, B., De Pablo, F. Organoculture of the chick embryonic neuroretina. Curr. Top. Dev. Biol. 36, 133-144 (1998).
- Dohle, D. S., Pasa, S. D., Gustmann, S., Laub, M., Wissler, J. H., Jennissen, H. P., Duenker, N. Chick ex ovo culture and ex ovo CAM assay: How it really works. J Vis Exp. 32, (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon