Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure des coefficients de diffusion par deux photons de récupération de fluorescence après photoblanchiment
Dans cet article
Résumé
Dans cet article nous allons décrire la procédure de mesure de coefficients de diffusion multi-photons en utilisant la récupération de fluorescence après photoblanchiment. Nous allons commencer par aligner le laser le long du chemin optique à l'échantillon et la détermination des paramètres expérimentaux appropriés, puis continuer à générer et enfin l'ajustement de courbes de recouvrement de fluorescence.
Résumé
Multi-fluorescence après photoblanchiment de récupération est une technique de microscopie utilisée pour mesurer le coefficient de diffusion (ou les paramètres de transport analogues) des macromolécules, et peut être appliqué à la fois
Protocole
1. Aligner le système optique.
L'équipement clé pour une expérience MP-FRAP comprennent: un mode bloqué source laser, cellule de Pockels (pour le faisceau de modulation), générateur d'impulsions, dichroïques, objectif, émission de fluorescence du filtre, tube photomultiplicateur fermée, et un système d'enregistrement des données (photon contre et multicanaux scaler).
2. Déterminer les pouvoirs de surveiller en toute sécurité.
- Atténuer le laser à un faible, mais raisonnable, le pouvoir de générer la fluorescence dans l'échantillon.
- Concentrer au sein de l'échantillon.
- Définissez un compteur de photons à intégrer sur une échelle de temps beaucoup plus long que la récupération de fluorescence prévu. Avec le volume focal maintenue immobile dans l'échantillon (sur notre logiciel de microscope cela est réalisé par un balayage point), d'enregistrer un nombre raisonnable de données de comptage de photons.
- Augmenter la puissance et prendre une autre série de données de comptage de photons. Répétez jusqu'à ce que l'augmentation du nombre de photons semble diminuer de façon significative par rapport à l'augmentation de puissance.
- Terrain log (chiffres de photons) en fonction de log (puissance). Un écart par rapport à une pente de deux indique blanchiment au cours de l'écran. Choisissez comme votre alimentation du moniteur une puissance qui est en dessous de ce coupé, mais qui permet un signal raisonnables par rapport au bruit.
3. Déterminer les paramètres d'entrée au générateur d'impulsions et multicanaux détartreur.
- Déterminer le dos de l'enveloppe--estimations du coefficient de diffusion et de temps de récupération basé sur la littérature et / ou l'équation de Stokes-Einstein et l'équation de diffusion.
- Réglez les valeurs des paramètres nécessaires sur le générateur d'impulsions et le zoom.
- Sur le générateur d'impulsions, régler le temps de pré-blanchiment et de l'eau de Javel. Une bonne série de règles de base est que l'eau de Javel préalable devrait être 1-2 fois plus grand que le temps de récupération moitié prévu, et le temps de l'eau de Javel doit être un dixième de la moitié du temps prévu de récupération.
- Sur le scaler, définir la largeur bin à environ une moitié de la durée de javel, et définir le nombre de bacs par enregistrement tels que le produit de la largeur de votre poubelle et les bacs sélectionnés par enregistrement est supérieure ou égale à environ un rétablissement complet attendu et pré -eau de Javel et parfois l'eau de Javel.
- Retour au générateur d'impulsions et de définir la fréquence de la séquence pre-bleach/bleach/monitor égale à une valeur juste plus petit que l'inverse du produit de l'époque largeur ben le nombre de bacs par enregistrement. *
- Enfin, définissez le nombre de dossiers / scan sur le scaler basée sur l'intensité du signal d'alimentation du moniteur à votre choix.
* Il est très important que le temps d'une séquence complète pre-bleach/bleach/monitor (1/frequency) mis sur le générateur d'impulsions est supérieur au temps de la collecte des données (ben x largeur des bacs / enregistrement) mis sur le mesureur. Si ce critère n'est pas atteint, déclenche l'eau de Javel multiples peuvent apparaître dans un dossier unique sur le mesureur.
- Réglez l'alimentation du moniteur à un niveau acceptable, préalablement déterminée. Réglez la puissance javel à 200 mW ou plus au-dessus du seuil de blanchissement déterminée lors de l'essai de surveiller le blanchiment. Ces pouvoirs sont tous deux définis comme des tensions différentes à travers le cristal PC.
- Sceau du microscope, éteindre les lumières, allumez le PMT, une numérisation point sur le logiciel de microscope, puis démarrez le générateur d'impulsions et détartreur.
- Analyser la courbe de récupération résultant en traçant la courbe et le marquage trois points importants: 1) la fluorescence pré-blanchiment, 2) la fluorescence immédiatement après l'eau de Javel, et 3) la fluorescence à la fin de la série de données. Utilisez les valeurs de fluorescence avant et immédiatement après l'eau de javel afin de mieux estimer le temps de demi-redressement.
- Avec cette estimation du temps de demi-recouvrement, utiliser les règles de base décrites précédemment pour déterminer de nouvelles valeurs pour le pré-blanchiment, eau de javel, et des durées largeur de bac. En outre, l'utilisation de la fluorescence pré-blanchiment et de fluorescence à la fin de la série de données afin de mieux estimer le temps nécessaire pour parvenir au recouvrement complet. En règle générale, les données doivent être collectées pour une période de temps qui permet la récupération complète pour être signalée pour la dernière moitié des données.
- Réglez les paramètres sur le générateur d'impulsions et détartreur, de prendre une nouvelle courbe, et continuent peaufiner les paramètres jusqu'à ce que votre courbe présente une eau de Javel et la reprise vigoureuse en douceur. Gardez à l'esprit que la durée de blanchiment peut, et doit, être réduit en dessous de la règle de base, si possible. La puissance javel peut aussi être ajustée si elle est trop peu profonde, ou trop profonde, une eau de Javel est atteint.
4. Test de la saturation d'excitation.
- Utiliser moniteur approprié et les pouvoirs eau de javel, déterminée précédemment, prendre une série de MP-FRAP courbes. Analysez chaque reprise, normalisée à la fluorescence pré-blanchiment, en utilisant le formulaire approprié mathématique et une méthode des moindres carrés non-linéaires algorithme d'ajustement (voir «Analyse des données» ci-dessous). Enregistrer la valeur ajustée de l'eau de Javel paramètre de profondeur.
- Continuez de prendre et d'analyser des séries successives de MP-FRAP courbes à des valeurs croissantes de la puissance javel.
- Log Plot (paramètre de profondeur de Javel) comme une fonction de log (puissance). Tout écart par rapport à une pente de deux indique la saturation d'excitation. Choisissez une puissance qui donne l'eau de Javel une eau de Javel forte, mais ne cause pas de saturation.
5. Continuez de prendre le MP-FRAP courbes.
- Continuez de prendre des courbes, comme ci-dessus, seront tous les paramètres correctement réglés.
6. Analyse des données.
- Supprimez les données pré-blanchiment et de l'eau de Javel à partir des données de fluorescence définir et ajuster les données de temps tel que t = 0 correspond à la valeur de fluorescence immédiatement après l'eau de Javel.
- Normaliser la récupération de fluorescence résultant par rapport à la moyenne pré-blanchiment par fluorescence.
- Monter la courbe normalisée en utilisant le modèle mathématique appropriée et d'un algorithme non-linéaire des moindres, des carrés de montage, telles que la fonction lsqcurvefit dans MATLAB. Le modèle présenté ici représente recouvrements de fluorescence à la fois influencé par la diffusion et le flux de convection:
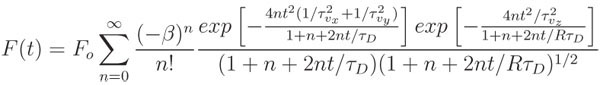
où F o est la fluorescence pré-blanchiment moyenne, β est le paramètre de profondeur de l'eau de Javel, τ D est la caractéristique de temps de récupération diffusif, R est le rapport du carré de l'axiale (w z) radiale (r w) largeurs de la deux photons volume focal, τ vx = w r / v x, τ vy = w r / v y, τ vz = w z / v z et v 2 = v x 2 + v y 2 + z 2 v est la vitesse de l'écoulement convectif. Pour un écoulement limité au plan d'imagerie, τ → ∞ vz et 1 / τ vx + 1 / τ vy peut être remplacé par une vr / τ. En l'absence d'écoulement convectif, les deux exponentielles dans le numérateur passer à 1 et l'expression est fortement réduite, à seulement deux paramètres d'ajustement, β et τ D. Le coefficient de diffusion est facilement calculé comme D = w D r 2 / 8τ.
7. Des résultats représentatifs.
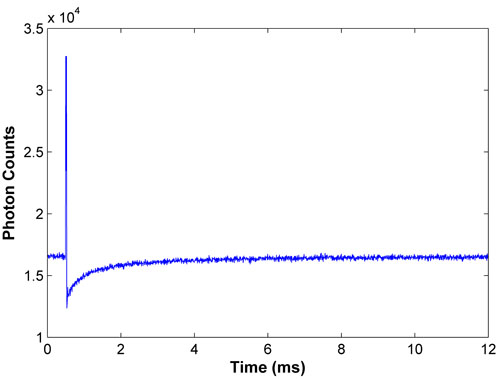
Figure 1. Javel et la courbe représentant la récupération pour FITC-BSA. Une courbe présente une bonne récupération eau de Javel et la reprise vigoureuse en douceur, avec la fluorescence à la récupération complète étant signalée pour la dernière moitié des données.
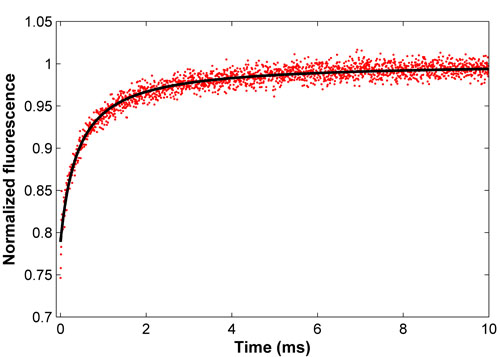
Figure 2. Courbe de rétablissement normalisé pour FITC-BSA (rouge) et l'associé des moindres carrés (en noir). Cet ajustement donne un coefficient de diffusion de 52,9 UM2 / s, compatible avec la littérature.
Discussion
La puissance du multi-photons de recouvrement de fluorescence après photoblanchiment réside dans sa capacité à sonder des échantillons épais avec une résolution 3D. Depuis son développement dans les années 1990, MP-FRAP a été utilisée pour déterminer le coefficient de diffusion (ou les paramètres de transport analogue) dans les corps cellulaires, ex vivo des tissus tranches épaisses, et dans les tissus in vivo et l'interstitium. Dans cet article, nous avons présenté l'...
Remerciements
Ce travail a été financé par un ministère de la Défense de l'ère Scholar Award Espoir (n ° W81XWH-05-0396) et chercheur au Pew le Prix des sciences biomédicales à Edward B. III Brown.
matériels
| Name | Company | Catalog Number | Comments |
| Ti:sapphire laser | Newport Corp. | Mai Tai | |
| Pockels Cell | Conoptics | 350-80 | |
| Laser Scanning Microscope | Olympus Corporation | Fluoview | |
| Short pass dichroic mirror | Chroma Technology Corp. | 670 DCSX-2P | |
| Photomultiplier tube | Hamamatsu Corp. | HC125-02 | |
| Photon counter | Stanford Research Systems | SR 400 | |
| Multi-channel scaler/averager | Stanford Research Systems | SR 430 | |
| Pulse Generator | Stanford Research Systems | DG 535 | |
| FITC-BSA | Invitrogen | -- |
Références
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Biophys J. 60, 73-76 (1990).
- Brown, E. B., Wu, E. S., Zipfel, W., Webb, W. W. Measurement of molecular diffusion in solution by multiphoton fluorescence photobleaching recovery. Biophys J. 77, 2837-2849 (1999).
- Sullivan, K. D., Sipprell, W. H. B. r. o. w. n., Jr, E. B., Brown, E. B. Improved model of fluorescence recovery expands the application of multiphoton fluorescence recover after photobleaching in vivo. Biophys J. 96, 5082-5094 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon