Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En direct de l'imagerie Drosophila melanogaster Migrations hémocytaires embryonnaires
Dans cet article
Résumé
Hémocytes drosophile se dispersent sur l'ensemble de l'embryon en développement. Ce protocole démontre comment monter et à l'image de ces migrations à partir d'embryons avec les hémocytes marqués par fluorescence.
Résumé
Beaucoup de migration cellulaire des études utilisant l'adresse
Protocole
Préparation
- Obtenir appropriés lignes drosophile contenant une hémocytes spécifiques Gal4 conducteur (p. ex srp-Gal4 2) et un journaliste codées génétiquement fluorescent sous SAMU de contrôle (par exemple, UAS-GFP). Les mouches homozygotes pour srp-Gal4, UAS-GMA 3 ou CRQ-Gal4, UAS-GFP 4, 5 sont particulièrement utiles à des fins d'imagerie (nb GMA est la GFP fusionnée au domaine de liaison de l'actine-moésine); voir ci-dessous pour une discussion sur la gamme de Gal4 pilotes et UAS constructions disponibles (le stock Bloomington centre contient une grande variété).
- Typiquement traverse génétiques sont réalisées de telle sorte que des allèles mutants sont équilibrés avec les équilibreurs fluorescentes CTG ou TTG 6, avec Gal4 pilotes et des constructions réalisées sur le SAMU alternatives chromosomes homologues. Cela permet de sélectionner des mutants homozygotes sur la base de l'absence de CTG / TTG-associé fluorescence de la GFP (cela se fait au stade de 2.11).
- Amplifier stocks et des mouches dans une cage pose avec une plaque de gélose au jus de pomme 7. Les mouches ont besoin d'au moins deux jours pour s'acclimater à la cage, avant la pose suffisamment d'embryons commencent à être établies. En général vingt mouches de chaque sexe doit être suffisante pour générer suffisamment d'embryons pour l'imagerie, mais il convient de noter que les différentes lignes ont différents degrés de fertilité. Nous utilisons des boîtes de Pétri 55mm qui s'inscrivent dans le fond d'un récipient en plastique, percé à sa base pour laisser l'air circuler. Les moyens exacte de collecte d'embryons est sans importance, mais les timings sont essentiels afin de collecter correctement mis en scène des embryons.
- Recueillir des embryons à partir d'une plaque de gélose au jus de pomme nuit maintenue à 25 ° C ou d'une plaque chronométré. Pour ces derniers, nous permettent généralement les mouches à poser sur une plaque pré-chauffée pendant 4 heures, avant d'enlever la plaque et en le plaçant à 18 ° C pour 15-16 heures avant le montage des embryons, ce qui fournit des embryons de stade avancé du 12 au à l'étape 15 de développement. Une plaque nuit contient une plus grande diversité des stades, mais offre l'avantage de la hausse des niveaux d'expression rapporteur fluorescent dans les hémocytes due à une plus longue période de temps à 25 ° C comme le système de Gal4-SAMU est sensible à la température.
Procédure
- Déloger les embryons de la plaque de gélose au jus de pomme, en utilisant une petite quantité d'eau et un pinceau à pointe molle. Embryons délogés peuvent être vus facilement à l'œil nu.
- Transfert des embryons à un tamis cellulaire (Fisher) ou home-made panier 7 en versant l'eau sur la plaque de gélose de pomme jus dans le panier a tenu plus d'un bécher pour recueillir les eaux usées.
- Répétez l'étape 2.2 jusqu'à ce que vous êtes satisfait, vous avez suffisamment d'embryons transférés de la plaque de gélose de pomme jus.
- Lavez les embryons dans une passoire cellules / panier avec de l'eau.
- Placez la cellule filtre / panier dans le couvercle boîte de Petri de la plaque de gélose de pomme jus et ajouter assez de javel soignée de suspendre embryons dans la passoire cellules / panier.
- Suivez dechorionation des embryons sur un microscope de dissection sous fond clair: dechorionation est terminée lorsque les appendices dorsaux ont dissous, ce qui devrait se produire dans les deux minutes.
- Retirez la cellule filtre / panier contenant des embryons de l'eau de Javel et laver l'eau de Javel résiduelle avec de l'eau. Toutes les traces d'eau de Javel doit être retiré avant de procéder à l'étape 2.8. Une astuce pour déterminer si toutes les javel a été enlevée est d'éponger hors de l'eau résiduelle sur les tissus en laboratoire de couleur bleu - si il ya l'eau de Javel résiduelle de la couleur bleue sera blanchi blanc / rose.
- Blot hors de l'eau restante en utilisant des tissus en laboratoire / mediwipes appliqué à la partie inférieure de la cellule de filtre / panier.
- Placez une goutte d'eau dans un couvercle de boîte de Pétri. Avec un pinceau fin, collecter toutes les embryons dechorionated du panier d'embryons et de les remettre en suspension dans la gouttelette. Suivant sécher les embryons en aspirant l'eau à l'aide d'une micropipette ou soigneusement l'absorber avec un tissu de laboratoire / mediwipes.
- Une fois que les embryons ont été séchées, ajouter une goutte d'huile d'VOLTALEF de couvrir tous les embryons. Mettre une goutte d'huile de petite seconde à côté de la gouttelette contenant les embryons. NB nous avons été incapables de trouver un fournisseur britannique de l'huile VOLTALEF; huile d'halocarbures 700 (Sigma) peut être utilisé à la place.
- Sous un microscope de dissection fluorescentes de sélectionner convenablement organisé embryons du génotype désiré à l'aide d'une paire de pinces horlogers (numéro 5) de la gouttelette d'huile. Ces pinces doivent être repliée vers l'intérieur (figure 1) afin de ramasser les embryons sans perforer leur membrane vitelline. Transfert des embryons sélectionnés pour la gouttelette d'huile secondes. Il est important que vous soyez capables de voir hémocytes fluorescentes sur le microscope de dissection afin d'être en mesure de recueillir de bonnes images sur le microscope confocal (Figure 2). Nous généralement monter embryons au stade 13/14 à la migration des hémocytes image latérale sur la ligne médiane ventrale ou le stade de 15 embryonsà l'image de la motilité des hémocytes après dispersion sur l'embryon.
- Bâton à deux lamelles (18x18mm, épaisseur 1) à la partie inférieure d'un plat Petriperm / Lumox (Sarstedt), en utilisant deux petites gouttes d'huile VOLTALEF, laissant environ 1 cm entre eux (figure 3); ils seront utilisés pour soutenir une lamelle placée au-dessus les embryons, afin de ne pas les écraser. Petriperm plats (diamètre 50mm) contiennent un revêtement hydrophobe, perméable aux gaz à membrane. Nous constatons que les plats deviennent plus faciles à utiliser une fois qu'ils ont été utilisés à plusieurs reprises (les plats peuvent être essuyés avec 70% d'éthanol et réutilisées).
- Sous fond clair sur le microscope de dissection, ramasser des embryons sélectionnés un par un avec la pince et la ligne qui les plié face ventrale et parallèle au bord de l'lamelles (figure 3). Il est possible d'aligner jusqu'à 15 embryons de cette manière, selon votre dextérité et votre patience. Il est important de manipuler les embryons en douceur à la fois comme des embryons et la membrane plat Petriperm sont fragiles et peuvent facilement être rompu.
- Une fois que les embryons sont alignés ajouter une petite goutte d'huile et laisser répandre pour former une couche homogène entre les deux lamelles. Après le pétrole s'est répandu (cela peut prendre quelques minutes) vérifier que les embryons sont toujours face ventrale en place. Si les embryons ont roulé un peu, les repositionner à nouveau avec la pince.
- Enfin, en utilisant une pince à épiler (numéro 3) placer une lamelle (18x18mm, épaisseur 1) sur les embryons, reposant sur les deux lamelles préalablement adhéré. Coller cette lamelle à la lamelle permet l'utilisation de vernis à ongles (figure 3).
- Prenez le plat avec des embryons Petriperm monté sur le microscope confocal ou à champ large et de monter le plat Petriperm sur la scène en utilisant un adaptateur approprié. Soit un microscope droite ou inversée peut être utilisé, avec l'objectif concentrant travers la lamelle (par opposition à travers la membrane).
Résultat représentant:
Ce protocole décrit comment monter des embryons de drosophile pour l'imagerie en direct de hémocytes sur la face ventrale de l'embryon. Si fait correctement, il sera facile de générer des images fixes ou des films ou des hémocytes. Le principal déterminant est le microscope utilisé pour l'image de la hémocytes (en particulier l'objectif), mais la nature des images acquises dépendra aussi du stade de développement, la température des embryons ont été soulevées et les lignes au GAL4 et UAS utilisés.
Des niveaux élevés d'expression de protéines fluorescentes permettra hémocytes à imager avec plus de facilité, il est donc important d'être capable de voir quand les hémocytes embryons sont au stade du protocole de 2,11 (figure 2 contient des exemples de hémocytes clair dans les embryons, prises avec un appareil équipé d'un microscope à dissection). Nombre a donc augmenté de Gal4 et les constructions UAS permettre une plus grande un signal à bruit. De plus cela réduit le besoin pour des intensités laser de haute ou de temps d'exposition accrue lorsque l'imagerie, qui permet à son tour le comportement hémocytes à suivre pour de plus longues périodes.
Des niveaux très élevés d'expression de la GFP s'affichera fins détails de la morphologie des hémocytes, en particulier les fines lamelles en forme de feuilles qui entourent le corps de la cellule circulaire (figure 4A-B). Circulaire régions hors GFP représentent phagosomes (figure 4A-C). Finger-like filopodes peut aussi être vu sortant de l'lamelles (figure 4B). Deux pilotes Gal4 demeurent suffisants pour voir ces processus (figure 4C), surtout si un ou plusieurs sont srp-Gal4 (voir la discussion), mais des vitesses de balayage plus lent ou plus grande puissance laser sur le microscope confocal peut être nécessaire. Comme les niveaux d'expression diminue, il devient plus difficile à l'image des saillies d'hémocytes; néanmoins il est toujours possible de suivre la migration des hémocytes dans ces conditions que le corps cellulaire reste évident même quand saillies sont moins claires (figure 4D).
Au stades de développement précoces (jusqu'au stade 13) hémocytes migrent en contact étroit les uns aux autres et il est souvent difficile de distinguer les cellules individuelles. À la fin de l'étape 13 hémocytes ont formé une seule ligne en bas de la ligne médiane ventrale (figure 5A), puis, de plus en plus mobiles, migrer latéralement sur les bords de la corde nerveuse ventrale (figure 5B). Le cytosquelette d'actine dans les protubérances dynamique des hémocytes peuvent être directement observés à travers l'expression de la GMA (figure 5C) ou cerise moésine.
Montage des embryons de cette manière permet les échanges gazeux et prévient la déshydratation et les embryons restent viables d'imagerie suivants. Si l'embryon est endommagé lors du montage, il est généralement évident que le contenu embryon de fuite à travers sa membrane vitelline. Si un embryon ne commence à se déshydrater, cela peut souvent été vus par des déformations de la membrane vitelline. Parfois un embryon va rouler pendant le cours d'un film timelapse, mais cela a seulement tendance à être problématique pour les films plus délais. LastlY, le montage de plusieurs embryons à la fois donne l'expérimentateur les meilleures chances d'obtenir un embryon dans l'orientation idéale pour leur expérience.

Figure 1. Pinces pour la manipulation des embryons dechorionated.
Les conseils des horlogers pince (numéro 5 taille) devrait être repliée vers l'intérieur afin de façonner un outil pour ramasser les embryons comme montré ici. La surface extérieure de la région plié est également utile pour manipuler des embryons lors du positionnement sur la membrane Petriperm car ils possèdent pas de bords coupants qui pourraient percer l'embryon.
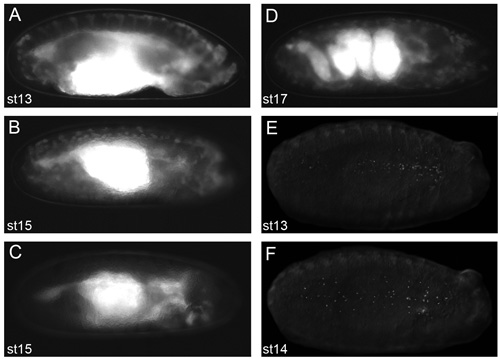
Figure 2. Des images représentant des embryons qui donneront de bons résultats d'imagerie en direct.
Images d'embryons dans l'huile dechorionated VOLTALEF (au stade du protocole de 2,11) prises sur un microscope à fluorescence de dissection. Vues latérales du stade 13 (A) et l'étape 15 (B) srp-Gal4, UAS-GFP; CRQ-Gal4, UAS-GFP embryons. Vue latérale d'une étape 15 srp-Gal4, UAS-GFP / +; CRQ-Gal4, embryon uas-GFP/uas-N17Rac (C) dans laquelle hémocytes ont échoué à migrer hors de la tête, montrant ce que les embryons ressembler quand hémocytes ne sont pas apparentes sur leurs itinéraires migratoires. Vue latérale d'un stade de 17 srp-Gal4, UAS-GFP; CRQ-Gal4, UAS-GFP embryon montrant la structure alambiquée de l'intestin à ce stade de développement (D); l'apparition de la contraction des muscles empêche imagerie en temps réel des embryons au-delà de cette stade de développement. Vues ventrale de l'étape 13 (E) et l'étape 14 (F) srp-Gal4, UAS-rouge embryons stinger montrant la dispersion des hémocytes avec des noyaux marqués par fluorescence. L'observation des hémocytes par fluorescence au stade 2.11 du protocole est une condition préalable pour obtenir d'excellentes images; antérieure est à la droite pour toutes les images.

Figure 3. Montage des embryons sur un plat Petriperm / Lumox.
Deux lamelles 18x18mm (épaisseur 1) sont collés sur la face inférieure de l'antenne Petriperm utilisant une petite goutte d'huile, séparés par environ 1cm comme indiqué. Les embryons sont ensuite alignés face ventrale avec leur axe long (antéro-postérieure) sur les bords de la lamelle et recouvert d'une petite goutte d'huile. Une fois l'huile s'est répandue pour combler l'écart entre les deux lamelles d'une lamelle tiers (épaisseur de 18x18mm 1) est placé délicatement sur le dessus des embryons recouverte de pétrole en utilisant les deux lamelles préalablement respectées comme un pont pour empêcher les embryons d'être écrasé. Cette lamelle est ensuite collée à l'aide de deux ponts lamelle deux petites gouttes de vernis à ongles. Une fois réglée, les embryons peuvent être visualisés sur un microscope à droite ou inversée avec la lentille de l'objectif se concentrant à travers la lamelle (par opposition à travers la membrane Petriperm).
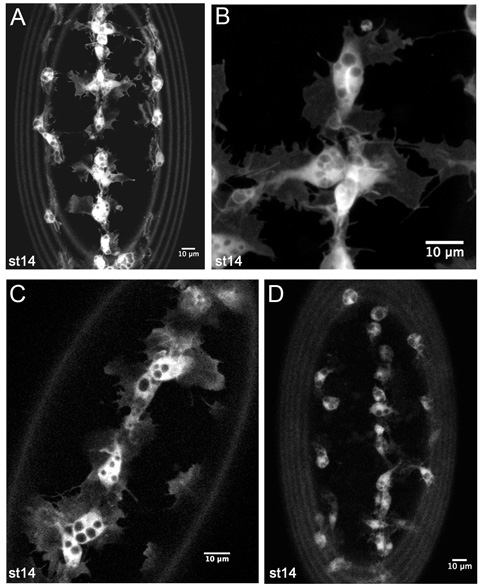
Figure 4. Les résultats représentatifs de l'imagerie en direct de hémocytes GFP étiqueté.
Z-projections d'hémocytes sur la face ventrale d'un stade de 14 srp-Gal4, UAS-GFP; CRQ-Gal4, UAS-GFP embryon (AB). (A) est une image plus faible grossissement tels que ceux utilisés pour contrôler les migrations hémocytes de développement dans les films timelapse. (B) est un grossissement plus élevé encore de hémocytes sur la ligne médiane ventrale, montrant des détails fins de leur morphologie. (C) est une simple tranche de 1 m de hémocytes sur la ligne médiane ventrale dans un stade de 14 srp-Gal4, UAS-GFP / +; CRQ-Gal4, UAS-GFP + / embryon, révélant que le nombre de copies inférieur de Gal4 pilotes et UAS les constructions sont également suffisantes pour générer de bonnes images. (D) affiche un z-projection des hémocytes dans un stade de 14 CRQ-Gal4, UAS-GFP embryon. Voici saillies hémocytes sont moins évidentes raison de la baisse d'expression de la GFP, mais il est encore possible de faire des films et de suivre la migration des hémocytes avec cette combinaison de Gal4 conducteur et UAS construire. Les images ont été prises sur un microscope confocal Leica LSM510; antérieure est en hausse dans toutes les images, les anneaux à la périphérie des images sont causés par autofluorescence membrane vitelline.

Figure 5. Les résultats représentatifs de l'imagerie en direct de hémocytes GMA exprimer.
Z-projections d'hémocytes sur la ligne médiane ventrale de l'étape 13 (A) et le stade 14 (B) srp-Gal4, UAS-GMA embryons, tirées de films timelapse pour montrer les migrations de développement des hémocytes. Des informations détaillées sur la dynamique de l'actine peuvent être obtenus par imagerie plus fort grossissement de hémocytes exprimant GMA (C). GMA est constitué de la GFP fusionnée au domaine liant l'actine des filaments d'actine moésine et des étiquettes. Antérieure est en hausse dans toutes les images, les images ont été prises sur un microscope confocal.
Discussion
Les éléments les plus importants de cette procédure sont à la sélection d'embryons sains avec hémocytes clairement étiquetés et de les monter avec soin sans les endommager. Une fois que les embryons sont des halocarbures dans l'huile ils sont résistants à la déshydratation et une fois montée peut être imagée pendant plusieurs heures. Dans nos mains, nous pouvons hémocytes d'image pendant trois heures, avec une déshydratation négligeable de l'embryon ou du photo-dommages évidents, en pre...
Remerciements
Ce protocole a été développé par notre travail au sein et en collaboration avec les laboratoires de Paul Martin et Antonio Jacinto. Nous remercions le Centre Stock Bloomington pour son excellent service et la communauté drosophile de continuer à partager les lignes voler. BS est actuellement financé par une subvention du BBSRC projet. WW est financé par une bourse du Wellcome Trust en développement de carrière.
matériels
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
Références
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon