Method Article
Exécution et traitement des FNA coussinet adipeux antérieure de l'amyloïde
Dans cet article
Erratum Notice
Résumé
L'aspiration coussinet adipeux est un préféré, approche du coût mini-invasive, et faible par rapport à d'autres méthodes pour détecter amyloïdes pour le diagnostic de l'amylose systémique. Cet article démontre la vidéo un aperçu de procédure pour effectuer une aspiration coussinet adipeux avec un traitement approprié de l'échantillon pour le résultat optimal de diagnostic.
Résumé
Historiquement, les biopsies cardiaques, hépatiques et rénales ont été réalisées pour démontrer dépôts amyloïdes dans l'amylose. Depuis la présentation clinique de cette maladie est très variable et non spécifique, les risques associés de ces biopsies sont trop importants pour le rendement diagnostique. D'autres sites qui ont un risque plus faible de biopsie, comme la peau ou la gencive, sont aussi relativement invasive et coûteuse. De plus, ces biopsies peut ne pas toujours avoir des dépôts amyloïdes suffisante pour établir un diagnostic. L'aspiration coussinet adipeux a démontré une bonne corrélation clinique à faible coût et une morbidité minimale. Cependant, il n'existe pas de protocoles normalisés pour l'exécution de cette procédure ou le traitement de l'échantillon aspiré, ce qui conduit à des résultats variables et non reproductibles. La modalité la plus fréquemment utilisée pour la détection de substance amyloïde dans les tissus est une biréfringence vert pomme sur des sections colorées à l'aide rouge Congo un microscope polarisant. Cette technique nécessite une préparation bloc cellulaire du matériel aspiré. Malheureusement, les patients présentant au stade précoce de l'amylose ont des quantités minimes de la substance amyloïde qui réduit fortement la sensibilité du rouge Congo sections colorées bloc cellulaire du aspirats coussinet adipeux. Par conséquent, l'évaluation ultrastructurale des ponctions coussinet adipeux par microscopie électronique devrait être utilisé, compte tenu de sa sensibilité accrue pour la détection de l'amyloïde. Cet article montre une méthode simple et reproductible pour réaliser l'aspiration antérieure coussinet adipeux pour la détection de la substance amyloïde utilisant à la fois coloration au rouge Congo des sections bloc cellulaire et la microscopie électronique pour l'identification ultrastructurale.
Protocole
Présentation
Amylose systémique est une maladie hautement variable qui fait référence à un dépôt extracellulaire de protéines différentes qui sont collectivement appelés amyloïdes. Le dépôt de ces fibrilles amyloïdes bêta plissée avec la configuration conduit à diverses présentations cliniques selon les organes touchés. Les manifestations les plus cliniquement pertinente de l'amylose systémique sont notés quand il ya implication des organes critiques tels que le cœur, le foie, et / ou des reins. Historiquement, ces organes impliqués seraient biopsie afin de démontrer la présence d'amyloïde. Ces procédures invasives modérément effectué un risque important, y compris l'hémorragie. L'aspiration coussinet adipeux a depuis été montré pour fournir une méthode fiable et non invasif pour la détection de la substance amyloïde dans une amylose systémique. Cette procédure est essentiellement comparable à la liposuccion de la graisse sous-cutanée dans la paroi abdominale antérieure sous anesthésie locale pour récupérer des tissus fibroadipose pour évaluer les dépôts amyloïdes peu dans les petites parois des vaisseaux sanguins 2.
La méthode la plus fréquemment utilisée pour l'identification amyloïde dans les tissus demeure le modèle caractéristique de biréfringence vert pomme vu quand Congo sections rouges tachées sont visualisées sous un microscope à lumière polarisée 3. Lorsque l'aspiration est effectuée coussinet adipeux, le Congo taches rouges qui peut être fait soit sur directes diapositives barbouillé ou préparations bloc cellulaire du tissu adipeux aspiré. Cependant, les patients à un stade précoce de l'amylose amyloïde ont peu, ce qui réduit considérablement la sensibilité de rouge Congo sections colorées bloc cellulaire 4,5. L'évaluation des ponctions ultrastructurale coussinet adipeux par microscopie électronique a une meilleure reproductibilité et la sensibilité améliorée 4. Par conséquent, il est recommandé de soumettre toutes les aspirations coussinet adipeux à la fois pour la préparation d'un bloc de cellules et pour effectuer la microscopie électronique 2.
L'aspiration coussinet adipeux est un coût relativement faible et la méthode non invasive pour l'obtention de tissus pour diagnostiquer l'amylose systémique. Cet article décrit la procédure d'aspiration pad graisses et des détails sur le traitement des échantillons à soumettre des échantillons pour à la fois coloration au rouge Congo et l'évaluation ultrastructurale par microscopie électronique. Dans cette vidéo, nous démontrons cette procédure reproductible et simple de récupérer optimale du matériel de diagnostic.
1. Exécution de la FNA du coussinet adipeux Antérieur
Anesthésie A. de la zone locale (figure 1 & 2)
- L'utilisation des tampons d'alcool ou de l'agent nettoyage de la peau préféré par une institution particulière, nettoyer la peau sur la zone quadrant inférieur de l'abdomen de la ligne médiane et en dessous de l'ombilic (figure 1).
- Marquer une zone en forme de losange d'environ 2 x 2 pouces comme le montre la figure 1 avec un marqueur.
- Aspirer à environ 10 ml de lidocaïne 1% avec une aiguille 18G. Joindre un 1 ½ aiguille 25G de pouce à la seringue. Retirer les bulles d'air en tapotant la seringue verticale tout en appuyant sur le piston jusqu'à ce liquide est distribué et aucune bulle d'air sont présents.
- Anesthetize le long des frontières de la zone en losange déjà marqué comme le montre la figure 2. Commencez par insérer l'aiguille 25G juste sous la peau au point A et poussez délicatement l'aiguille sous la peau au point X. Tirez sur le piston de la seringue afin de s'assurer que vous n'êtes pas dans un vaisseau. Puis poussez lentement le piston pour infiltrer jusqu'à 2,5 mL de lidocaïne (environ ¼ de la lidocaïne dans une seringue de 10 ml) tout en retirant l'aiguille au point A, sans laisser l'aiguille de sortir de la peau au point A (figure 2a3). Avec l'aiguille sous la peau encore changer la direction vers le point Y (Figure 2A4) et pousser l'aiguille sous la peau au point Y (figure 2b1). Comme précédemment, confirme que l'aiguille n'est pas dans un bateau et passer d'environ 2,5 mL de lidocaïne tout en retirant lentement l'aiguille à travers le point A. (Figure 2b3 2b4 travers) Répétez les étapes similaires à partir du point B et de distribution de lidocaïne sous-cutanée à partir de points B et B à X à Y (figure 2c1 2d4 travers). Prévenir les saignements de la piqûre A et B par l'application ferme des pièces de calibre stérile.
- Vous pouvez maintenant vérifier que la zone est anesthésiée en touchant légèrement la peau au sein du losange anesthésiés par la pointe / coin de pièce de gaze de coton, par comparaison avec la peau non anesthésiés adjacentes.
B. Effectuer une aspiration coussinet adipeux (Figure 3)
(Application de l'anesthésie locale avant la performance d'aspiration coussinet adipeux peuvent être contournés, en fonction des préférences régionales et individuelles. Correctement effectué la procédure pour l'aspiration FNAB pad antérieure graisse peut être complété en une seule piqûre. Cependant, selon le seuil de la douleur du patient , la manoeuvre d'aiguille 18G avant en arrière dans le tissu gras sous-cutané est relativement distreschanter. La méthode décrite anesthésie atteint ici l'effet en seulement deux piqûres avec aiguille 25G et évite la douleur avec une tolérance améliorée à la procédure.)
- Assemblez 18G 1 ½ pouces sur une aiguille de seringue de 10 ml. Monter l'ensemble seringue-aiguille dans la poignée de seringues («grip FNAB / pistolet») pour une application correcte et la libération de vide.
- Insérer la pointe de l'aiguille dans la graisse sous-cutanée dans la zone nettoyée et anesthésiés losange (figure 3a).
- Rétracter complètement le piston de la seringue avec l'aiguille insérée dans le tissu sous-cutané pour générer vide (figure 3b).
- Maintenir le vide et manœuvrer l'aiguille d'avant en arrière dans des directions différentes à la graisse sous-cutanée (figure 3c par 3i). Chaque course doit être aussi longue que possible avec la longueur de l'aiguille choisie sans laisser l'aiguille de sortir de la peau. Maximum de prélèvement est réalisé par un changement de direction à chaque coup (figure 3i). Il est important de garder la direction de l'aiguille tangentielle à la séreuse et parallèle à la surface de la peau pour éviter la perforation de la cavité péritonéale.
- Le tissu fibroadipose s'accumule dans la seringue. Une fois que suffisamment de fragments de tissus fibroadipose (jusqu'à 1 mL d'échantillon de fragments de sang riche en mixte) sont récupérés, libérer le vide complètement et enlever l'aiguille (figure 3k).
- Demander au patient ou à l'assistant appliquer une pression ferme sur le domaine de la procédure avec un tampon de gaze pour éviter une extravasation de sang.
2. Traitement des échantillons
- Placez au moins 5-6 fragments de tissu dans une solution de glutaraldéhyde fibroadipose pour la microscopie électronique (figure 4B).
- Selon le protocole institutionnel, un frottis-uns des fragments de tissus fibroadipose peuvent être préparés par les répartissant entre deux lames (figure 4A).
- Le matériel restant est mis à coaguler dans la seringue (cela peut prendre 5-7 minutes, selon le temps de coagulation) (figure 4C).
- Aspirer formol à 10% dans la seringue afin que le matériau fibroadipose coagulé tissu est délogé de la paroi de la seringue et flottant librement (Figure 4C2). Retirer le piston de la seringue (Figure 4C3) et le transfert des tissus fibroadipose coagulé dans le conteneur formol à 10% depuis l'extrémité ouverte de la seringue en face de l'extrémité de la buse (figure 4C4).
- Étiqueter les contenants adéquatement et soumettre le glutaraldéhyde pour la microscopie électronique et le formol pour la section H & E et le Congo tache rouge pour l'évaluation en polarisant la microscopie. Si les frottis sont préparés, ils peuvent être traités selon le protocole du laboratoire.
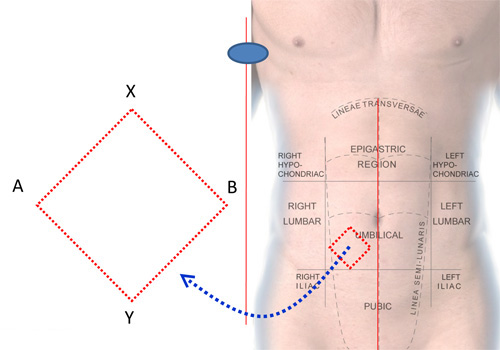
Figure 1. Zone d'être anesthésié pour la FNAB du coussinet adipeux antérieur.
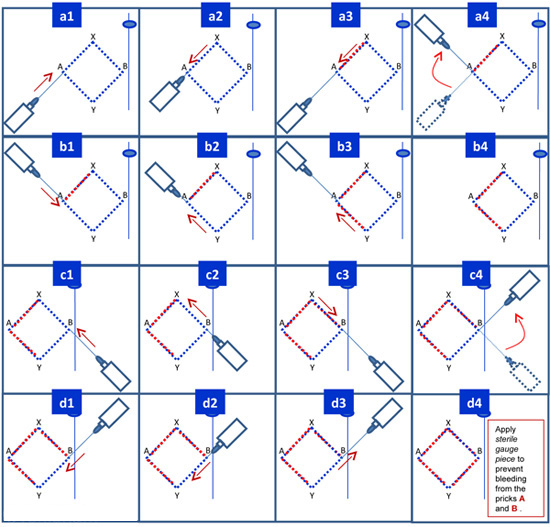
Figure 2. Anesthésie de la zone locale.
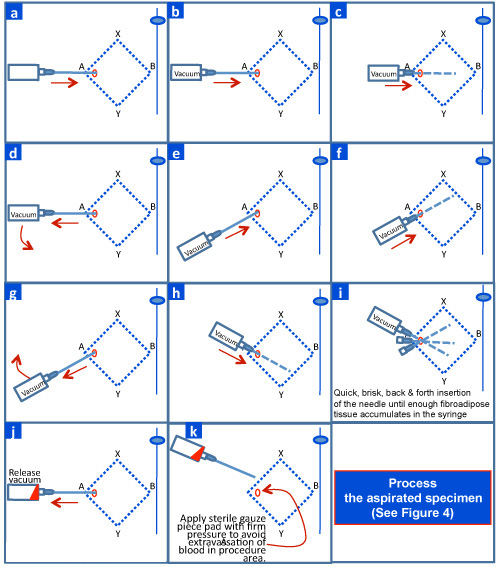
Figure 3. Exécution du coussinet adipeux FNAB antérieure.
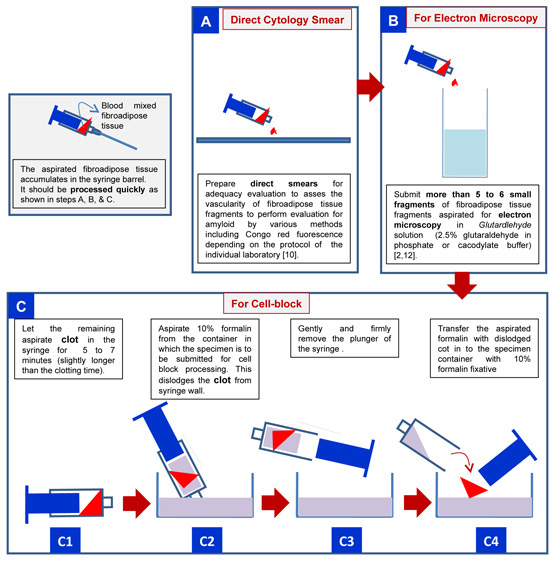
Figure 4. Traitement des coussinet adipeux antérieure aspirer à être soumis au laboratoire pour détecter des dépôts amyloïdes.
3. Les résultats représentatifs
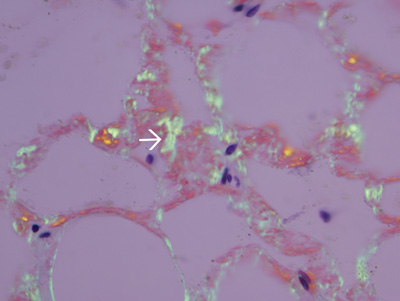
Figure 5. Amyloïdes dans la paroi des petits vaisseaux sanguins dans les fragments de tissus fibroadipose. Tissus Fibroadipose été traitées par le formol, inclus en paraffine, colorés au rouge Congo, et examinés par microscopie optique polarisant. Amyloïdes à la paroi des récipients sanguins montrent vert pomme biréfringence (flèche blanche).
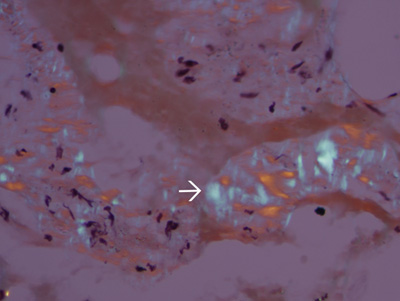
Figure 6. Tissus manquent amylose. La biréfringence vert pomme est absent dans les tissus d'un patient différent sans amylose. Bleu biréfringence (flèche blanche) des fibres de collagène, sont habituellement présents dans presque tous les spécimens.

Figure 7. Fibrilles amyloïdes dans compatible avec la paroi des vaisseaux sanguins. Micrographie électronique de droite, non-branchement, au hasard dispersées 80-10 nm de diamètre fibrilles formées par amyloïdes dans la paroi des vaisseaux sanguins.
Discussion
Diagnostic de l'amylose est généralement réalisée avec un tissu des organes touchés tels que les reins, le foie, et / ou une biopsie du cœur. Cette démarche a haut rendement diagnostique, cependant, est invasive et peut être associée à des complications, notamment une hémorragie 2. Rectale, gingivales, et des biopsies de moelle osseuse ont été préférée pour le diagnostic que l'approche relativement moins invasive dans les années 1960 6,7,8. Abdominale aspiration coussinet adipeux a été signalé en 1973 comme un coffre-fort, mini-invasive, une procédure simple et moins coûteux pour le diagnostic des tissus de l'amylose systémique 1. Toutefois, les détails de la procédure et l'approche de traitement de l'échantillon récupéré n'est pas cohérente signalés. Cette vidéo et l'article décrivent l'étape de la procédure par étape.
L'approche de détection des amyloïdes dans l'aspiration coussinet adipeux, de même, n'est également pas bien standardisés avec un peu d'études comparant et en évaluant les différentes approches 1,5,6,7,8. Évaluation des ponctions antérieure coussinet adipeux avec coloration au rouge Congo est moins sensible avec une reproductibilité interobservateurs bas surtout dans les premiers cas de l'amylose avec des dépôts amyloïdes peine 5. L'immunohistochimie réalisée sur le formol et inclus en paraffine fixés bloc cellulaire et le Congo sections fluorescence rouge réalisé sur un frottis de dépistage ont été rapportés pour améliorer la sensibilité diagnostique 9,10. La microscopie électronique améliore la détection et l'identification des fibrilles amyloïdes peu dans les petites parois des vaisseaux sanguins dans le tissu fibroadipose en gras pad aspirats 4, 5. Basé sur cette information, cet article décrit le traitement de l'échantillon à préparer des blocs de cellules (pour l'évaluation de rouge Congo sections colorées bloc cellulaire au microscope polarisant pour le diagnostic biréfringence vert pomme et aussi pour l'immunohistochimie comme indiqué) et pour la microscopie électronique. Toutefois, selon l'approche choisie pour l'évaluation de l'échantillon de l'amyloïde, il peut être soumis à la préparation du frottis cytologique, la préparation des blocs de cellules, et le traitement pour la microscopie électronique. Certains laboratoires effectuer les tests sur les frottis préparés à partir des fragments de tissus aspirés fibroadipose et colorées au rouge Congo pour étudier les 10 fluorescence.
Généralement, dans une amylose fin, la microscopie optique à la microscopie polarisante rouge Congo peut être suffisant, mais dans les stades précoces de la maladie de la coloration rouge Congo avec la microscopie polarisante sur des sections de bloc cellulaire est moins sensible et fiable pour la graisse aspire pavé 4,5,11 . Autres colorants spéciaux, y compris thioflavine T peut être utilisé avec des limitations similaires. D'autres approches pour détecter amyloïdes comprennent l'évaluation des frottis d'aspiration de l'amyloïde au rouge Congo microscope polarisant et de fluorescence 10. Dans notre expérience, cette méthode est moins reproductible. Évaluation des vaisseaux sanguins dans le coussinet adipeux de l'amyloïde par microscopie électronique permet de surmonter ces limitations 4,11. Une caractérisation plus poussée de l'amyloïde a été rapporté par microscopie immunoélectronique 12; cependant, ces méthodes peuvent ne pas être largement disponibles dans un établissement de soins non tertiaires.
Les aiguilles utilisées pour effectuer des procédures d'aspiration peuvent être classés en fonction de leurs tailles fines jauge dans (21-25G), intermédiaire (18-20G), et de grande taille (par ex-14G) 11. Antérieur aspirations coussinet adipeux ont été signalés à être réalisée en utilisant des jauges variables, allant de l'intermédiaire (18 à 20G) à l'amende (21 à 22G) 2,10. La plupart des lésions de masse sont aspirés avec des aiguilles de jauge plus fine (tels que 25G) pour obtenir un frottis de dépistage ainsi que des bonnes passes supplémentaires avec une aiguille de calibre plus large (comme 18G) pour récupérer un échantillon supplémentaire pour les blocs de cellules.
Pendant l'aspiration pad antérieure graisse, le tissu fibroadipose cohésive n'aspire pas bien avec des aiguilles plus fines. La préparation des blocs de cellules et microscopie électronique sont importantes pour l'évaluation des petites parois des vaisseaux sanguins dans les fragments de tissus dans le fibroadipose aspire la graisse. Aiguilles de calibre plus large (comme 18G) sont recommandées pour rendement diagnostique matériel adéquat 2,10. Comme la procédure est comparable à la FNAB conventionnelles, l'aspiration coussinet adipeux est considéré comme la FNAB, même si des aiguilles de calibre plus large peut être utilisée pour réaliser qu'il 5.
Déclarations de divulgation
Remerciements
Nous remercions Mme Bonnie Phetteplace, RN pour l'assistance au cours de la démonstration vidéo graphique procédure de la FNAB.
matériels
Tampons d'alcool, compresses de gaze, marqueur, 10 ml seringues x2, 1% de lidocaïne (anesthésique local Si la lidocaïne est utilisée seule, elle provoque une sensation de brûlure initiale après l'instillation. Ceci peut être évité en utilisant un mélange 1:1 de 1% lidocaïne et 1% de sodium-bi-carbonate), de calibre 18 (G) 1 ½ pouces aiguilles x2 (pour effectuer la FNAB), 25G 1 ½ pouces d'aiguille (pour injecter un anesthésique local), porte-seringue FNA («fusil»), un bandage, flacon de glutaraldéhyde (pour la microscopie électronique), et contenant une biopsie du formol à 10%.
Références
- Westermark, P., Stenkvist, B. A new method for the diagnosis of systemic amyloidosis. Arch Intern Med. 132, 522-523 (1973).
- Devata, S., Hari, P., Markelova, N., Li, R., Shidham, V. B. Detecting AL Amyloid in Abdominal fat pad aspirates: Is Congo red sufficient?. Amyloid. , .
- Merlini, G., Bellotti, V. Molecular Mechanisms of Amyloidosis. New Engl J Med. 349 (6), 583-596 (2003).
- Shidham, V. B., Kumar, N., Cihlar, K., Varsegi, G., Markelova, N., Li, R., Hari, P. Fine needle aspiration of abdominal fat pad for diagnosis of early amyloidosis: How can the clinical role of the test be improved?. Mod Pathol. 20, 1A-380A (2007).
- Halloush, R., Lavrovskaya, E., Mody, D., Lager, D., Truong, L. D. Diagnosis and typing of systemic amyloidosis: The role of abdominal fat pad fine needle aspiration. Cytojournal. 6, 24-24 (2010).
- Hazenberg, I. I., Rijswijk, C. V. a. n., H, M. Diagnostic Accuracy of Subcutaneous Abdominal Fat Tissue Aspiration for Detecting Systemic Amyloidosis and Its Utility in Clinical Practice. Arthritis Rheum. , 54-546 (2006).
- Guy, C. D., Jones, C. K. Abdominal fat pad aspiration biopsy for tissue confirmation of systemic amyloidosis: specificity, positive predictive value, and diagnostic pitfalls. Diagn Cytopathol. 24, 181-185 (2001).
- Westermark, P. Diagnosing Amyloidosis. Scand J Rheumatol Suppl. 24, 327-329 (1995).
- Linke, R. P. Highly Sensitive Diagnosis of Amyloid and Various Amyloid Syndromes Using Congo Red Fluorescence. Virchow Arch. 436, 439-448 (2000).
- Giorgadze, T. A., Shiina, N., Baloch, Z. W., Tomaszewski, J. E., Gupta, P. K. Improved detection of amyloid in fat pad aspiration: an evaluation of Congo red stain by fluorescent microscopy. Diagn Cytopathol. 31, 300-306 (2004).
- DeMay, R. M. Fine Needle Aspiration Biopsy. The Art & Science of Cytopathology. , 465-46 (1996).
- Arbustini, E., Vrga, L., Concardi, M., Pallandini, G., Obici, L., Merlini, G. Electron and Immuno-electron Microscopy of Abdominal Fat Identifies and Characterizes Amyloid Fibrils in Suspected Cardiac Amyloidosis. Amyloid. 9, 108-114 (2002).
Erratum
Formal Correction: Erratum: Performing and Processing FNA of Anterior Fat Pad for Amyloid
Posted by JoVE Editors on 12/20/2010. Citeable Link.
A correction was made to Performing and Processing FNA of Anterior Fat Pad for Amyloid. There was an error with an author's name. The author's last name had a typo and was corrected to:
Safwan S. Jaradeh
instead of:
Safwan S. Jardeh
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon